DOI:10.20986/resed.2021.3876/2020
ARTÍCULO
SENSIBILIZACIÓN CENTRAL EN LA ARTROSIS
CENTRAL SENSITIZATION IN OSTEOARTHRITIS
J. Monfort Faure1
1Servicio de Reumatología. Hospital del Mar. Barcelona, España
ABSTRACT
Pain in patients with osteoarthritis is a social and health problem of great magnitude and is responsible for the significant functional limitation and loss of quality of life in this disease.
Despite the important advances made in the knowledge of the pathophysiological mechanisms of pain, many questions about arthritic pain remain unanswered.
One of the least studied aspects of chronic pain in osteoarthritis is the phenomenon of central sensitization.
Functional Magnetic Resonance Imaging has shown to be a useful technique for addressing this phenomenon.
Many studies carried out in patients with osteoarthritis with different degrees of sensitization show that the incidence of this phenomenon is high, that sensitized and non-sensitized patients show different patterns in terms of the magnitude of the cerebral response to pain and that the connectivity patterns differ from one disease to another.
Finally, in patients who are candidates for knee arthroplasty, it is important to evaluate the degree of sensitization prior to surgery, since it is the patients with the highest degree of sensitization who will present more torpid evolutions and higher levels of post-surgical pain.
Key words: Osteoarthritis, pain, central sensitization, functional magnetic resonance imaging
RESUMEN
El dolor de los pacientes con artrosis es un problema sociosanitario de primera magnitud y es el responsable de la importante limitación funcional y pérdida de calidad de vida en esta enfermedad.
A pesar de haberse producido avances importantes en el conocimiento de los mecanismos fisiopatológicos del dolor, son muchos los interrogantes del dolor artrósico que todavía quedan por contestar.
Uno de los aspectos menos estudiados del dolor crónico en la artrosis es el fenómeno de sensibilización central.
La resonancia magnética nuclear funcional se ha mostrado como una técnica útil para el abordaje de este fenómeno.
Diferentes estudios realizados a pacientes afectos de artrosis con distintos grados de sensibilización ponen de manifiesto que la incidencia de este fenómeno es elevada, que los pacientes sensibilizados y no sensibilizados muestran patrones diferentes en cuanto a la magnitud de la repuesta cerebral al dolor y que los patrones de conectividad difieren de una enfermedad a otra.
Finalmente, en los pacientes candidatos a artroplastia de rodilla es importante evaluar el grado de sensibilización previo a la cirugía, puesto que son los pacientes con mayor grado de sensibilización los que presentarán evoluciones más tórpidas y mayores niveles de dolor posquirúrgico.
Palabras clave: Artrosis, dolor, sensibilización central, resonancia magnética nuclear funcional
Correspondencia: Jordi Monfort Faure
JMonfort@parcdesalutmar.cat
INTRODUCCIÓN
La artrosis (OA) es la enfermedad articular más prevalente. Aproximadamente 27 millones de personas en EE. UU. y 8,5 millones en el Reino Unido sufren OA sintomática de alguna articulación (1). Las rodillas son, junto a las caderas, las articulaciones más frecuentemente afectadas debido a las cargas mecánicas que soportan a lo largo de la vida. En España el porcentaje de personas con OA sintomática de rodilla asciende al 13,83 % en pacientes mayores de 40 años (2).
El dolor asociado a la OA provoca una importante limitación en la capacidad funcional y calidad de vida de los enfermos. La disminución de la movilidad de los pacientes que padecen OA de las articulaciones de carga, fundamentalmente rodilla y cadera, es fuente de importante comorbilidad. La obesidad, la hipertensión arterial, la diabetes mellitus, la dislipemia y la depresión son las efermedades más comunmente asociadas a la OA (3). La importante comorbilidad asociada a la OA puede contribuir a empeorar el dolor y la fucionalidad de los pacientes (4).
El dolor en la OA conduce a la búsqueda de asistencia sanitaria, lo que contribuye a un importante gasto sociosanitario. Los gastos directos e indirectos asociados a la OA equivalen al 0,5 % del PIB español (5).
En las últimas décadas el concepto de OA ha cambiado. La OA ha dejado de ser una enfermedad del cartílago para convertirse en una enfermedad de toda la articulación en la que están implicados todos los tejidos de la articulares.
A su vez se han producido avances notables en el terreno de la fisiopatología y la imagen. Esto ha permitido identificar factores de progresión importantes como el edema óseo, la sinovitis y la extrusión meniscal, así como la obtención de biomarcadores solubles y de imagen (6,7).
No obstante, y a pesar de los avances logrados hasta la fecha, queda un largo camino por recorrer; se desconocen todavía muchos de los aspectos implicados en la fisiopatología del dolor que padecen los pacientes con OA.
Uno de los aspectos menos estudiados del dolor crónico en la OA es el fenómeno de sensibilización central (SC). En un porcentaje importante de pacientes se producen fenómenos de hiperestimulación a nivel periférico y central (tanto a nivel espinal como cerebral) que hacen que estímulos no nociceptivos, como los inducidos al caminar o estar de pie, sean percibidos como dolorosos.
LA SENSIBILIZACIÓN CENTRAL AL DOLOR
En situaciones de dolor crónico tras la información nociceptiva la neurona libera sustancia P y péptido relacionado con el gen de la calcitonina (CGRP). Estas dos sustancias, tras ser liberadas, se unen a receptores localizados en los neutrófilos, mastocitos y basófilos. Esta unión provoca la liberación de sustacias proinflamatorias como citocinas, histamina, cicloxigenasa (COX), prostaglandinas, eicosanoides y finalmente óxido nítrico (NO). También se libera factor de crecimiento neuronal (NGF) y pequeñas cantidades de opioides endógenos. Todo esto induce la amplificación de la señal en lo que se conoce como sensibilización periférica (8).
Existe también una SC. Ante la llegada de una señal aumentada desde la periferia se produce un aumento en la liberación de glutamato que se une a sus receptores postsinápticos (receptor propio del glutamato [NMDA] y receptor metabotrópico del glutamato). Como consecuencia aumenta la síntesis de COX y NO en la neurona postsináptica (8).
El dolor crónico provoca además la aparición de ramificaciones de colaterales axónicas, que aumentan la aferencia nociceptiva, así como una cierta pérdida de la inhibición procedente de las vías descendentes junto a una menor liberación de opioides endógenos y degeneración celular de dichas neuronas (8).
Las respuestas neuronales son entonces exageradas (hiperalgesia) o bien los estímulos normalmente inocuos se perciben como dolorosos (alodinia). La hiperalgesia y la alodinia son dos de los componentes característicos del fenómeno de SC.
LA SENSIBILIZACIÓN CENTRAL EN ARTROSIS
En los últimos años hay una evidencia creciente sobre la importancia del fenómeno de la SC en la OA. De hecho, la inflamación y el edema óseo, que son hallazgos frecuentes en la OA contribuyen de forma importante a la sensibilización de los nociceptores en las enfermedades musculoesqueléticas. En la OA se observa de forma habitual una disociación clínico-radiológica que responde en gran manera a fenómenos de SC. También se observa la presencia de dolor en áreas perilesionales que diversas publicaciones atribuyen al fenómeno de sensibilización. Niveles altos de dolor mantenidos durante mucho tiempo se relacionan con un aumento del nivel de SC (9).
En 2014, Lluch y cols. publicaron una revisión sistemática de la literatura en la que se incluyeron 36 artículos. Los autores concluyen que en la OA de larga evolución frecuentemente está presente un cierto grado de sensibilización del sistema nervioso central y que este fenómeno está relacionado con el tipo de dolor que los pacientes que padecen OA, presentan (10).
No obstante, los mismos estudios concluyen que el estudio y tratamiento del fenómeno de SC se encuentra en sus inicios y que son necesarios más estudios con metodología más precisa para abordar correctamente esta cuestión (10).
LA SENSIBILIZACIÓN CENTRAL EN ARTROSIS Y LA RMN FUNCIONAL
Estudio del dolor mediante resonancia magnética nuclear funcional
La RNM funcional (RMNf) es una técnica de imagen capaz de identificar la activación cerebral al dolor mediante la evaluación indirecta de cambios en la microvasculatura cerebral; de hecho, detecta los cambios metabólicos y vasculares focales de nuestro cerebro basándose en su sensibilidad a los efectos magnéticos causados por la modulación del estado oxigenado de la hemoglobina. De esta manera, permite detectar la activación de regiones cerebrales que responden a un estímulo doloroso o la “matriz neural del dolor”, por lo que, además, es una herramienta útil para evaluar el efecto analgésico de un determinado fármaco (11).
El dolor es una experiencia desagradable como resultado de la estimulación de fibras sensoriales y un procesamiento emocional y cognitivo, que pueden experimentar los seres vivos con sistema nervioso central, como consecuencia de una alteración somática o de daño interno o externo (12). Estas tres dimensiones que se observan en la definición (la sensorial, emocional y cognitiva) son las clásicas dimensiones del dolor propuestas por Melzack y Casey (1968) (13).
Gracias a la neuroimagen funcional sabemos que diversas regiones anatómicas integran la experiencia dolorosa y modulan la respuesta cerebral ante un estímulo considerado nociceptivo (14). La implicación de diferentes componentes y la participación de diferentes áreas cerebrales en el dolor justifican el hecho de que, más que especular sobre una localización neuroanatómica del dolor, se hable de un circuito neuronal cuyas estructuras integrantes tengan un papel definido en la modulación de la percepción y de la experiencia dolorosa (11).
En dicho circuito se puede hablar de dos sistemas: el nociceptivo y el antinociceptivo. En el primero, que implica la proyección desde las vías espinales ascendentes hasta el sistema nervioso central, se han propuesto dos vías funcionales: la vía espinotalámica lateral y la vía espinotalámica medial. La primera se proyecta al núcleo ventroposterolateral del tálamo y a la corteza somatosensorial y se involucra en la transmisión y discrimicación sensorial del dolor.
La segunda se proyecta hasta el tálamo y del tálamo hasta la corteza cingulada anterior, la amígdala y el hipotálamo, y se encargaría de procesar el componente somático y emocional de la experiencia dolorosa. Este modelo clásico no contempla la dimensión cognitiva del dolor (11).
La percepción del dolor estaría mediada por un mecanismo/vía ascendente (estímulo conducido) y una vía descendente. El sistema nociceptivo (modulación cerebral ascendente) es esencial para que un individuo pueda reaccionar a situaciones dolorosas potencialmente peligrosas. Por el contrario, el sistema antinociceptivo (modulación cerebral descendente) se asocia con las conductas de anticipación y expectación al dolor y con los factores cognitivos relacionados con el mismo. El equilibrio entre ambos mecanismos es crucial para la percepción del dolor. Una alteración, bien estructural, bien funcional, en la interacción entre ambos mecanismos puede contribuir al desarrollo o mantenimiento de los estados de dolor crónico (11,13).
Evidencia del fenómeno de sensibilización central en artrosis mediante RMNf
En 2017, los Servicios de Reumatología y Neuroimagen del Hospital del Mar de Barcelona llevaron a cabo un estudio con el objetivo de evaluar la magnitud y las características del fenómeno de SC en pacientes afectos de OA de rodilla. Para ello se reclutaron 30 controles sanos y 60 pacientes con OA de rodilla (30 pacientes con SC y 30 pacientes no sensibilizados) (15). Los pacientes fueron seleccionados de forma consecutiva del dispensario monográfico de OA del Servicio de Reumatología del Hospital del Mar y la muestra de voluntarios sanos estaba compuesta por familiares de los pacientes. Ambas muestras se balancearon por edad y sexo y se establecieron criterios estrictos de exclusión relacionados con el consumo de fármacos y otras patologías asociadas. A todos los pacientes se les pasaron las escalas y cuestionarios VAS, WOMAC y PAIN DETECT para determinar si eran candidatos a participar. Se evaluaron 10 puntos de la versión extendida del mapa peripatelar de Arendt-Nielsen (9). Se caracterizaba la presencia de SC por la respuesta aumentada al dolor o hiperalgesia y sumación temporal. Una vez confirmada la elegilibilidad de los voluntarios, se les practicó una RMNf en la que se registraba la actividad cerebral mientras se les realizaban 5 secuencias: en primer lugar se recogía la actividad del cerebro en reposo; seguidamente, ejerciendo una presión de 2,5 kg/cm2, se les presionaba la interlínea medial mediante un algómetro; inmediatamente después se volvía a recoger la actividad cerebral en estado de reposo; a continuación se ejercía una presión de 4 kg/cm sobrela tibia y finalmente, se utilizaba estimulación térmica en el antebrazo utilizando temperaturas máximas de 45 °C.
Lo primero que se hizo evidente es que se trataba de un fenómeno imposible de dicotomizar, ya que la sensibilización es un fenómeno gradual.
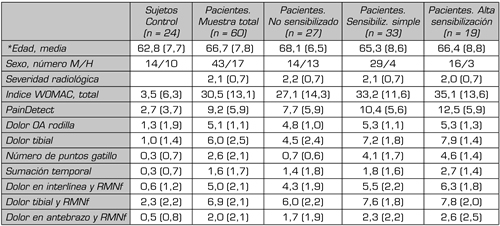
Del total de pacientes artrósicos 19 cumplían todos los criterios de Arendt-Nielsen, mientras que 14 pacientes mostraban solo algún criterio de SC. A nivel clínico lo más destacable fue la magnitud del fenómeno, ya que, en función de los resultados el 32 % de los pacientes estaban totalmente sensibilizados y el 55 % de los pacientes presentaban algún grado de SC (Tabla I).
Tabla I. Características clínicas de los pacientes OA sensibilizados y no sensibilizados y controles sanos

En el ámbito de la neuroimagen el primer resultado a destacar fue que todos los pacientes mostraron una activación de la totalidad de las áreas relacionadas con la matriz del dolor.
Cuando se compararon los subgrupos extremos de pacientes (totalmente sensibilizados vs. no sensibilizados) se detectó una mayor activación de la unión occipitotemporoparietal en el primer grupo. Esta activación desaparecía al incluir en el análisis el subgrupo de pacientes parcialmente sensibilizados. Estos resultados son consistentes con la hipótesis de partida; la interlínea articular es una zona dolorosa en todos los pacientes por la propia fisiopatología de la OA y, por tanto, no es una zona idónea para discriminar aquellos pacientes que están sensibilizados de los que no lo están. Así pues, la interlínea interna es una zona de sensibilización periférica y no central.
Por el contrario, la estimulación sobre la tibia sí permite observar diferencias entre las medias de activación de los tres grupos. Al comparar el grupo de pacientes sensibilizados con el de no sensibilizados, los primeros muestran mayor activación en regiones de la matriz neural del dolor que incluyen áreas primarias somatosensoriales bilaterales, el giro supramarginal (con mayor implicación del hemisferio derecho), la mayor parte de la corteza motora primaria derecha, la ínsula, los ganglios basales y la corteza auditiva. Al incluir en el análisis a los pacientes parcialmente sensibilizados, las diferencias, aunque más discretas, continuaron siendo significativas (Figura 1).
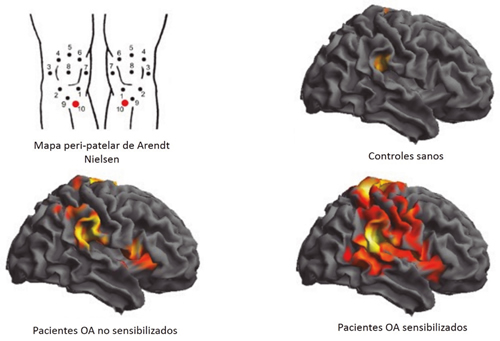
Fig. 1. Respuesta cerebral a la presión sobre la tibia (círculo rojo en el mapa peripatelar de Arendt-Nielsen) en pacientes OA sensibilizados y no sensibilizados así como en controles sanos.
A diferencia de la interlínea, la tibia es un punto alejado de la articulación que no debería ser doloroso en la OA, ya que no se relaciona anatómicamente con la degeneración de las estructuras articulares. Estos resultados fueron consistentes con la idea de que los pacientes sensibilizados tienen una respuesta cerebral diferente de los que no lo están.
Posteriormente se utilizaron los datos de todos los pacientes y se realizaron correlaciones de los datos de imagen de la secuencia de la tibia con diferentes variables clínicas. Los datos mostraron que, cuanto más bajo era el umbral del dolor, mayor activación cerebral se detectaba en áreas somatosensoriales, giro supramarginal, corteza parietal, putamen ventral bilateral, corteza cingulada anterior y cortezas visual y auditiva.
La participación de regiones anteriores como el cíngulo anterior y el putamen ventral bilateral sugieren que el fenómeno de sensibilización central podría estar mediado por comportamientos aprendidos (por ejemplo, la asociación del dolor a situaciones del día a día).
Por último, los resultados de la secuencia de estimulación térmica del antebrazo en la que se pretendía contrastar si la sensibilización se extendía a otras regiones distanciadas de la pierna mostraron que la activación cerebral fue similar en todos los grupos, indicando que la SC en la OA es un fenómeno localizado o regional.
Por lo que atañe a la conectividad cerebral, se obtuvieron resultados en estado de reposo pre y posestimulación dolorosa, y se compararon con un estudio similar realizado en pacientes con fibromialgia (FM) (16).
Determinadas revisiones de la literatura sugieren que los pacientes con OA que están sensibilizados pueden mostrar ciertas similitudes con los enfermos afectos de FM. No obstante, estos resultados muestran que, si bien ambas patologías comparten ciertas anomalías en alguna región cerebral, en realidad se trata de dos entidades claramente diferenciadas (16).
En la secuencia de reposo previa a la estimulación dolorosa se observó que los pacientes con FM manifiestaron una reducción de la conectividad global de las áreas somatosensoriales primarias, ínsula posterior, áreas temporales de procesamiento de información auditiva y áreas occipitales o de procesamiento de información visual (16).
En la OA, sin embargo, esto no sucedía; estas mismas áreas no están hipoconectadas en situación de reposo, por lo que a las regiones hiperconectadas respecta, se observó un aumento de la conectividad en áreas sensoriales secundarias y la ínsula en ambas patologías (16).
Cuando en estos mismos mapas cerebrales se fija una semilla en áreas sensoriales secundarias, para dilucidar qué regiones muestran conectividad simúltánea con ellas, se observa que los pacientes con OA manifiestan un descenso de la conectividad con respecto al cíngulo anterior, precisamente lo contrario que se oberva en la FM (16).
Si tomamos como referencia el test de estimulación sobre la tibia, se aprecia otra gran diferencia en ambas patologías: el dolor de los pacientes OA con SC se traduce en su gran mayoría en una activación de áras sensoriales, mientras que en la FM se obtienen además áreas frontales (15). Las áreas frontales podrían estar regulando en estos pacientes aspectos más cognitivos de la experiencia dolorosa, como las atribuciones al dolor, la capacidad de inhibición o aspectos relacionados con el afrontamiento (15).
Cuando el análisis en reposo se hizo escasos minutos después de haber provocado dolor, se observaron diferencias de conectividad entre el grupo de pacientes sensibilizados vs. OA con dolor nociceptivo no sensibilizados. En concreto se detectó un aumento de conectividad en la ínsula. Este hallazgo deja costancia de la huella que deja el dolor en este subgrupo de pacientes, una vez el estímulo doloroso ha desaparecido. Únicamente este subgrupo de pacientes sensibilizados y no todos los pacientes con OA continúan con una importante activación cerebral de la ínsula, la región que integra la información sobre el tipo de estímulo (si duele o no, si es una sensación de presión o punzante o de dónde viene) con la sensación visceral o el estado interno que provoca dolor (15).
Por último, se utilizó la misma semilla, ubicada en el área somatosensorial secundaria, con la finalidad de observar su conectividad respecto a otras regiones. Al comparar ambos subgrupos de pacientes con OA, se replicaron los resultados obtenidos durante la fase de reposo previa al estímulo doloroso aunque de manera más evidente y con un mayor nivel de significación estadística. Se apreció un incremento de conectividad respecto a la ínsula y un descenso en relación al cíngulo anterior (15) (Figura 2).
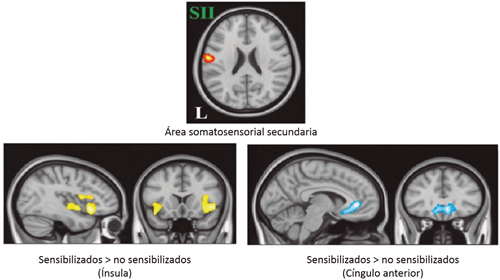
Fig. 2. Conectividad cerebral en reposo posterior a estimulación dolorosa, entre el área somatosensorial secundaria y la ínsula (hiperconectividad) y el cíngulo anterior (hipoconectividad).
A pesar de los avances en el conocimento de la OA, un número no despreciable de ellos require la colocación de una prótesis en las fases más avanzadas de su enfermedad. Sin embargo, entre un 20-30 % de los pacientes sometidos a artroplastia siguen padeciendo dolor después de la intervención. Se ha postulado que la SC al dolor previa a la cirugía podría ser una causa importante del fracaso de una parte de estas intervenciones.
Soni y cols. realizaron en 2019 un estudio para evaluar la influencia de la SC en el dolor severo y continuo de algunos pacientes con OA de larga evolución sometidos a artroplastia de rodilla. En este estudio los investigadores compararon pacientes con y sin SC previa a la cirugía y demostraron que los pacientes con SC tenían más dolor y una evolución más tórpida que aquellos pacientes que padecían únicamente dolor nociceptivo. A pesar de que la muestra limitada de pacientes no permitió extraer conclusiones clínicamente significativas, el estudio mediante RMN funcional postuló al cíngulo anterior, como el área clave en los trastornos de conectividad de los pacientes con OA de rodilla y SC (17).
CONCLUSIONES
La incidencia de la SC dentro del grupo de pacientes artrósicos es elevada. De hecho, hasta un 55 % de los pacientes que consultan de forma habitual por su OA de rodilla presentan un cierto grado de sensibilización.
Otro hecho importante es que, aunque en la práctica clínica diaria los pacientes con OA de rodilla parezcan tener patrones comunes de dolor, en realidad los pacientes sensibilizados difieren de los no sensibilizados tanto en la magnitud del dolor subjetivo provocado como en la estimulación de la presión tibial anterior y en la magnitud de la respuesta cerebral.
La RNM ha demostrado ser una técnica de imagen capaz de discriminar patrones de opuestos de conectividad funcional en la FM y en la OA, dejando en evidencia que la SC ocurre de una forma muy diferente en ambas patologías. En concreto, se podría hablar del cíngulo anterior como una región clave involucrada en este fenómeno de SC en la OA, que abre nuevas líneas de investigación y a la que sin duda habrá que prestar mayor interés en un futuro próximo.
Por último, es importante comentar que la SC es un elemento clave a tener en cuenta en aquellos pacientes con OA de rodilla que deciden someterse a una artroplastia. No en vano aquellos pacientes previamente sensibilizados serán los que a la postre presentarán niveles mayores y más prolongados de dolor después de la intervención quirúrgica.
El fenómeno de la SC en la OA debería tenerse en cuenta en nuestras consultas diarias para valorar de forma más precisa la mejor opción terapéutica para nuestros pacientes.
BIBLIOGRAFÍA