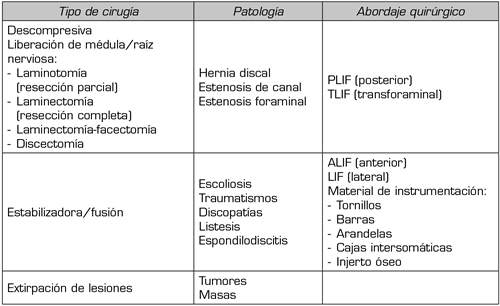
PLIF: fusión intersomática lumbar posterior. TLIF: fusión intersomática lumbar transforaminal. ALIF: fusión intersomática lumbar anterior. LIF: fusión intersomática lumbar lateral
DOI: 10.20986/resed.2021.3921/2021
EDITORIAL
UTILIDAD O NECESIDAD DE LA KETAMINA EN ELDOLOR POSTOPERATORIO
USEFULNESS OR NECESSITY OF KETAMINE IN POSTOPERATIVE PAIN
M. Monerris Tabasco1
2Unidad del Dolor. Hospital Universitario Germans Trias i Pujol. Badalona, Barcelona, España
Correspondencia: Mar Monerris Tabasco
mmmonerris.germanstrias@gencat.cat
Cuando se me ofreció la oportunidad de escribir el editorial del artículo “Efectividad del uso de ketamina perioperatoria en pacientes sometidos a cirugía de raquis en tratamiento crónico con opioides”, la primera persona en la que pensé fue el Dr. Jaume Canet, referente en la especialidad de Anestesiología, Reanimación y Terapéutica del Dolor, humano, profesional, y a su vez un apasionado de la ketamina (1).
La ketamina es un antagonista no competitivo del receptor N-metil-D-aspartato (NMDA) con un efecto analgésico a dosis subanestésicas (2).
Es obvio que, debido al aumento en la incidencia de la cirugía de raquis por distintas patologías (Tabla I), se dan simultáneamente varios condicionantes que dificultan y/o complican el control del dolor agudo postoperatorio (3).
Tabla I. Cirugía de raquis

PLIF: fusión intersomática lumbar posterior. TLIF: fusión intersomática lumbar transforaminal. ALIF: fusión intersomática lumbar anterior. LIF: fusión intersomática lumbar lateral
El dolor intenso originado por la disección y manipulación quirúrgica (tejidos osteotendinosos, musculares, radiculares, meníngeos, etc.) conduce a un estado perioperatorio de sensibilización nociceptiva, en el que está implicado la estimulación del receptor NMDA. Por ello, el bloqueo del receptor NMDA se plantea como una estrategia terapéutica para mejorar el control del dolor postoperatorio en la cirugía de raquis (4).
Teniendo en cuenta que casi un 25 % de los pacientes que se someten estos tipos de cirugías son consumidores crónicos de opioides, es importante realizar un adecuado manejo perioperatorio, con el objetivo de promover una analgesia satisfactoria y, sobre todo, prevenir el síndrome de abstinencia (3).
La evidencia en cuanto al manejo de los pacientes consumidores crónicos de opioides es muy escasa; sobre todo está basada en casos clínicos, series pequeñas y como siempre en opiniones de expertos. No obstante, ante la escasez de guías tenemos que asistirlos en las 3 etapas del perioperatorio (Tabla II):
Tabla II. Etapas del perioperatorio en pacientes consumidores crónicos de opioides
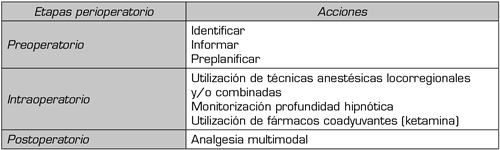
Hay que decirle al paciente que va a ser más complicado el manejo de su dolor. Este es el momento de explicar en la consulta, lo más importante: el día de la intervención no ha de suspender/modificar el opioide (dosis), ni cambiar la vía de administración. También se le informará de que va a disponer de unos dispositivos (elastómeros, PCA [Patient Controlled Analgesia]), a través de los cuales se le administrará los analgésicos.
La anestesia locorregional proporciona un adecuado control de la nocicepción, y por tanto evita la hiperalgesia inducida por opioides.
También es imprescindible la monitorización de la profundidad hipnótica en los pacientes consumidores crónicos de opioides, precisamente por un riesgo incrementado de despertar intraoperatorio.
Hasta la actualidad se han empleado fármacos que si utilizamos intraoperatoriamente nos disminuyen el consumo de opioides. Se han publicado revisiones, metanálisis de los alfa-2 agonistas (5), entre los cuales está la clonidina y la dexmetomidina, así como los gabapentinoides (6), pero de todos los coadyuvantes el que con mayor frecuencia se utiliza es la ketamina (7).
Aunque la dosis óptima no está establecida, un bolus de ketamina a dosis subanestésicas (0,2-0,75 mg/kg vía intravenosa) junto con una perfusión intraoperatoria a dosis bajas (2-10 mcg/kg/min vía intravenosa) disminuye intraoperatoriamente el empleo de analgésicos (opioides y no opioides), e infiere una reducción del consumo de analgésicos en el dolor crónico durante semanas más tarde (8,9).
Se ha observado que el uso de ketamina en perfusión intravenosa, junto con cloruro mórfico mediante dispositivos PCA en una proporción 1:1, es estable y reduce el consumo de opioide (12,13), así como una disminución en las náuseas y vómitos postoperatorios y en los efectos psicomiméticos (14). Sin embargo, dosis mayores de 25-30 mg/día de ketamina no aumentan el efecto ahorrador de opioide y podría ocasionar alucinaciones.
De esta manera, la ketamina administrada perioperatoriamente por vía intravenosa a dosis subanestésicas (Tabla III):
Tabla III. Dosis perioperatoria de ketamina intravenosa

El artículo “Efectividad del uso de ketamina perioperatoria en pacientes sometidos a cirugía de raquis en tratamiento crónico con opioides” que se publica en este número de la Revista de la Sociedad Española del Dolor, nos aporta gracias a la administración intraoperatoria de ketamina, así como su combinación con cloruro mórfico en el postoperatorio, un excelente protocolo analgésico multimodal, efectivo y seguro para el control del dolor agudo en las primeras 48 horas tras la cirugía.
BIBLIOGRAFÍA