DOI: 10.20986/resed.2022.3943/2021
ORIGINAL
USO DE TOXINA BOTULÍNICA EN EL DOLOR TRAS AMPUTACIÓN
USE OF BOTULINUM TOXIN FOR PAIN AFTER AMPUTATION
R. Sepulcre Agulló1
R. Gálvez Mateos2
R. Pozuelo Calvo3
1Servicio de Medicina Física y Rehabilitación. Hospital Universitario Fundación Jiménez Díaz. Madrid, España
2Servicio de Anestesiología y Reanimación. Hospital Universitario Virgen de las Nieves. Granada, España
3Servicio de Medicina Física y Rehabilitación. Hospital Universitario Virgen de las Nieves. Granada, España
RESUMEN
Introducción: Una amputación es un suceso demoledor para todo paciente que lo sufre, puesto que presenta un cambio importante, interfiriendo en la esfera física, psíquica y social del individuo, requiriendo una adaptación y reacondicionamiento progresivo. Uno de los puntos más importantes a controlar ante esta situación es el dolor del muñón, puesto que en muchas ocasiones será aquello que realmente determine la calidad de vida del paciente. En los últimos años, se ha estudiado la utilidad de la toxina botulínica para el tratamiento del dolor con resultados esperanzadores.
Objetivo: Realizar una revisión sistemática de la literatura científica existente, sin restricción de año de publicación, sobre el empleo de la toxina botulínica en el dolor de los pacientes amputados, para agrupar los datos existentes.
Métodos: La literatura se extrajo de PubMed, EMBASE, Cochrane, Clinical Key, Science Direct, Medes, Dialnet, Scielo y Google Schoolar. Se definió como único criterio de exclusión estudios realizados en no humanos. Se incluyeron todos los documentos relacionados con el objetivo de la búsqueda, independientemente de año, idioma, sexo, edad, tipo de amputación o toxina botulínica. De los 1795 estudios hallados tras la búsqueda inicial, se seleccionaron 19. Los niveles de evidencia corresponden a 2B, grado de recomendación B (2 estudios piloto, aleatorizados, doble ciego, con grupo control) y 4C (2 estudios observacionales longitudinales prospectivos, 15 casos clínicos).
Resultados: Se estima una mejoría para el dolor residual del muñón ± sensación del miembro fantasma del 80,43 % (74 pacientes) y un alivio del dolor del miembro fantasma ± dolor residual del 65,22 % (60). Se describe una ausencia de modificación del dolor del miembro fantasma para 32 pacientes (34,7 %) y ausencia de alivio del dolor residual en 18 pacientes (19,57 %). En ningún estudio se refleja un empeoramiento de la clínica.
Conclusiones: El presente estudio sugiere una mejora y alivio del dolor del miembro fantasma y del dolor residual, en los pacientes tratados con toxina botulínica con un nivel de evidencia 2B, grado de recomendación B. Son requeridos estudios futuros para confirmar los datos obtenidos.
Palabras clave: Toxina botulínica, amputado, amputación, muñón, dolor residual, muñón doloroso, miembro fantasma
ABSTRACT
Introduction: An amputation is a devastating event for all patients who suffer it. It introduces significant changes in the patient’s physical, psychic and social spheres. It requires progressive adaptation and reconditioning. Stump pain is one of the most important points in order to control this situation as, on many occasions, it will be what truly determines the patient’s life quality. In the recent years, the usefulness of botulinum toxin was studied for pain treatment with encouraging results.
Objetive: Provide a systematic review on existing scientific literature, with no restrictions on publication year, about the use of botulinum toxin for the pain of amputated patients in order to compile the existing data.
Methodology: Literature was retrieved from PubMed, EMBASE, Cochrane, Clinical Key, Science Direct, Medes, Dialnet, Scielo and Google Schoolar. The only exclusion criterium was studies carried out on non-human. All documents related to the objective of this research were included independently of year, language, sex, age, type of amputation or botulinum toxin. From 1795 studies found after initial research, 19 studies were selected. The levels of evidence are pertained to 2b, degree of recommendation B (2 pilot studies, randomised, double-blind, with control group) and 4C (2 observational and longitudinal prospective studies, 15 clinical cases).
Results: It is estimated that an 80.43 % (74 patients) improvement of stump residual pain and/or of the sensation on the phantom limb and a 65.22 % (60 patients) relief of the phantom limb pain and/or of the residual pain. An absence of change of the phantom limb pain was described by 32 patients (34.7 %) and an absence of relief of residual pain was reported on 18 patients (19.57 %). No studies reflect a deterioration of the disease.
Conclusions: The current study suggests improvement and relief of pain of the phantom limb pain as well as the residual pain in patients treated with botulinum toxin with a 2B level of evidence, degree of recommendation B. Future studies are required to confirm the obtained data.
Key words: Botulinum toxin, amputee, amputated, amputation, residual limb pain, stump pain, phantom limb pain
Correspondencia: Raquel Sepulcre Agulló
raquelsepulcre@gmail.com
Recibido: 18-09-2021
Aceptado: 22-02-2022
INTRODUCCIÓN
Una amputación es la separación de una o más partes de cuerpo, por lo general, secundaria a un traumatismo o en el contexto de una intervención quirúrgica como consecuencia de una lesión o enfermedad.
Epidemiología
Existen muy pocos estudios de fiabilidad que recojan datos estadísticos sobre pacientes amputados. Basándonos en los datos de la National Health Interview Survey (NHIS), existen aproximadamente 1,6 millones de americanos con algún miembro amputado (1). La Amputee Coalition estima que existen unos 2 millones de personas amputadas en EE. UU., con una incidencia aproximada de 185.000 amputaciones por año (2). El estudio de conducta y epidemiología de Ziegler-Graham y cols. (3) predice que en el 2050 vivirían aproximadamente 3,6 millones de personas con algún miembro amputado.
De forma general, las causas más frecuentes en relación con la pérdida de miembros son enfermedades vasculares (54 %), traumáticas (45 %) y cáncer (menos del 2 %) (2), siendo hasta 11 veces más frecuentes en la extremidad inferior (4), en varones (5) y hasta en 2/3 en pacientes mayores de 60 años (6).
Afectación funcional y calidad de vida
El porcentaje de depresión en estos pacientes gira en torno al 18-35 % (5,6). Un adecuado control del dolor en el postoperatorio favorecería una mejora en los síntomas de ansiedad y depresión, por lo que podría facilitar una mejor participación en la rehabilitación posterior (6,7). Las personas amputadas suelen participar en menos actividades sociales y se encuentran más insatisfechas en el trabajo, además de afectarse también la sexualidad (6). Otras complicaciones funcionales secundarias al dolor del miembro fantasma son alteración del sueño, mala tolerancia protésica, dificultad para la deambulación e incapacidad laboral (8).
El dolor, por tanto, es un síntoma que afecta en todas las esferas y resulta esencial su control y manejo para una correcta participación en el programa de rehabilitación y mejora de la calidad de vida tras una amputación.
Dolor en muñón
Las secuelas neurológicas que aparecen tras la pérdida de una parte del cuerpo pueden ser dolorosas o no dolorosas (5,9,10). Estas se pueden dividir en tres categorías diferentes según las percepciones del individuo:
Según el estudio transversal realizado por Ephraim y cols., realizado con una muestra de 914 personas con amputación, hasta un 95 % refería presentar alguna de estas tres sensaciones descritas previamente (9,12).
En muchas ocasiones coexisten en un mismo individuo y puede ser difícil diferenciarlos. La sensación de miembro fantasma no suele ser debilitante, mientras que el dolor del miembro fantasma y el dolor residual pueden llegar a limitar mucho funcionalmente al paciente (5). En ocasiones, se pueden encontrar también otros tipos de dolor, como aquel referente a la herida quirúrgica.
Tratamiento
En la actualidad se dispone de evidencia científica de calidad muy limitada que nos permite elaborar guías clínicas de tratamiento específico. Según la última revisión de la Cochrane (13), se contemplan como tratamiento la toxina botulínica, opioides (morfina), antagonistas de los receptores NMDA (memantina, ketamina, dextrometorfano), anticonvulsionantes (gabapentina), antidepresivos (amitriptilina), infusión de calcitonina y anestésicos locales (bupivacaína, lidocaína).
Toxina botulínica
La toxina botulínica, neurotoxina producida por diferentes serotipos de la bacteria Clostridium botulinum, es comúnmente utilizada en el tratamiento de síndromes dolorosos relacionados con espasmos musculares, gracias a la inhibición de la liberación de acetilcolina en la unión neuromuscular (14). Recientemente se han apreciado propiedades analgésicas independientes de su efecto sobre la transmisión neuromuscular (15,16). Según varios estudios, la toxina botulínica podría interferir en la reducción de la liberación de neuropéptidos y neurotransmisores como sustancia P, glutamato y CGRP, inhibición de canales de sodio y de la descarga en el huso muscular y atenuación de la inflamación local perineural (17,18,19), consiguiendo así una disminución de la sensibilización periférica y, de forma indirecta, de la sensibilización central (20).
OBJETIVO
Siguiendo la línea desarrollada en la introducción, queda de manifiesto que el objetivo principal de este trabajo es realizar una revisión sistemática de la literatura científica existente en la actualidad, con el fin de agrupar y analizar los estudios cuyo contenido haga referencia al empleo analgésico de la toxina botulínica en el dolor de los pacientes amputados, incluyendo tanto el dolor de miembro fantasma como el dolor residual del muñón.
Si bien no es tarea sencilla, se analizarán de forma incisiva los estudios publicados en cada artículo para extraer de forma individualizada los resultados obtenidos y, así, poder realizar una aproximación más certera. En última instancia se busca extraer una conclusión para orientarnos hacia un correcto enfoque terapéutico de los pacientes amputados basado en la evidencia.
MÁTERIAL Y MÉTODOS
Se ha realizado una exhaustiva revisión bibliográfica sobre la literatura científica existente hasta noviembre de 2020, relacionada con tratamiento del dolor en el miembro amputado mediante el empleo de toxina botulínica. La literatura fue extraída de las siguientes bases de datos y revistas digitales, incluyendo bases de datos de idioma nacional: PubMed, EMBASE, Cochrane, Clinical Key, Science Direct, Medes, Dialnet y Scielo. Dado el limitado número de referencias publicadas sobre el tema, se decide ampliar la búsqueda para incluir literatura gris a través de Google Schoolar para obtener material procedente de repositorios científicos e institucionales, no recuperado en las bases de datos. Las palabras clave empleadas para la búsqueda fueron “botulinum toxin”, “amputee”, “amputated”, “amputation”, “residual limb pain”, “stump pain”, “phantom limb pain” [términos Mesh], utilizando los siguientes términos para las bases de datos españolas “toxina botulínica”, “amputado”, “amputación”, “muñón”, “dolor residual”, “muñón doloroso”, “miembro fantasma” [términos Desh].
Debido a que se trata de un tema novedoso con escasa literatura, en este estudio no se han tenido en cuenta criterios de exclusión como límite de año, sexo, edad, idioma, tipo de amputación o toxina botulínica. Se excluyen aquellos estudios realizados sobre tratamiento llevado a cabo en sujetos no-humanos. Se incluye todo artículo que describa o analice la respuesta del dolor en amputados tras el tratamiento con toxina botulínica.
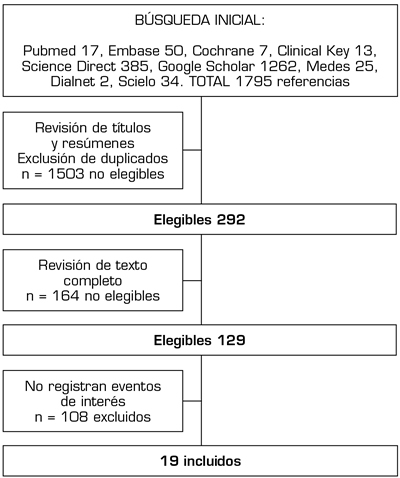
Tras la búsqueda inicial, se obtienen un total de 1795 referencias (Figura 1). En una segunda fase, después de la lectura de títulos y resúmenes, se descartan los artículos que no correspondían con el objeto de la revisión y aquellos duplicados. Se seleccionan 292 referencias para un análisis pormenorizado del texto completo, dando especial interés a su objeto y población de estudio, intervención realizada y método, características del trabajo y resultados en relación con el objetivo de la presente revisión. Se obtienen un total de 129 artículos, descartando 108 por no registrar eventos de interés. El presente artículo se centra en la revisión de 19 artículos seleccionados cuidadosamente, los cuales describen al menos 1 caso en el cual se trata con alguno de los tipos de toxina botulínica comercializada el dolor presente en un amputado, considerando como tal el dolor del miembro fantasma y el dolor residual del muñón.

Fig. 1. Proceso de selección de estudios.
Los artículos obtenidos tras la minuciosa búsqueda bibliográfica y la selección de los mismos presentan un nivel de evidencia leve, según los niveles de evidencia propuestos por el Centre for Evidence-Based Medicine de Oxford (CEBM) (21). Se trata de 15 descripciones de casos clínicos o series de casos con nivel de evidencia 4, grado de recomendación C (22-35); 2 estudios observacionales longitudinales prospectivos con nivel de evidencia 4, grado de recomendación C (36,37); y 2 estudios piloto aleatorizados y doble ciego con grupo control con nivel de evidencia 2B, grado de recomendación B (38,39) (Tabla I).
Con el fin de ampliar el valor de la muestra alcanzada, se analizan de forma individualizada los pacientes descritos en los artículos seleccionados, siempre que sea posible, en base a sus características demográficas, tipo de intervención y seguimiento y análisis del resultado. Tras una revisión metodológica y agrupación de los datos existentes en los estudios incluidos, se obtiene una revisión sistemática con nivel de evidencia 3A, grado de recomendación B (Figura 2). No se ha encontrado ningún metanálisis, revisión sistemática o estudio clínico con alto nivel de evidencia y grado de recomendación relacionado con el objetivo del presente trabajo. Por este motivo, se reafirma la necesidad de continuar con la presente revisión y promover la realización de estudios futuros con mayor nivel de evidencia clínica.
Tabla I. Características y descripción de estudios incluidos.
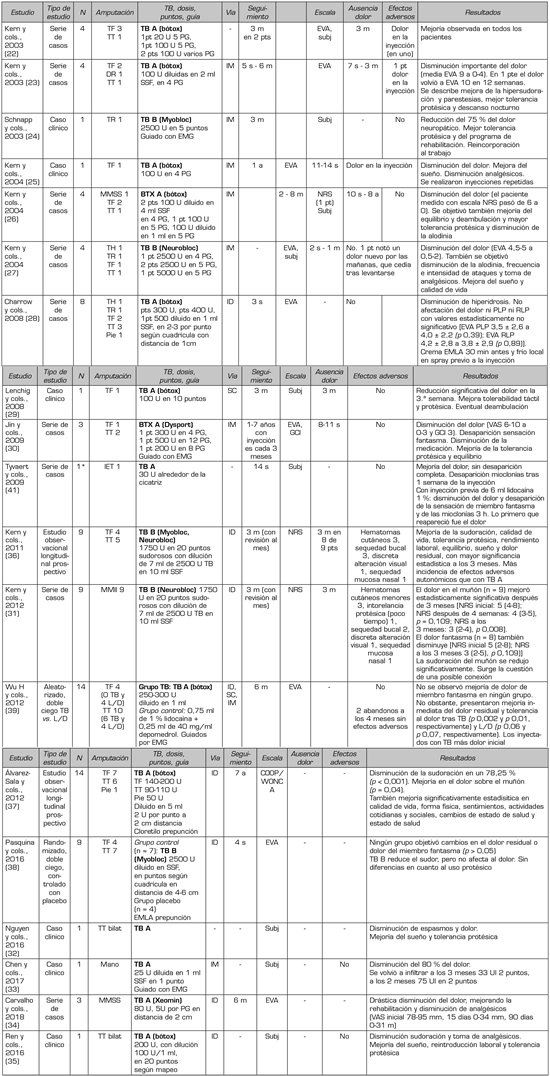
TB: toxina botulínica. L/D: lidocaína/depomedrol. IET: interescapulotorácica. TH: transhumeral. TR: transradial. TF: transfemoral. TT: transtibial. DR: desarticulación de rodilla. MMSS: miembro superior. MMII: miembro inferior. PG: punto gatillo. ID: intradérmica. IM: intramuscular. SC: subcutánea. EVA: escala visual analógica. NRS: escala numérica. CGI: escala de impresión clínica global. SUBJ: subjetividad. PT(s): paciente(s). D: días. S: semanas. M: meses. A: años.
*Esta serie de casos incluye una segunda paciente, la cual no fue amputada. Se trató por otro dolor y no se incluye en la tabla.
RESULTADOS
Todos los estudios tienen un tamaño muestral pequeño (menor de 20 participantes en cada uno), por lo que en la presente revisión se realiza un análisis conjunto de todos ellos.
Características de los estudios
En esta revisión sistemática se incluyen 19 estudios con un total de 92 participantes. El total de estudios se divide en 2 estudios piloto aleatorizados y doble ciego con grupo control (n = 23), 2 estudios observacionales longitudinales prospectivos (n = 23), 9 series de casos (n = 40) y 6 informes de un caso (n = 6). Originalmente, se obtuvo un total de 19 estudios donde se describían 93 pacientes; no obstante, se decidió excluir de la valoración y exportación de datos una paciente sin antecedentes de amputación (41). Las características y descripción de los estudios seleccionados se encuentran resumidos en la Tabla I. De entre los participantes amputados, 4 de ellos, distribuidos en 3 artículos diferentes (32,35,38), presentaban 2 amputaciones en distintas extremidades, por lo que se contabilizará un número de participantes n = 92 con un total de amputaciones n = 96, tratándose de forma independiente cada muñón en el mismo acto clínico.
Los estudios incluidos fueron publicados entre el 2003 y el 2019. La mayoría se realizó en países desarrollados de Norte América (EE. UU. [n = 7]) y de Europa (Alemania [n = 8]), Francia [n = 1] y España [n = 1]). Solamente uno se llevó a cabo en un país en vías de desarrollo (Brasil [n = 1]). Uno de los estudios no refleja la ubicación del mismo.
Datos demográficos y característicasde los pacientes
La presente revisión incluye un total de 92 pacientes (68 varones, 9 mujeres, 9 desconocido) con antecedentes personales de amputación, tanto en miembros superiores (n = 11) como de miembros inferiores (n = 85) con edades comprendidas entre 18 y 86 años (media 44,576) (Figura 2). Los niveles de amputación de los miembros superiores fueron interescapulotorácica (IET; n = 1), transhumeral (TH; n = 2), transradial (TR; n = 3) y de la mano (n = 1); y para miembros inferiores transfemoral (TF; n = 32), desarticulación de rodilla (DR; n = 1), transtibial (TT; n = 41) y pie (n = 2) (Figura 3). No se describe el nivel en 4 de los pacientes con amputación para miembro superior y en 9 para miembro inferior. En ningún estudio se valoró el tipo de lateralidad previa.
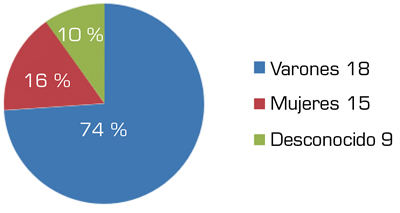
Fig. 2. Sexo.
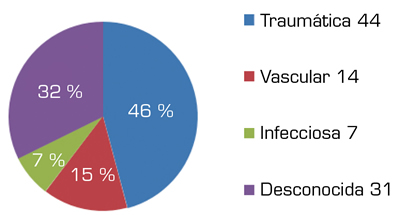
Fig. 3. Etiología.
Las causas de las amputaciones fueron traumática (n = 44), vascular (n = 14) e infecciosa (n = 7) ocurridas entre 1-28 años antes de su correspondiente estudio (media = 8,556). No quedan reflejadas las razones por las que fueron amputados 31 participantes, ni el tiempo de evolución en 56 de ellos (Figura 4).
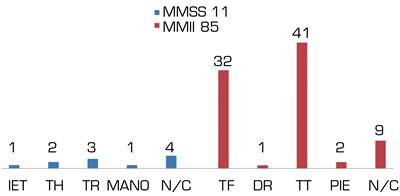
Fig. 4. Tipos de amputación.
Tratamiento recibido
En todos los artículos seleccionados, los pacientes se trataron al menos en una ocasión con infiltración de toxina botulínica (TB). Se utilizó TB tipo A en 14 de los 19 estudios (bótox 9; Xeomin 1; Dysport 1; no indicado 3) y TB tipo B en los otros 5 (Myobloc 2, Neurobloc 2, Myobloc y Neurobloc 1).
En aquellos participantes infiltrados con bótox se inyectó una dosis de entre 20 y 500 unidades (U) repartidas entre 1 y 20 puntos del muñón. En el estudio con infiltración de Xeomin se administró una dosis de 80 U, sin indicar el número de puntos. En aquel que se empleó Dysport, las dosis fueron de entre 200 y 500 U distribuidas entre 4 y 12 puntos. Los estudios que utilizaron toxina botulínica tipo B, administraron dosis mayores, infiltrándose entre 1750 y 2500 U entre 5 y 20 puntos para Myobloc; y entre 1750 y 5000 U repartidas entre 4 y 20 puntos para Neurobloc. En los artículos donde queda descrita la dilución de la toxina se emplea SSF con una cantidad de 1 a 5 ml para la TB tipo A y de hasta 7 ml para diluciones con TB tipo B.
La vía de abordaje empleada para la infiltración fue intradérmica (i.d.; n = 53), subcutánea (s.c.; n = 1) e intramuscular (i.m.; n = 18). En un artículo con n = 14 se describen las tres vías. En 3 estudios con un total de 6 participantes no se menciona la vía de abordaje. En 4 de los estudios con infiltración intramuscular se realizaron mediante guía con electromiografía (EMG) (24,30,33,39). El resto de estudios emplearon la palpación para localización de punto gatillo (PG); puntos de mayor sudor, en algunos casos mediante prueba del sudor; o en la región de la cicatriz (41). En dos estudios se realiza una distribución de los puntos a infiltrar mediante una cuadrícula o rejilla (28,38).
Para disminuir el dolor de la punción se describe el empleo de crema EMLA® (crema al 1 % lidocaína/prilocaína 25 mg/g + 25 mg/g) (38) y Cloretilo® spray (37) o ambos combinados (28).
Seguimiento y evaluación
Tras el tratamiento, se realizó un seguimiento para revisión del paciente y valoración de su evolución. El tiempo de seguimiento entre las distintas publicaciones seleccionadas es muy dispar, con un rango de 3 semanas a 7 años (moda 12; media 84,952; mediana 19).
Todos los estudios miden la mejora del dolor. Para estadificar el dolor y notificar el cambio tras el tratamiento, se realizó una cuantificación mediante el empleo de escalas del dolor en un total de 13 trabajos combinando en algunos de ellos con la subjetividad notificada por el participante. Para cuantificar el dolor se utilizó la Escala Visual Analógica (EVA, en inglés Visual Analogue Scale - VAS) en 9 estudios y la Escala Numérica del Dolor (Numeric Rating Scale - NRS) en 3 estudios. La Escala de Impresión Clínica Global (Clinical Global Impresión - GCI), que valora la gravedad y mejoría tras el tratamiento, se empleó en 1 estudio, en el cual también se empleó EVA. En otro estudio se optó por la medición de la calidad de vida relacionada con la salud mediante el cuestionario de láminas COOP/WONCA. Los 6 restantes realizan una descripción del alivio del dolor de forma cualitativa y subjetiva sin hacer uso de escalas o cuestionarios.
La mejoría funcional y de movilidad, disminución del sudor, mayor tolerancia a la prótesis y al programa de rehabilitación, reducción de la duración de las crisis de dolor y la mejora de la calidad de vida y mayor reintegración socio-laboral son cambios que se observan tras el tratamiento con toxina botulínica en los pacientes. No obstante, son 4 los trabajos en los que se estudian rigurosamente algunos de estos factores, empleando para ello el análisis gravimétrico del sudor, la prueba del sudor con almidón y yodo, el cuestionario de láminas COOP/WONCA para la calidad de vida relacionada con la salud, escalas analógicas visuales de sudor y de calidad de vida o una batería de preguntas formuladas por equipo de investigación en base a su interés. En el resto de los artículos se realiza una evaluación verbal para definir las variaciones obtenidas.
Análisis del dolor
Los pacientes presentaron una duración del alivio sintomático del dolor tras el tratamiento recibido con TB de entre 2 y 14 semanas (moda 12; mediana 10,969; mediana 12), sin cambios relevantes independientemente del tipo de TB empleada.
Para el análisis del dolor antes y después del tratamiento, se han agrupado los estudios en base al cuestionario empleado y a la subjetividad referida por el paciente.
De los 9 artículos que emplean la escala EVA para cuantificar el dolor 15 pacientes correspondientes a 8 artículos diferentes presentan una disminución en la escala de ≥ 3 puntos, pasando de un EVA inicial moderado (n = 10) y severo (n = 5), con una moda 9; media de 7,89; y mediana 9; a un EVA final leve (n = 13) y moderado (n = 2), con una moda 0, 1 y 2; media de 1,656; y mediana 1,25. En 1 paciente del estudio de Kern y cols. (22) que inicialmente presentaba EVA 10/10, se detectó una reducción al 5.º día del tratamiento del 80 % del dolor, con un EVA 10/10 a las 12 semanas y la misma intensidad de los ataques. El paciente logró reducir los analgésicos y toleró más tiempo la prótesis, pero el dolor según la escala EVA inicial y final no se modificó (Figura 5).
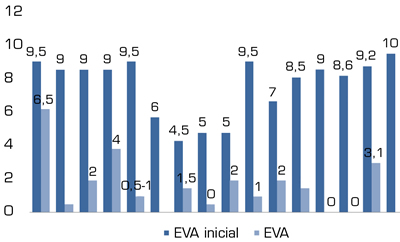
Fig. 5. EVA inicial vs. final.
El último artículo que emplea la escala EVA con n = 8, se revisa por otro lado, puesto que divide el dolor del miembro fantasma y el dolor residual del muñón (28). En ambos casos se obtiene de forma estadísticamente no significativa, una ausencia de mejoría del dolor tanto para el dolor del miembro fantasma (EVA inicial 3,5 ± 2,6; EVA final 4 ± 2,2) ni para el dolor residual (EVA inicial 4,2 ± 2,8; EVA final 3,8 ± 2,9).
De los artículos incluidos, se utiliza la escala NRS en 4 de ellos. En el artículo de Kern y cols. (26) se refleja esta escala en un solo paciente de los 4 casos clínicos, con un NRS inicial de 6 y final de 0. En otro de los estudios de Kern y cols. (36) con una n = 9, se describe una mejoría de al menos 2 puntos, con una mediana de NRS inicial para el dolor residual de 5 (4-8), en la revisión del mes NRS 4 (3-5); p = 0,109; y a los 3 meses NRS final 3 (2-4); p = 0,008. En el tercer estudio de Kern y cols. (31), se obtiene una mejoría del muñón (n = 9) estadísticamente de manera muy significativa después de 3 meses (NRS inicial: 5 [4-8]; NRS después de 4 semanas: 4 [3-5], p = 0,109; NRS a los 3 meses: 3 [2-4], p = 0,008). El último artículo que emplea la escala NRS con una n = 14 (37), no refleja la disminución numérica, si describe una mejoría en el dolor sobre el muñón (p = 0,04).
Interpretación de los resultados
De los 19 trabajos elegidos tras la revisión bibliográfica, 15 reflejan una mejoría de la clínica del dolor para el paciente tras el tratamiento con toxina botulínica en todos sus pacientes. En un estudio de Kern y cols. (36)presenta tres casos clínicos con alivio del dolor y uno sin cambios con un EVA 10 inicial y final.
En el estudio de Charrow y cols. (28) con una n = 8 y valorado con NRS, refiere no afectación para el dolor ni del miembro fantasma ni residual, con valores estadísticamente no significativo. En el estudio piloto aleatorizado con control de Wu y cols. (33) con n = 14 y valorado con la escala EVA, se describe una ausencia de mejoría de dolor de miembro fantasma en ambos grupos y mejoría inmediata de dolor residual del muñón y de tolerancia al dolor tras TB (p = 0,002 y p = 0,01) y L/D (p = 0,06 y p = 0,07). El estudio piloto aleatorizado con control de Pasquina y cols. (38), con n = 9 y medición con la escala EVA, no objetivo cambios en el dolor residual o dolor del miembro fantasma en ninguno de los grupos (p > 0,05).
Efectos adversos
Todos los efectos adversos reportados son de características leves que no compromete la vida ni la integridad del paciente. Se han descrito en 6 pacientes hematomas cutáneos menores, 4 sequedad bucal, 2 discreta alteración visual, 2 sequedad mucosa nasal, 1 intolerancia protésica temporal y dolor con la infiltración. Se describe un caso de aparición de dolor nuevo durante las mañanas, pero que cedía tras levantarse de la cama.
Según el estudio de Kern y cols. (36), se reportó mayor incidencia de efectos adversos autonómicos con TB B, abogando una probable relación con la mayor dosis empleada.
DISCUSIÓN
De acuerdo con nuestro conocimiento, esta es la primera revisión sistemática con el objetivo de agrupar la literatura existente hasta la actualidad sobre el tratamiento del dolor en amputados, tanto dolor del miembro fantasma como dolor residual del muñón, mediante la infiltración de toxina botulínica.
Los resultados de este estudio estiman una mejoría para el dolor residual del muñón ± sensación del miembro fantasma del 80,43 % (mejoría presente en 74 pacientes repartidos en 17 estudios) y un alivio del dolor del miembro fantasma del 65,22 % (60 pacientes descritos en 4 artículos diferentes). En varios de estos sujetos, la medida a estudio se obtuvo mediante la subjetividad del paciente sobre su percepción del dolor antes y después del tratamiento, reflejándose en algunos de ellos sobre escalas cualitativas del dolor (EVA, NRS). Entre ellos se incluye el estudio observacional longitudinal prospectivo de Álvarez-Sala y cols. (37)donde se refleja una mejoría del dolor sobre el muñón estadísticamente significativa (p = 0,04) y el estudio piloto aleatorizado doble ciego de Wu y cols. (39), donde presentaron mejoría inmediata del dolor residual y tolerancia al dolor tras TB de forma estadísticamente significativa (p = 0,002 y p = 0,01, respectivamente); no así para el grupo control con L/D (p = 0,06 y p = 0,07, respectivamente).
Por el contrario, se describe una ausencia de modificación del dolor del miembro fantasma para 32 pacientes (34,7 %) y ausencia de alivio del dolor residual en 18 pacientes (19,57 %), descritos en los siguientes trabajos: 1 estudio piloto aleatorizado doble ciego con grupo control (alivio del dolor residual, sin mejoría para el dolor del miembro fantasma) (39), 1 estudio piloto aleatorizado doble ciego con grupo control (p > 0,05), una serie de casos (28) con resultados no significativos [dolor miembro fantasma p = 0,39; dolor residual p 0,89)] y un caso clínico.
En los artículos revisados, se describen también otros hallazgos tras el tratamiento con TB, como son disminución de número, duración e intensidad de ataques nocturnos y mioclonías; mayor descanso nocturno; disminución de parestesias y alodinia; disminución y/o desaparición de hiperidrosis; disminución de la medicación y mayor tolerancia al dolor; mayor tolerancia protésica; mejor adaptación al tratamiento rehabilitador con mayor facilidad de manipulación; mejora del equilibrio y deambulación; mayor calidad de vida y rendimiento laboral.
En la serie de casos de Kern y cols. 2012 (31) surge la idea de una posible conexión entre la disminución de hiperhidrosis y el alivio del dolor del muñón, tras la mejora de ambos con el tratamiento mediante TB tipo B.
SESGOS Y LIMITACIONES
El trabajo elaborado dispone de los siguientes sesgos y limitaciones en su elaboración, desarrollo y síntesis:
CONCLUSIONES
Tras el análisis realizado, se puede observar una tendencia a la mejora y alivio del dolor, tanto dolor del miembro fantasma como dolor residual, en los pacientes tratados con toxina botulínica con un nivel de evidencia 2B, grado de recomendación B. No obstante, es aconsejable que los profesionales valoren el riesgo beneficio de forma individualizada y pragmática ante la posibilidad de complicaciones no descritas por escasa muestra. Se requiere llevar a cabo estudios futuros para confirmar los datos obtenidos de esta revisión.
CONCLUSIÓN PARA LA PRÁCTICA
Esta primera revisión sistemática sobre el tratamiento con toxina botulínica en el dolor del paciente amputado muestra un resultado favorable. Un correcto enfoque terapéutico podría ser beneficioso para lograr un alivio del dolor y disminución de tratamiento farmacológico, consiguiendo una mayor tolerancia al uso protésico y al tratamiento rehabilitador, mejorando así la calidad de vida del paciente.
CONFLICTO DE INTERESES
El autor correspondiente asegura no tener afiliación con empresas cuyo producto se menciona en el presente trabajo o empresas que se encarguen de la venta de productos de la competencia. Se declara no tener ningún conflicto de interés.
AGRADECIMIENTOS
A la bibliotecaria (HUPH), Dña. Cristina Escribano Gómez, por toda su dedicación, paciencia y formación hacia mi persona en el proceso inicial.
A la Dra. Azucena Jover Llopis, FEA Medicina Física y Rehabilitación (CHUVI), por su manejo y resolución en cualquier materia, ayuda y apoyo incondicional.
BIBLIOGRAFÍA