doi.org/10.20986/resed.2022.4027/2022
ARTÍCULO
CANNABINOIDES EN DOLOR NEUROPÁTICO: LUCES Y SOMBRAS
CANNABINOIDS IN NEUROPATHIC PAIN: LIGHTS AND SHADOWS
A. Serrano Afonso1
1Facultativo Especialista Adjunto. Coordinador del Grupo de Trabajo de Dolor Neuropático de la Sociedad Española del Dolor. Departamento de Anestesia, Reanimación y Clínica del Dolor. Hospital Universitario de Bellvitge. Universitat de Barcelona-Campus de la Salud, IDIBELL. Barcelona, España
RESUMEN
Objetivos: La inquietud sobre el grupo terapéutico cannabinoide ha ido creciendo en las últimas décadas, tanto a nivel de publicaciones como dentro de los socios de la Sociedad Española del Dolor. El interés sobre los cannabinoides en dolor neuropático (DN) es más reciente, siendo las primeras publicaciones desde el año 2001. El presente manuscrito recoge la información de la ponencia sobre DN y cannabinoides realizada para la Jornada del Grupo de Interés de Cannabinoides.
Material y métodos: Se realizó una revisión narrativa no sistemática. El término de búsqueda fue “cannabis medicinal” Y “dolor neuropático”. La base de datos utilizada fue PubMed Central sin límite de fechas, con idioma de búsqueda inglés. Se seleccionaron los artículos más destacados en las categorías: “metanálisis y revisiones sistemáticas”, “revisiones de expertos” y “experiencia ajena” (experiencias en otros países, tras su aprobación).
Resultados: Desde el año 2001 se han publicado 54 revisiones sistemáticas sobre cannabinoides y dolor con conclusiones contradictorias. Un análisis de las revisiones mostró una baja calidad de los propios ensayos clínicos y de las revisiones en sí. De 10 revisiones específicas sobre cannabinoides y DN, la mayoría ni definió el objetivo de dolor analizado, ni la vía de administración de los ensayos clínicos analizados, ni el tipo de agente analizado. Solo 1 cumplía criterios de alta calidad AMSTAR-2, mientras que 7 eran de calidad críticamente baja. Un metanálisis sobre la opinión de la impresión de cambio del paciente reveló un odds ratio de 2,0, (intervalo de confianza 1,37-2,94). Algunas sociedades científicas han publicado recomendaciones sobre su uso como terapias de 2.ª o 3.ª línea, pero con considerables precauciones y limitaciones. En la experiencia de otros países también se pueden observar datos contradictorios. En Tailandia el número de efectos secundarios aumentó significativamente, sobre todo con el aceite. En Israel disminuyó un 20 % la intensidad de dolor, y un 43 % de disminución de uso de analgésicos. La dosis equivalente de morfina (DEM) disminuyó un 42 %. La discapacidad mejoró un 19 %, y la calidad de vida otro 25 %. La ansiedad disminuyó un 40 % y la depresión otro 32 %, con una mejora en el catastrofismo del dolor del 17 %. Además, los pacientes reportaron una mejora del 33 % en las alteraciones del sueño, con un aumento de la duración del sueño del 14 %. Sin embargo, en Dinamarca los usuarios de tetrahidrocannabinol (THC) combinado con cannabidiol o THC puro usaron más dosis diaria de cualquier analgésico (incluyendo opioides), pero sí disminuyó el consumo de los medicamentos específicos para DN.
Conclusiones: Las revisiones sistemáticas llegan a conclusiones divergentes sobre la eficacia. Las recomendaciones de las asociaciones científicas difieren para los medicamentos a base de cannabis y el cannabis medicinal. Esto se debe a que existen lagunas de investigación. Los médicos que decidan usar medicamentos a base de cannabis o cannabis medicinal para tratar el DN deben tener en cuenta la limitada evidencia sólida del efecto y las preocupaciones por los daños derivados.
Palabras clave: Revisión, datos en tiempo real, calidad de vida, tratamiento coadyuvante
ABSTRACT
Objectives: The concern about the cannabinoid therapeutic group has been growing in recent decades, both at the level of publications and within the members of the Spanish Pain Society. The interest in cannabinoids in neuropathic pain (NP) is more recent, with the first publications dating back to 2001. This manuscript collects information from the presentation on NP and cannabinoids given for the Cannabinoids Interest Group Conference.
Material and methods: A non-systematic narrative review was carried out. The search term was “medical cannabis” AND “neuropathic pain”. The database used was PubMedâ Centralâ without date limits, with English search language. The most outstanding articles were selected from the categories: “meta-analyses and systematic reviews”, “expert reviews” and “experience from others” (experiences in other countries, after approval).
Results: Since 2001, 54 systematic reviews on cannabinoids and pain have been published with contradictory conclusions. An analysis of the reviews showed low quality of the clinical trials and of the reviews themselves. Of 10 specific reviews on cannabinoids and NP, the majority neither defined the objective of pain analyzed, nor the route of administration of the clinical trials analyzed, nor the type of agent analyzed. Only 1 met AMSTAR-2 high quality criteria while 7 were of critically low quality. A meta-analysis on the patient’s impression of change opinion revealed an odds ratio of 2.0, (confidence interval 1.37-2.94). Some scientific societies have published recommendations on their use as 2nd or 3rd line therapies, but with considerable precautions and limitations. Contradictory data can also be observed in the experience of other countries. In Thailand the number of side effects increased significantly, especially with oil. In Israel, the intensity of pain decreased by 20 %, and the use of analgesics decreased by another 43 %. Morphine Equivalent Dose (DEM) decreased by 42 %. Disability improved by 19 %, and quality of life by another 25 %. Anxiety decreased by 40 % and depression by another 32 %, with an improvement in pain catastrophism of 17 %. In addition, patients reported a 33 % improvement in sleep disturbances, with a 14 % increase in sleep duration. However, in Denmark, users of tetrahydrocannabinol (THC) combined with cannabidiol, or pure THC used more daily doses of any analgesic (including opioids), but the consumption of NP-specific medications did decrease.
Conclusions: Systematic reviews reach divergent conclusions about efficacy. The recommendations of the scientific associations differ for cannabis-based medicines and medical cannabis. This is because there are research gaps. Physicians who decide to use cannabis-based drugs or medical cannabis to treat DN should consider the limited robust evidence of effect and concerns about resulting harms.
Key words: Review, real-time data, quality of life, coadyuvant therapy
Correspondencia: Ancor Serrano Afonso
a.serrano@bellvitgehospital.cat
INTRODUCCIÓN
Ya hace más de 10 años que en la Revista de la Sociedad Española del Dolor (RESED) se comentó sobre el potencial de los cannabinoides como tratamiento (1). Esta inquietud no ha desaparecido y, de hecho, hace poco,el Grupo de Trabajo (GT) de Dolor Neuropático (DN) de la SED ya investigó sobre los conocimientos y la aplicabilidad en la práctica clínica entre sus socios (2). Sin embargo, esta cuestión no es reciente. Una breve búsqueda en PubMed para “cannabinoides” y “dolor” muestra más de 4000 resultados, siendo los primeros de principios de los años 90. La pendiente ha ido creciendo, sin apreciarse un decrecimiento de interés. Pero cannabinoides es un término muy genérico. Este engloba desde cannabis medicinal hasta diferentes fármacos derivados del tetrahidrocannabinol (THC) o del cannabidiol (CBD), o incluso una combinación de ambos. Ahora que la Comisión de Sanidad y Consumo del Congreso de los Diputados ha dado luz verde a legalizar el cannabis medicinal, regulado para aliviar el dolor, es una buena estrategia intentar centrarse en esta sustancia.
Según la Comisión, en un plazo de 6 meses desde su aprobación (27 de junio de 2022) la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) recogerá las recomendaciones para que tengan encaje en la normativa y sean viables. El informe recoge varias recomendaciones, entre las que se encuentra el dolor no oncológico. Y, una vez más, nos encontramos ante un término muy genérico que engloba muchos tipos de dolor. En este caso nos centraremos en dolor neuropático (DN). El interés sobre los cannabinoides en DN es más reciente, siendo las primeras publicaciones desde al año 2001. De hecho, en los últimos años han salido revisiones sistemáticas y metanálisis diversos. En cambio, si centramos la búsqueda solo en “cannabis medicinal” y “dolor neuropático”, se puede apreciar que el interés es aún más reciente; este aparece (y crece) a partir de 2015.
El autor de este artículo fue invitado a la Jornada realizada el 8 de marzo de 2022 por el Grupo de Interés de Cannabinoides de la SED para mejorar el conocimiento de este potencial nuevo tratamiento. Dado el creciente interés generado y la importancia del conocimiento para poder realizar una correcta indicación y prescripción, el autor realizó una búsqueda de los artículos más importantes para la ponencia. El presente manuscrito recoge la información de dicha ponencia.
MATERIAL Y MÉTODOS
Este trabajo consiste en una revisión narrativa no sistemática. El término de búsqueda fue “cannabis medicinal” Y “dolor neuropático”. La única base de datos utilizada fue PubMed Central. No hubo límite de fechas. El idioma de búsqueda fue el inglés. Se seleccionaron los artículos más destacados en las siguientes categorías: “metanálisis y revisiones sistemáticas”, “revisiones de expertos” (Key Opion Leaders [KOL] en inglés), y “experiencia ajena”, entendiendo por experiencia ajena aquellas publicaciones sobre el cannabis medicinal en otros países, tras su aprobación.
REVISIONES SISTEMÁTICAS Y METANÁLISIS
Como se ha dicho previamente en la introducción, el interés por este tema ha ido en aumento. Tanto es así que desde el año 2001 en adelante se han publicado 54 revisiones sistemáticas sobre cannabinoides y DN. De hecho, recientemente se ha publicado una revisión de revisiones (3), trabajo que desgrana completamente cada una de ellas y sus riesgos de sesgo. En esas revisiones hay ensayos clínicos totalmente variados. Entre los analizados podemos encontrar desde ensayos clínicos con cigarrillos de cannabis fumado (4), hasta moléculas de THC puras, administradas por vía sublingual (5), pasando por moléculas sintéticas como el dronabinol (6).
Sin embargo, estas revisiones sistemáticas no solo no son coincidentes, sino que muchas de ellas acaban en resultados contradictorios. Por ejemplo, el trabajo de Meng sobre 11 ensayos clínicos de moléculas sintéticas (dronabinol, nabilona y otros nabiximoles en aerosol), en un total de 1219 pacientes, encontró una diferencia significativa con una disminución de tan solo 0,65 puntos en una escala de 11 puntos de valoración de dolor (7). Esta mejoría tan solo se reportó tras dos semanas de latencia, por ello le dieron una recomendación débil con evidencia de calidad moderada.
Otro trabajo sobre cannabis o cannabinoides para diferentes tipos de dolor no oncológico analizó 48 ensayos clínicos para DN (8). De los 48 solo pudieron analizar correctamente 7, con 1100 pacientes en total. De esos 11 ensayos encontró un Ods Ratio (OR) de 1,31 (con intervalo de confianza [IC] variando entre 1,02 y 1,69) para una reducción del dolor del 30 %. Pero si analizaba la reducción del dolor del 50 %, el OR era de 1,43 con un IC de 0,97 a 2,11. En este punto hay que recordar que cuando el IC está englobando el número 1, como es el caso, no existe significación. Por otra parte, la reducción del dolor de un 50 % es un requisito de las agencias de evaluación desde 2010 (9-11). Por lo tanto, para los requisitos actuales de las agencias evaluadoras, el resultado de esta revisión no encontró significación. Este resultado coincide con otra revisión reciente, de 2021 (12), sobre varios tipos de dolor. Cuando analizaron por tipo de dolor, particularmente en DN, solo 4 ensayos clínicos cumplían todos los criterios de valoración, con un total de 835 pacientes. Según estos, la diferencia de riesgo para una reducción del dolor del 30 % era tan solo de 0,03 puntos, con un IC desde -0,07 a 0,12. En las diferencias de riesgo, una valoración negativa va a favor del placebo, mientras que la positiva va a favor de la intervención. Sucede aquí como en el OR del 50 % valorada por Stockings (8).
De hecho, uno de los principales problemas de todas estas revisiones es la baja calidad de los propios ensayos clínicos y de las revisiones en sí mismas (3,13). Esto hace que, de manera confusa, proporcionen una amplia gama de conclusiones que van desde evidencia clara de eficacia hasta exactamente lo contrario. Si se desgranan todas estas revisiones sistemáticas se puede observar que solo 10 fueron para DN. De ellas, 1 fue para cannabis sativa, otra para moléculas sintéticas (7), otra para cualquier tipo de preparación de cannabis en general. Las 7 restantes fueron para cannabinoides, sin precisar. De esas 10 revisiones, 1 revisó exclusivamente ensayos para la ruta inhalada o vaporizada, 3 indicaron que investigaban cualquier ruta. Pero en 6 casos no se pudo apreciar la ruta investigada, dado que no estaba definida. Y peor aún, si se analizan estos 10 ensayos clínicos por su valoración de la reducción del dolor, únicamente 2 de ellos evaluaron la reducción del dolor del 30 %, o del 50 %. En una de ellas directamente no se definió, en otras 2 se valoraron otros resultados diferentes, y en otras 5 no se pudo encontrar. Debido a todo esto, cuando se analizan los criterios AMSTAR (14) de estas revisiones sistemáticas, únicamente 1 tenía alta calidad. Otro era de calidad media. Y de los otros 8, 1 tenía baja calidad metodológica, siendo los 7 restantes “críticamente” baja.
Así pues, la información que se puede obtener de los ensayos clínicos y de las revisiones sistemáticas no solo es contradictoria y confusa, sino que además la calidad metodológica de estas es baja o críticamente baja. Por lo tanto, podemos concluir que los ensayos clínicos y las revisiones sistemáticas aportan más sombras que luces, por lo menos en lo que respecta al tratamiento del DN.
OPINIONES DE EXPERTOS (KEY OPINION LEADERS)
El siguiente paso, al comprobar que la evidencia científica supuestamente de alta calidad (ensayos clínicos y metanálisis) no lo es tanto, es buscar a los líderes de opinión para valorar qué parecer tienen estos con respecto a la información encontrada anteriormente. En 2018 se publicaron 3 artículos en ese sentido (15-17). Según la EFIC, por las siglas en inglés de la Federación Europea de Capítulos de la Asociación Internacional para el Estudio del Dolor (IASP – International Association for the Study of Pain), los cannabinoides estarían en tercera línea de tratamiento para el DN crónico (15). Además, para su tratamiento recomiendan lo siguiente:
Las otras dos publicaciones coinciden en sus recomendaciones (16,17) con la EFIC:
Finalmente, hay otro grupo de expertos de opinión cuya voz no suele aparecer frecuentemente publicada. Qué mejor que preguntarle al paciente su opinión al respecto al tratamiento. En este caso, cuando se realiza un metanálisis sobre la opinión de la impresión de cambio (patient global impresión of change [PGIC]), el resultado es francamente positivo (8). El OR para la PGIC sobre 8 ensayos clínicos y 1250 pacientes fue de 2,0, con un IC de 1,37 a 2,94. Es decir, en los ensayos clínicos, los pacientes opinan que mejoran, y bastante. Esta diferencia con la valoración de la mejoría del dolor puede ser por varios motivos. Uno de ellos es que los perfiles de beneficio-seguridad para los cannabinoides pueden ser más altos que para otros medicamentos de uso común para el DN, en gran parte porque contribuyen más a la calidad de vida y tienen un perfil de efectos secundarios más favorable (18). Cuando se les pregunta a los pacientes que ponderen el valor de preferencia general para las diferentes terapias para el DN, la seguridad sobrepasa holgadamente el beneficio (la mejora del dolor). Los pacientes quieren mejorar el dolor, pero sobre todo no quieren empeorar (de cualquier causa). Pero si estas dos opciones se desglosan, el beneficio está dividido en alivio del dolor y en mejora de calidad de vida, siendo esta última la que más pesa. En cambio, la seguridad queda subdividida en varios ítems que van desde diferentes efectos secundarios hasta la tolerancia o dependencia, sin que exista un predominio claro de ninguno de ellos sobre los otros, ponderando todos de manera aproximada.
Así pues, en este caso, parece que la opinión de expertos sí da algo de luz, pero no mucha. El tratamiento quedaría supeditado a DN resistente y en combinación con otros tratamientos. Además, los pacientes parece que perciben una mejora en la calidad de vida mayor que en la reducción de dolor.
EXPERIENCIA AJENA
El mayor interés por este grupo terapéutico no solo se puede apreciar en el aumento de publicaciones. La situación del cambio legislativo que se dará en España ya ha ocurrido en algunos países previamente. Así pues, se puede aprovechar esa información para intentar adelantarse a situaciones futuras que puedan ocurrir. Para ello, algunos países han publicado resultados de estudios de cohortes prospectivos o incluso de datos en tiempo real (19-21).
En Tailandia se legalizó el uso del cannabis en enero de 2019. Durante los 12 meses previos, el número de pacientes que notificaban efectos adversos por exposición a cannabis permaneció constantemente bajo (19). Sin embargo, los 3-4 meses previos a su legalización, el número aumentó progresivamente, sobre todo en aquellos por uso de aceites. Y en los 4 meses siguientes a su legalización la pendiente de casos de efectos secundarios por aceite de cannibis aumentó considerablemente. Sin embargo, la exposición a otras vías o productos permaneció en la misma constante que anteriormente. Este faro nos debe alertar que la exposición a aceites, y sus efectos secundarios, aquí en España, debe estar aumentando ya en estos momentos, y que su pendiente también puede incrementarse cuando finalice el proceso legislativo.
En Israel, en un estudio prospectivo con datos en tiempo real, aparecieron datos muy interesantes (20). La intensidad del dolor disminuyó un 20 %. Un 43 % de los pacientes ya no usaban analgésicos. La dosis equivalente de morfina (DEM) disminuyó significativamente en el 42 % de los pacientes. La discapacidad mejoró un 19 %, y la calidad de vida otro 25 %. La ansiedad disminuyó un 40 % y la depresión otro 32 %, con una mejora en el catastrofismo del dolor del 17 %. Además, los pacientes reportaron una mejora del 33 % en las alteraciones del sueño, con un aumento de la duración del sueño del 14 %. Sin embargo, estos datos tan espectaculares contrastan con los obtenidos en Dinamarca (21). Allí se realizó otro estudio de cohortes prospectivo reciente, pero los datos que se obtuvieron no solo no fueron tan espectaculares, sino que algunos fueron en la dirección contraria. Por ejemplo, los usuarios de THC combinado con cannabidiol o THC puro usaron una mayor dosis diaria de cualquier analgésico que los controles. Esto incluye también un aumento de dosis de opioides, al contrario de la opinión de varios expertos y los resultados de algunos ensayos clínicos. Sin embargo, sí que disminuyeron el consumo de los medicamentos específicos para DN, tales como los gabapentinoides o antidepresivos; y el uso de los cannabinoides se asoció a un tiempo significativamente menor de días de hospitalización. Probablemente estas diferencias se deben al uso en población en general, sin tener en cuenta posibles factores de predicción positiva o negativa. Por ejemplo, en el estudio de Israel, la presencia de DN predijo tasas más bajas de éxito del tratamiento (20). En cambio, sí se pudo comprobar que tanto la duración del sueño normal, así como cifras de índice de masa corporal menores o puntuaciones bajas en la escala de depresión, todas ellas previas al consumo de cannabinoides, predecían tasas más altas de éxito del tratamiento.
Así pues, lo que se puede observar de estudios de cohortes poblacionales es que probablemente este tratamiento no sea beneficioso en todos los grupos de población. En algunos subgrupos las tasas de éxito serán mayores o menores, cosa que todavía debe comprobarse más fehacientemente. De hecho, en una encuesta realizada recientemente a socios de la SED sobre diversos tratamientos para DN, también se preguntó al respecto de los cannabinoides (2). Interesantemente, un 20 % de los encuestados respondieron que los usaban ocasionalmente, y otro 20 % que no los usaba en la actualidad, pero que anteriormente sí lo había hecho. Y la mayoría de ellos había obtenido la información para su uso de las publicaciones recientes. En estudio Delphi que realizó el GT DN SED se obtuvieron algunas conclusiones que van en esta dirección. Los datos experimentales en laboratorio y en modelos animales muestran que los cannabinoides son una alternativa válida en el tratamiento de las DN. Los cannabinoides tienen recomendaciones de uso débiles y evidencia de calidad moderada. Consiguen pequeñas reducciones del dolor, con periodos de latencia, y deben administrarse en combinación con otros analgésicos. La combinación de concentraciones bajas de THC (<12,5 %) y altas de CBD parece ejercer mejores efectos analgésicos, pero hasta el momento ningún estudio ha evaluado productos farmacológicos basados en dicha combinación. Los mejores efectos analgésicos se logran a través de la vía de administración vaporizada, siendo el efecto pequeño por vía oral. El único tratamiento basado en cannabinoides disponible actualmente en España, ha demostrado beneficios analgésicos para el dolor central asociado a la esclerosis múltiple, la lesión por avulsión del plexo, el DN tras una lesión periférica y la neuropatía diabética. Aun así, no se han caracterizado los efectos secundarios a largo plazo ni el riesgo de adicción, pero los efectos a corto plazo son de leves a moderados, siendo los más graves los cognitivos agudos (particularmente sobre la memoria en dosis altas). Y no se recomienda su uso en pacientes menores de 25 años, en mujeres embarazadas o en pacientes con enfermedades cardiovasculares o respiratorias, psicosis o antecedentes de abuso de sustancias. Este tipo de recomendaciones no solo las ha hecho la SED. Otros autores están publicando también algoritmos de aproximación al tratamiento con cannabinoides, para tratar de perfilar a los mejores candidatos posibles (22). Entre estos, se recomienda en terapia combinada. Sin embargo, en una revisión reciente sobre combinación terapéutica para DN se encontró que agregar THC/CBD a un tratamiento preexistente para DN no mostró ningún beneficio para estos paciente (23). Esto puede deberse a que, en otra revisión reciente, exclusivamente sobre cannabinoides, se encontró que el nabiximol (una mezcla de THC/cannabidiol) era superior a placebo, pero con un tamaño de efecto pequeño. Este tamaño puede ser insuficiente para crear una diferencia apreciable en una combinación de tratamientos. No obstante, en terapia combinada, junto con otros tipos de agentes (como antiepilépticos) el THC sin cannabidiol podría presentar como un adyuvante potencial.
CONCLUSIONES
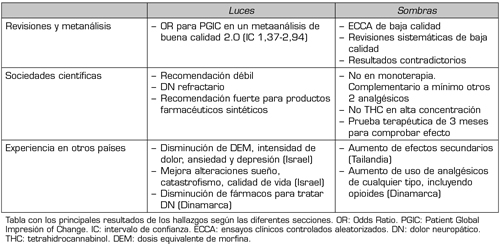
Después de esta revisión se pueden sacar una serie de conclusiones que vuelven al título de luces y sombras (Tabla 1) (24):
Tabla I. Luces y sombras en Cannabis medicinal para DN. Resultados

Tabla con los principales resultados de los hallazgos según las diferentes secciones. OR: Odds Ratio. PGIC: Patient Global Impresión of Change. IC: intervalo de confianza. ECCA: ensayos clínicos controlados aleatorizados. DN: dolor neuropático. THC: tetrahidrocannabinol. DEM: dosis equivalente de morfina.
AGRADECIMIENTOS
Este texto es un resumen de la ponencia realizada en la Jornada del Grupo de Interés en Cannabinoides para el dolor. Particularmente es de agradecer la labor del Dr. Jesús de Santiago en la coordinación, organización y ejecución de dicho evento, además de la creación de este número especial.
CONFLICTO DE INTERESES Y FINANCIACIÓN
Este trabajo se ha realizado sin financiación.
BIBLIOGRAFÍA