doi.org/10.20986/resed.2022.3970/2022
REVISIÓN
SÍNDROME DE DOLOR MIOFASCIAL EN LA MUSCULATURADEL SUELO PÉLVICO FEMENINO. REVISIÓN NARRATIVA DE LA LITERATURA
MYOFASCIAL PAIN SYNDROME IN THE FEMALE PELVIC FLOOR MUSCULATURE. NARRATIVE REVIEW OF THE LITERATURE
D. A. Mendez Vega1
L. Arce Gálvez2
M. A. Tovar Sánchez2
1Departamento de Ginecología y Obstetricia. Universidad Libre. Cali, Colombia
2Departamento de Medicina Física y Rehabilitación. Universidad del Valle. Departamento de Medicina Física y Rehabilitación. Hospital Universitario del Valle E.S.E. Cali, Colombia
RESUMEN
Introducción: El síndrome de dolor miofascial del suelo pélvico en la mujer es una causa frecuente de dolor agudo y crónico, en ocasiones superpuesto a otras entidades patológicas. Es secundario a la sobrecarga mecánica muscular que favorece la aparición de puntos gatillo.
Objetivo: Describir una entidad dolorosa frecuente, su fisiopatología y posibilidades de tratamiento.
Metodología: Se realizó una revisión de la literatura con términos Mesh en inglés y español en las bases de datos Embase, Pubmed, Lilacs, Sage, Google Acedemics y Scielo desde el año 1983 hasta el año 2021. Se encontraron 240 artículos y fueron seleccionados 50, basados en su impacto clínico.
Resultados: El dolor pélvico afecta a más del 50 % de las mujeres mayores de 35 años. Existen diferentes condiciones clínicas que favorecen la sobrecarga mecánica muscular y la formación de puntos miofasciales dolorosos. El diagnóstico es clínico, pero se pueden solicitar estudios imagenológicos. El tratamiento incluye varias modalidades: terapia física, psicoterapia, farmacoterapia e intervencionismo con aguja seca, estimulación eléctrica y toxina botulínica.
Conclusión: El síndrome miofascial en la musculatura pélvica femenina es una condición prevalente que debe ser considerada dentro del diagnóstico de dolor pélvico y abordada de manera multidisciplinaria.
Palabras clave: Miofascial, suelo pélvico, dolor, punto gatillo
ABSTRACT
Introduction: Pelvic floor myofascial pain syndrome in women is a frequent cause of acute and chronic pain, sometimes superimposed on other pathological entities. It is secondary to mechanical muscle overload that favors the appearance of trigger points.
Objective: To describe a frequent painful entity, its pathophysiology, and treatment possibilities.
Methodology: A literature review was carried out with Mesh terms in English and Spanish in the databases Embase, Pubmed, Lilacs, Sage, Google Academics, Scielo from 1983 to 2021. 240 articles were found and 50 were selected based on their clinical impact.
Results: Pelvic pain affects more than 50 % of women over 35 years of age. There are different clinical conditions that favor mechanical muscle overload and the formation of painful myofascial points. Diagnosis is clinical, but imaging studies may be requested. Treatment includes several modalities: physical therapy, psychotherapy, pharmacotherapy, and dry needling, electrical stimulation, and botulinum toxin.
Conclusion: Myofascial syndrome in the female pelvic musculature is a prevalent condition that should be considered within the diagnosis of pelvic pain and approached in a multidisciplinary manner.
Keywords: Myofascial, pelvic floor, pain, trigger point
Recibido: 07-01-2022
Aceptado: 17-10-2022
Correspondencia: Leonardo Arce Gálvez
leonardo.arce@correounivalle.edu.co
INTRODUCCIÓN
El dolor musculoesquelético es una de las causas más frecuentes de consulta en los servicios médicos ambulatorios y de urgencias de diferentes especialidades. Afecta a ambos sexos y está presente en todos los grupos etarios, pudiendo abarcar hasta el 56 % de los casos de dolor crónico en mayores de 35 años y hasta el 86 % de los casos en mayores de 56 años (1).
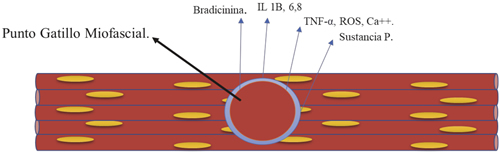
Una de las fuentes de dolor musculoesquelético es el síndrome de dolor miofascial (SDMF), el cual es un cuadro de dolor regional que se localiza en un músculo o grupo muscular funcional, que se caracteriza por puntos gatillo localizados sobre bandas musculares tensas a la palpación, que evocan los síntomas sensitivos y generan dolor referido (2). Se considera actualmente que además de los cambios musculares hay también alteraciones motoras, sensitivas y autonómicas que modifican la conformación de la fibra muscular y favorecen la elevación de citoquinas inflamatorias como bradicininas, interleucinas, radicales libres y factores de necrosis tumoral (Figura 1) (2).

Fig. 1. Cambios fisiológicos y liberación de citoquinas inflamatorias.
Para el diagnóstico se emplean diferentes criterios clínicos. El consenso internacional de Fernández y Dommerholt es uno de los más utilizados, por su facilidad de aplicación (Tabla 1) (3). Se pueden realizar imágenes diagnósticas, como la ecografía y la resonancia magnética, para la identificación de los puntos gatillo, donde se encuentran cambios morfológicos en la fibra muscular (Tabla 2), pero los cambios son variables entre las diferentes revisiones y no están presentes en todos los pacientes diagnosticados y tratados para esta entidad clínica, lo que convierte al síndrome de dolor miofascial en una entidad de diagnóstico clínico (4).
Tabla I. Consenso internacional en criterios para punto de dolor miofascial.

*Deben estar presentes al menos 2 de los 3 criterios.
Tabla II. Características de los puntos de dolor miofascial en estudios de imagen.

El dolor de esta patología se clasifica en el periodo agudo como nociceptivo somático dada la estimulación de nociceptores y cambios de la homeostasis local muscular. Al cruzar la barrera de los 3 meses de evolución es considerado un dolor crónico, en el cual se inician procesos neurológicos de nociplasticidad con las modificaciones de sensibilización del sistema nervioso que, a futuro, resolviendo la noxa inicial, pueden condicionar dolor nociplástico musculoesquelético con la posibilidad que existan nuevos focos de dolor muscular nociceptivo (5). Esta observación cobra importancia en los procesos de nociplasticidad central y periférica, debiendo ser considerada en el abordaje farmacológico y psicológico de la entidad, reconociendo además que en las mujeres los procesos hormonales e inmunológicos median factores que modifican la respuesta glial y favorecen la cronificación de los síntomas (6).
Los puntos gatillo se pueden clasificar de manera adicional en puntos miofasciales activos y latentes (7). Los puntos activos tienen síntomas de dolor espontáneo, están asociados a posturas o al movimiento, se acompañan de efectos motores y autonómicos generan debilidad muscular, limitación en los arcos de movilidad articular y pérdida de la coordinación. Los puntos latentes generan síntomas solo con la palpación con una respuesta motora y autonómica de menor grado (7).
METODOLOGÍA
El objetivo de esta revisión narrativa es describir al síndrome de dolor miofascial en asociación con la musculatura del suelo pélvico femenino desde una perspectiva amplia, que incluye sus características fisiopatológicas, anatómicas, clínicas y consideración de tratamiento. Se realizó una revisión de la literatura médica disponible en las siguientes bases de datos: Embase, Pubmed, Lilacs, Sage, Google Acedemics, Scielo, con los términos Mesh, tanto en inglés como en español, que incluían: miofascial, piso pélvico, suelo pélvico, dolor y punto gatillo. La búsqueda incluyó artículos desde el año 1983 hasta el año 2021. Se encontraron 240 artículos. Los autores realizaron una revisión del título y resumen de cada artículo, obteniendo el contenido completo de la publicación en los considerados más relevantes para el desarrollo de cada uno de los segmentos de la publicación, como las definiciones, anatomía fisiología y tratamiento, se consideró de manera adicional la calidad de la información, el impacto de la revista de publicación, la indexación y el número de referencias. Como resultado, se seleccionaron 50 artículos. Se excluyeron los artículos que no tienen disponible un documento completo, reportes o series de casos y publicaciones en congresos o pósteres.
ANATOMÍA
El suelo pélvico es un aparato mecánico complejo y tridimensional, que da soporte y suspensión a los órganos pélvicos y abdominales. Su componente más importante es el músculo elevador del ano, el cual cubre la mayor parte de la pelvis. Los órganos pélvicos pueden dividirse en 3 compartimentos: anterior (vejiga y uretra), medio (útero y vagina) y posterior (recto, conducto anal y aparato esfinteriano). El soporte de los órganos pélvicos proviene de las conexiones de estos a la pelvis ósea y sus músculos (8).
El sistema de soporte de órganos pélvicos incluye la fascia endopélvica, la membrana perineal y los músculos elevadores del ano, que son controlados por el sistema nervioso central y periférico (9). La musculatura del suelo pélvico está conformada por un grupo de músculos estriados de control voluntario, que forman una estructura de soporte similar a una hamaca para los órganos de la pelvis. El músculo elevador del ano está conformado por tres fascículos que forman una “U” o “V” abierta hacia anterior, permitiendo el paso de los extremos distales de los sistemas urinario, genital y digestivo (9). Estos fascículos corresponden a los músculos puborectal, pubococcígeo, iliococcígeo e isquiococcígeo, en estrecha relación complementaria con los músculos coccígeo, obturador interno y piriforme; todos ellos tienen una longitud de sarcómero y tejido conectivo más corto que el resto de la musculatura esquelética con una carga mecánica mayor (10). Existen músculos más superficiales en relación con los genitales, como son el músculo bulbocavernoso, el isquiocavernoso y el trasverso superficial y profundo del periné, de pequeño tamaño pero al igual que la musculatura más profunda con la posibilidad de generar dolor (8) (Figura 2).
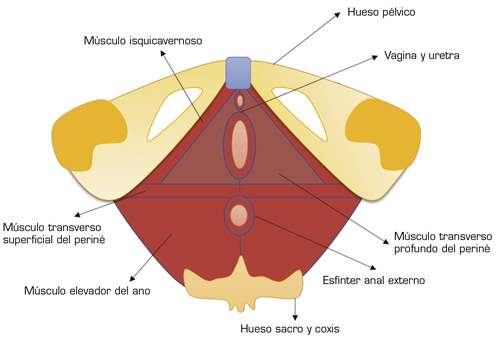
Fig. 2. Diagrama muscular del piso pélvico.
El músculo elevador del ano, en conjunto con el músculo coccígeo, forman el diafragma pélvico. Este diafragma se extiende como un embudo hacia la parte inferior formando la mayor parte del suelo de la pelvis (8). El músculo elevador del ano es una estructura dinámica que en reposo presenta la forma de domo, pero al contraerse se vuelve horizontal elevando y llevando hacia anterior la unión anorrectal, lo cual genera un ángulo que dificulta el paso de las heces desde el recto hasta el ano por un cambio en los ejes de ambos, cuando se relaja y estira coordinadamente durante la defecación desciende la unión anorrectal y se alinea el recto con el conducto anal para permitir la defecación (11).
DOLOR MIOFASCIAL PÉLVICO EN LA MUJER
El SDMF en la musculatura del suelo pélvico es una de las causas más frecuentes de dolor pélvico crónico en la mujer, ya sea como entidad sindrómica o asociado a otras causas orgánicas de dolor (12). Ha sido reportado que el 87 % de los focos de endometriosis encontrados en intervenciones laparoscópicas tiene poca respuesta terapéutica, además de no tener una relación clara con la zona de dolor de las pacientes y, por tanto, en los últimos años el SDMF ha cobrado importancia como posible etiología (13).
Los puntos de dolor miofascial pélvico de la mujer no solo generan síntomas dolorosos con la estimulación de la banda tensa, sino que afectan de manera negativa la calidad de vida y favorecen procesos de sensibilización central y periférica al dolor, lo cual dificulta la respuesta de las intervenciones (14). A pesar de ser una condición ginecológica y urológica frecuente, la mayoría de los médicos de estos campos no reciben formación suficiente sobre el diagnóstico y tratamiento de esta entidad (12).
La clínica usual del SDMF en el suelo pélvico se presenta con dolor nociceptivo somático localizado, de intensidad moderada a severa que se incrementa con algunos movimientos con síntomas que se agravan a la palpación. Se puede encontrar un dolor referido difuso en múltiples localizaciones como uretra, vagina, recto, coxis, región lumbar, abdomen inferior, muslos y piernas (10,15) (Figura 3). Estos síntomas en general se diferencian del dolor neuropático, ya que no existe una alteración anatómica nerviosa, no se presentan síntomas sensitivos cutáneos en distribución nerviosa y los estudios electrofisiológicos son normales. Sin embargo, existen entidades que pueden coexistir con el SDMF a nivel pélvico, como la neuralgia del nervio pudendo atrapado a través del canal de Alcock, la neuralgia de los nervios iliohipogástrico, ilioinguinal, genitofemoral y el síndrome del piriforme con compresión por variante anatómica del nervio ciático (16). Estas entidades que generan un dolor de características neuropáticas sumado a la nocicepción y nociplasticidad del SDMF, convierten el diagnóstico en un reto.
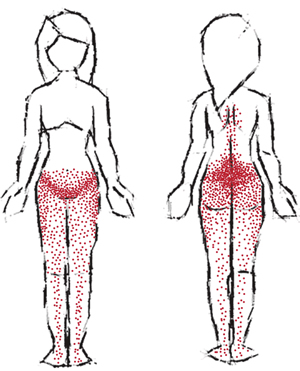
Fig. 3. Distribución del dolor pélvico y puntos de referencia.
Hay que tener en cuenta también todas las patologías ginecológicas, urológicas, gastrointestinales, articulares e infecciosas que tienen un manejo particular, pero que se pueden superponer al SDMF en el suelo pélvico, por tanto el tratamiento debe ser debe complementado con las intervenciones específicas para el SDMF (17,18).
ETIOLOGÍA
La causa de SDMF en el suelo pélvico es multifactorial. Se han presentado diferentes teorías que pueden explicar las alteraciones fisiológicas que sufre un músculo en cualquier localización. La formación de la banda muscular tensa se debe a la disminución del ATP local, lo que limita la ruptura de los puentes cruzados contráctiles de miosina-actina y al aumento local de calcio por la disminución en la captación del retículo sarcoplásmico mediada por ATP (7). Estos cambios generan estrés metabólico y radicales libres, lo que incrementa los cambios isquémicos locales a nivel del músculo y produce potenciales de acción muscular aberrantes que favorecen la hiper contracción (19).
Un desequilibrio metabólico puede generar un incremento de la acetilcolina y modificación de la respuesta bioquímica del receptor, generando espasmo muscular e incremento de la actividad de las fibras en los puntos gatillo (20). Por otro lado, el movimiento asociado a las actividades cotidianas o al ejercicio favorecen el sobreúso muscular son factores de riesgo para esta entidad, considerando además que existen puntos críticos por la alta carga mecánica y el pequeño tamaño del musculo, en el caso del suelo pélvico con una alta carga funcional (10).
SENSIBILIZACIÓN AL DOLOR
La sensibilización produce una modificación en los umbrales al dolor por estímulos nociceptivos y no nociceptivos, siendo uno de los condicionantes más importantes en el desarrollo de nociplasticidad (21). De manera inicial, la liberación de citoquinas proinflamatorias genera hiperalgesia como una respuesta protectora, pero esta sobrestimulación persistente en el tiempo a nivel periférico y central (medular y encefálico), modifica la liberación de neuromoduladores, lo que facilita la transmisión de estímulos nociceptivos y la comunicación sináptica de las neuronas en el asta dorsal de la médula espinal (22). Se genera también un reclutamiento de fibras sensitivas no nociceptivas de tacto, vibración y temperatura, lo que magnifica la percepción dolorosa y modifica la sensibilidad en regiones no afectadas (2).
De manera adicional a los mecanismos de sensibilización se produce una disminución en la acción de las vías inhibitorias descendentes del dolor (23). Estas respuestas son variables entre cada persona que sufre de SDMF y se superpone entre la sensibilización por los estímulos nociceptivos y la disminución en la modulación por las vías descendentes inhibitorias (24).
EXAMEN FÍSICO
Las estructuras musculares por examinar en la mujer con SDMF del suelo pélvico se alcanzan desde la palpación superficial en la región glútea y perineal y profunda a nivel intravaginal e intra rectal. Se busca en la evaluación del suelo pélvico realizar un examen físico estructurado por pasos que facilite la identificación de todas las estructuras relevantes, evitando pasar por alto puntos críticos sintomáticos (25).
En una revisión sistemática previa de la Dra. Meister y cols., para la revista Americana de Obstetricia y Ginecología, se plantea el siguiente orden: primero explicar a la paciente la evaluación y su finalidad, posicionar a la paciente en posición de litotomía, realizar un examen unidigital con guante lubricado en el introito vaginal, localizar los músculos del suelo pélvico utilizando un modelo de reloj con las 12 hacia el pubis y las 6 hacia el ano, continuar con la palpación unidigital de los músculos superficiales y avanzar a los profundos, ubicando puntos de dolor con el sistema de reloj (pubococcígeo 7-11 izquierdo, 1-5 derecho; iliococcígeo 4-8; coccígeo 5-7 con inserción digital profunda; obturador interno 2-10) (Figura 4); cuantificar el dolor con la escala numérica de clasificación de 1 a 10; además de esto, es posible incluir la palpación externa del músculo piriforme, la musculatura glútea y lumbar, la articulación sacroilíaca, una exploración vaginal externa, anal y abdominal (25).
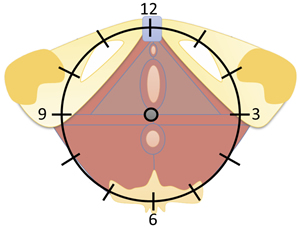
Fig. 4. Examen físico, modelo en reloj.
Es importante complementar la evaluación muscular examinando los arcos de movilidad articular de la columna lumbosacra y de los miembros inferiores, las posiciones que adopta el paciente en bípedo, sedente y decúbito y su patrón de marcha, que puede representar dolor o debilidad muscular, descartar alteraciones estructurales como escoliosis y asimetrías (26).
TRATAMIENTO
El SDMF en el suelo pélvico puede existir como una entidad clínica independiente, pero en muchas ocasiones es una condición asociada o sumada a otra entidad clínica dolorosa del suelo pélvico, ya sea urológica, ginecológica, gastrointestinal musculoesquelética, neurológica o psicógena, por lo cual requiere un abordaje terapéutico multidisciplinario con intervenciones farmacológicas y no farmacológicas (18).
Terapia física
Dentro de las intervenciones no farmacológicas se inicia con la terapia física del suelo pélvico. Se han propuesto diferentes técnicas para la intervención, prefiriendo un plan de trabajo individualizado (27). Los pilares de la intervención con terapia física serán la educación, la modificación de conductas, el reentrenamiento neuromuscular, el uso de estimulación eléctrica transcutánea, ultrasonido, biofeedback auditivo o visual (intravaginal o intrarectal con ejercicios de Kegel) y el desarrollo de un plan de ejercicios en casa. Además, se puede realizar la liberación manual de los puntos miofasciales con masaje por vía vaginal o anal (28). Las modalidades de terapia tienen evidencia no concluyente, pero puede llegar a ser útil, en la coexistencia de vulvodinia, la aplicación de frío o calor por medio de baños calientes, toallas sobre la piel o paquetes fríos. La frecuencia de la intervención debe ser mínimo de una hora a la semana, prefiriendo un trabajo de al menos 3 sesiones semana por 4 semanas (29).
Los objetivos de la intervención serán mejorar la debilidad muscular, favorecer el control muscular del suelo pélvico, mejorar la flexibilidad y disminuir el dolor (30,31). La base fisiológica de la intervención por terapia física es la mejoría del flujo sanguíneo a la zona tratada con modalidades, estiramientos y masaje (18), además del incremento en la disponibilidad del ATP por cambios de temperatura que lleva a adaptaciones vasculares y las modificaciones del potencial de acción motor por la estimulación eléctrica transcutánea que mejoran el estado de hipercontracción, disminuyendo la producción de radicales libres (31,32).
Psicoterapia
Las mujeres con SDMF del suelo pélvico presentan de manera frecuente cuadros de ansiedad o depresión, en ocasiones con un antecedente de trauma pélvico o abuso sexual (15). Estos factores de estrés mental y emocional favorecen la formación de puntos gatillo musculares y el desarrollo de dispareunia y constipación, que generan una sobrecarga nociceptiva y mecánica a nivel del suelo pélvico (33). Intervenir de manera adecuada las enfermedades psiquiátricas, la terapia cognitivo conductual y el apoyo emocional asociados a las intervenciones farmacológicas y no farmacológicas, juegan un papel importante en el control de los síntomas (10).
Medicamentos
La decisión clínica de intervenir al paciente de manera farmacológica no excluye el inicio de terapia física o intervencionismo. Se debe considerar en primera medida las comorbilidades de la paciente, su función renal y hepática, el riesgo cardiovascular, su historial farmacológico y analgésico (34).
La intervención farmacológica inicial en general incluye acetaminofén y antinflamatorios no esteroideos (AINE). Los opioides típicos y atípicos han sido utilizados en bajas dosis y por un lapso corto de tiempo en dolor refractario, pero no tienen una indicación mayor al tratarse de una condición crónica no oncológica (35).
En combinación con otras terapias como acetaminofén o AINE, se pueden utilizar relajantes musculares no benzodiacepínicos, como la tizanidina y la ciclobenzaprina, los cuales por su acción central, además de relajar las fibras musculares, favorecen un mejor patrón de sueño, utilizados por periodos cortos de hasta 20 días (36). La neuromodulación con gabapentinoides como pregabalina o gabapentina tiene una evidencia no concluyente, pero hay un beneficio teórico en el control de la ansiedad al igual que los antidepresivos tricíclicos, sumado a su acción sobre los receptores glutamatérgicos NMDA que pueden modificar la percepción del dolor crónico nociceptivo propio del SDMF (37).
Intervencionismo
Dentro de los procedimientos intervencionistas se encuentran: la punción con aguja seca, la inyección de anestésicos locales y corticoesteroides y la inyección de toxina botulínica. Se consideran la segunda línea de manejo cuando las intervenciones conservadoras como la terapia física en sus diferentes modalidades y la intervención farmacológica no logran el efecto terapéutico deseado (38).
La punción con aguja seca es un procedimiento ampliamente utilizado en el SDMF; en manos de un médico entrenado en la identificación del punto gatillo es un procedimiento que puede ser llevado a cabo por guía anatómica, pero se prefiere por precisión y seguridad la guía ecográfica (39). Se realiza introduciendo una aguja de acupuntura en la banda muscular del punto gatillo, donde se percibe una resistencia que es liberada progresivamente con movimiento circulares y en abanico de la aguja (Figura 5) (26). Este estímulo genera un aumento transitorio en la actividad muscular local y una relajación muscular distal debido a una respuesta refleja espinal que facilita la liberación de las fibras, además de mejorar con este cambio estructural la irrigación y oxigenación del tejido (40). Se ha encontrado que este estímulo micro-traumático local, además, favorece la liberación de opioides endógenos, la activación del sistema serotoninérgico, la disminución de calcitonina y sustancia P, de citoquinas inflamatorias e interleucinas, procesos estos mediados por el incremento de endorfinas y la disminución en la estimulación sensitiva de las neuronas del asta dorsal de la medula espinal (41). Por último, se genera una modificación de la percepción sensitivo-motora a nivel de la ínsula, el tálamo, la corteza cingular anterior y la corteza somatosensorial por medio de la modulación de estímulos recibidos por neuronas de tercer orden a nivel de tallo cerebral en sinapsis con las neuronas del asta dorsal (42).
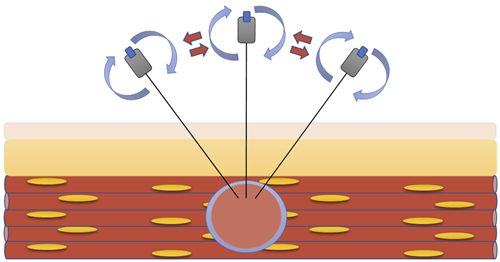
Fig. 5. Punción con aguja seca con técnica en círculo y abanico.
La asociación de estimulación eléctrica a la punción con aguja seca ha mostrado mejoría y sustenta su aplicación en la estimulación de la sustancia gris periacueductal y las vías inhibitorias descendentes del dolor, careciendo de evidencia en la musculatura del suelo pélvico (43).
La infiltración de anestésicos locales agregado a la punción con aguja seca no ha mostrado un beneficio en la mejoría del dolor, funcionalidad o calidad de vida; se ha encontrado que puede generar una disminución sutil de los síntomas con la punción inicial, pero sin afectar el desenlace a largo plazo (44). Como anestésico local se utilizan lidocaína o bupivacaína en volúmenes bajos de 0,25 a 0,5 mililitros, teniendo en cuenta la seguridad de los medicamentos y la prevención de punción intravascular (18).
El uso de corticoesteroides en el SDMF es controvertido, ya que los estudios han demostrado una no inferioridad al compararlo con la aguja seca, pero sin adicionar beneficios adicionales y agregando las complicaciones de la inyección de este tipo de medicamentos (45). Sin embargo, existen alunas revisiones de aplicación en la musculatura pélvica que favorecen la inyección de corticoesteroides, lo que puede llegar a ser una estrategia útil en la paciente refractaria a las intervenciones con aguja seca y manejo farmacológico (46).
Por último, se han realizado ensayos clínicos con la inyección de toxina botulínica tipo A en el SDMF de la musculatura pélvica en pacientes refractarias a otras intervenciones (47). Su utilidad teórica se basa en el bloqueo del SNAP-25 que hace parte de un grupo de proteínas sinápticas que favorecen la exocitosis de acetil colina, al bloquearla mejora el estado de hipercontracción de los puntos gatillo, además disminuye la secreción de moléculas mediadoras de dolor y la expresión de los receptores TRPV1, los cuales tiene un rol principal en el dolor osteomuscular (18,48). En la musculatura pélvica no existe una práctica estándar de inyección, se prefiere la guía ecográfica para mayor seguridad y localización muscular en un abordaje intravaginal, utilizando de 5 a 30 unidades de toxina botulínica por punto de inyección y una concentración total de hasta 200 unidades (49). El uso concomitante de esta intervención con la terapia farmacológica o la terapia física puede generar un beneficio adicional a las pacientes (50).
CONCLUSIÓN
El SDMF del suelo pélvico es una entidad causal muy frecuente de dolor pélvico agudo y crónico, puede presentarse en solitario, pero en general está relacionada a otras alteraciones que favorecen sobrecarga mecánica muscular y el dolor. El diagnóstico requiere a un personal entrenado que realice un examen físico sistemático. Existen diferentes opciones de tratamiento, prefiriendo un abordaje multidisciplinario con intervenciones farmacológicas y no farmacológicas en simultáneo para favorecer el mejor desenlace clínico posible. El conocimiento de esta entidad y su búsqueda en las consultas de médicos ginecólogos, gastroenterólogos, coloproctólogos, urólogos, rehabilitadores y del dolor, puede brindar opciones de tratamiento a pacientes con cuadros dolorosos crónicos refractarios a intervenciones usuales por otras causas.
CONFLICTO DE INTERESES
Declaramos no presentar ningún conflicto de interés.
FINANCIACIÓN
Los autores no recibieron financiamiento para llevar a cabo este estudio.
BIBLIOGRAFÍA