http://dx.doi.org/10.20986/resed.2023.4010/2022
ORIGINAL
DATOS DE REMISIÓN Y MANEJO DE UNA POBLACIÓN ONCOLÓGICA A UNA UNIDAD DE DOLOR. ¿QUÉ PODEMOS MEJORAR?
REVIEW OF THE REMISSION AND MANAGEMENT OF A CANCER RELATED PAIN POPULATION TO A PAIN UNIT. WHAT CAN WE IMPROVE?
A. Carregal Rañó, M. Mayo Moldes, T. Fernández Rodríguez y M. Vieito Amor
Servicio Anestesiología, Reanimación y Tratamiento del Dolor. Complexo Hospitalario Universitario de Vigo. Pontevedra, España
RESUMEN
Objetivos: Determinar las características demográficas, clínicas y de manejo analgésico de una población con dolor oncológico remitida a nuestra unidad de dolor (UD). Descripción de su manejo clínico una vez recibidos en la unidad. Detectar aspectos de mejora.
Material y métodos: Estudio retrospectivo y descriptivo, realizado durante un periodo de 23 meses, entre noviembre de 2019 y diciembre de 2021, de todos los pacientes oncológicos derivados a la UD, cuya causa de derivación fuera dolor de origen oncológico.
Resultados: Se analizaron 78 pacientes, el 63,2 % hombres y el 46,8 % mujeres. La edad media poblacional fue de 64,84 ± 12,623 años. El 44,7 % fueron remitidos por servicios quirúrgicos. El 75 % presentaba dolor moderado o severo. Los tumores más frecuentes fueron los abdominales (31,6 %), y cabeza y cuello (22,4 %). La causa del dolor fue en 48,7 % de los casos de la infiltración tumoral y en un 60,5 % un dolor de origen de mixto. En el momento de la remisión el 60 % de los pacientes recibía opioides mayores, con una dosis de equivalentes diarios de morfina (EDM) de 163,57 ± 167,10 mg y el 38 % recibía antineuropáticos. El tiempo medio para atender a estos pacientes desde el momento de solicitarla fue de 9,18 ± 9,73 días. Se realizó intervencionismo menor en el 56,6 % (43) de los pacientes y mayor en el 2,6 % (2). Se inició en la UD el tratamiento con fármacos antineuropáticos en el 68,4 % de los casos. Tras el manejo en la UD, un 72,4 % de los pacientes refirieron mejoría del dolor.
Conclusiones: Mejorar la tasa de remisión de pacientes desde servicios como Oncología médica y Atención primaria. Mejorar los tiempos de remisión a las unidades de dolor. Ajustar mejor los tratamientos analgésicos antes de la remisión. Generar un protocolo de remisión sencillo de pacientes que incluyan pautas básicas de manejo del dolor. Mejorar el diagnóstico de dolor neuropático. Aumentar la cartera de servicios de intervencionismos de la UD. Las unidades de dolor pueden mejorar el dolor en los pacientes con dolor oncológico. Crear comités de multidisciplinares de dolor oncológico.
Palabras clave: Dolor oncológico, servicios de remisión, unidades de dolor, comité de dolor oncológico, intervencionismo.
ABSTRACT
Aim: Studying the demographic profile, clinical characteristics and analgesic management of an oncologic population sent to our pain unit. To describe the pain management in our unit. To detect management aspects to be improved.
Methodology: Retrospective and descriptive study, performed in a period of 23 months, between November 2019 and December 2021, of all patients sent to our pain unit for cancer pain management.
Results: A total of 78 patients were analyzed, 63,2 % men and 46,8 % women. The average age was 64,84 ± 12,623 years. 44,7 % were sent by surgical services. In 75% the pain was moderate or severe. The main cancer location was abdominal (31,6 %), and head and neck (22,4 %). In 48,7 % the pain was originated by tumoral infiltration and in 60,5 % the pain was judged to be mixed. At the moment of the arrival 60 % of patients were on opioids, with an average dose of 163,57 ± 167,10 mg EDM and 38 % were on antineurophatic drugs. The average time to attend the patients from the moment or request was 9,18 ± 9,73 days. A minor interventional procedure was performed in 56,6 % (43) of the patients, and a major intervention in 2,6 % (2). We started antineurophatic drugs in 68,4 % of the cases. During the period of pain management in our unit a 72,4% of the patients referred an improvement of their cancer related pain.
Conclusions: It is necessary to improve the rate of remission from medical oncology departments and primary care physicians. To reduce the remission time to our unit from the referral services. To improve analgesic management before referral. To create an easy protocol for remission of patients that includes basic pain management instructions. To improve the rate of neuropathic pain diagnosis before referral. To expand our interventional technics portfolio. Pain units can improve cancer related pain management. To create multidisciplinary cancer pain comities.
Key words: Cancer pain, referral services, pain units, pain units, cancer pain comities, interventional management.
Recibido: 03-08-2022
Aceptado: 25-04-2023
Correspondencia: Alfonso Carregal Rañó
alfcarregal@gmail.com
INTRODUCCIÓN
Con el aumento de nuestra capacidad para diagnosticar y tratar la enfermedad oncológica, se ha producido un aumento progresivo de la supervivencia y, por ende, de la esperanza de vida media de los pacientes tras su diagnóstico. Como contrapartida, tanto la enfermedad oncológica como su tratamiento nos van a mostrar mayores efectos secundarios nocivos a largo plazo (1).
En la nueva clasificación del dolor crónico de la CIE-11, el dolor por cáncer se define como el dolor crónico causado por el propio cáncer primario, por las metástasis (dolor crónico por cáncer) o por su tratamiento (dolor crónico posterior al tratamiento del cáncer). La Organización Mundial de la Salud y otros organismos internacionales han elaborado guías clínicas de tratamiento del dolor para pacientes con cáncer terminal, cuyo control resulta muy difícil, ya que el dolor oncológico va avanzando según avanza la enfermedad (2).
Por tanto, son los pacientes que, en su mayoría, se beneficiarán de terapias farmacológicas coadyuvantes e intervencionistas. Esto hace que nos cuestionemos si un manejo precoz, más agresivo, en el que se derivase a las unidades de dolor (UD) de forma más temprana y en donde se realizaran unas terapias más agresivas, aportaría un mejor control analgésico (3).
Dada la creciente concienciación sobre el potencial de abuso y adicción a los opioides, estamos recurriendo progresivamente más a las técnicas intervencionistas disponibles para mitigar el dolor. Muchas de estas técnicas pueden ofrecer una analgesia eficaz con menos toxicidad sistémica y dependencia, así como con una buena tolerancia por parte del paciente.
Las terapias intervencionistas que realizamos habitualmente para otras patologías, como los bloqueo de nervios y raíces, las infiltraciones miofasciales, la terapia intratecal, la neuromoduladora, etc., están resultando cada vez más eficaces en el tratamiento del dolor oncológico, y nos aportarían la respuesta a nuestra pregunta anterior: remitir de forma precoz a los pacientes oncológicos a las UD, puede ser un factor crucial para su adecuado tratamiento (4,5).
Para confirmar esta hipótesis, y verificarla, necesitamos disponer de datos propios dentro de las UD para analizarlos y saber qué acciones correctoras podemos realizar para mejorar su terapia.
MATERIAL Y MÉTODOS
Estudio retrospectivo y descriptivo, realizado durante un periodo de 23 meses, entre noviembre de 2019 y diciembre de 2021.
Se recogieron los datos de todos los pacientes oncológicos derivados a la UD, cuya causa de derivación fuera dolor de origen oncológico.
Se creó una base de datos donde se recogieron los siguientes datos:
En esa misma base de datos se recogió información sobre el manejo y la gestión de los pacientes una vez admitidos en la UD:
Las variables cuantitativas se expresaron como media ± desviación estándar y las cualitativas se expresaron mediante frecuencias. Para el análisis estadístico se utilizó el programa estadístico SPSS 25.0
RESULTADOS
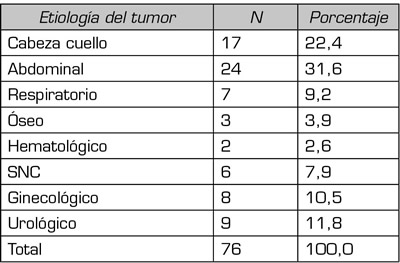
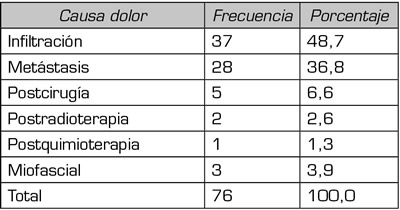
Se remitieron un total de 94 pacientes con el diagnóstico de dolor oncológico. Se excluyeron 18 pacientes porque ya estaban previamente en la unidad antes de noviembre del 2019 o porque tras la anamnesis, la causa del dolor no era el proceso oncológico, por lo que el número total de pacientes analizados fue de 78. El 63,2 % eran hombres y el 46,8 % mujeres. La edad media poblacional fue de 64,84 ± 12,623 años. Los tipos de tumores se encuentran descritos en la Tabla I y el origen del dolor en la Tabla II.
Tabla I. Frecuencia de tumores por localización.

Tabla II. Causas del dolor.
La remisión de estos pacientes en un 44,7 % la realizaron los servicios quirúrgicos y en menor medida Oncología médica y Radioterápica, Atención primaria y Medicina interna (Figura 1).
MAP: médico atención primaria.
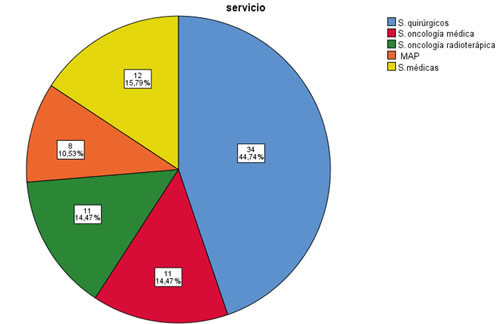
Fig. 1. Servicios remisores de pacientes a la Unidad de Dolor.
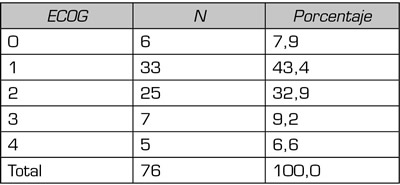
En la Tabla III vemos la escala ECOG en la que destaca que el 43,4 % de los pacientes remitidos no son capaces de desempeñar ningún trabajo y sus síntomas le obligan a permanecer en la cama durante varias horas al día.
Tabla III. Clasificación ECOG de los pacientes.
La terapia oncológica realizada, previo a la derivación a la UD, se recoge en la Tabla IV.
Tabla IV. Tratamientos realizados al paciente para el tratamiento de su tumoración y dolor.

Los tratamientos analgésicos pautados por otros especialistas, previo a la derivación a nuestra UD, fue en un 60 % con opioides mayores, con una EDM de 163,57 ± 167,10 mg. En el 50 % esta dosis incluía opioides de liberación rápida, para el dolor incidental, y se había intentado una rotación de opioides en el 22,4 %. Para el dolor de características mixtas, se habían asociado antineuropáticos al tratamiento opioide en un 38 %.
El tiempo medio de retardo en la atención en la UD desde la remisión de los servicios fue de 9,18 ± 9,73 días.
La intensidad de dolor en la primera consulta se recoge en la Figura 2, mediante la escala EVS. Se observa cómo el 75 % relataron que presentaban dolor moderado o severo en los momentos de mayor intensidad.
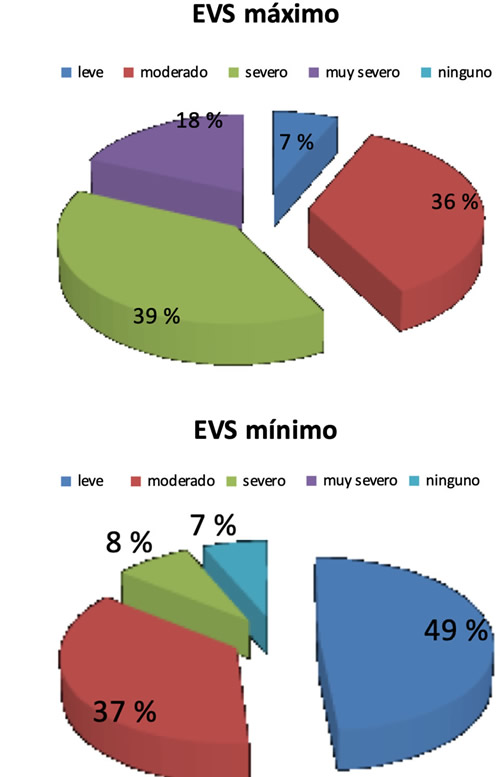
Fig. 2. Intensidad de dolor medido en la primera consulta en la Unidad de Dolor.
Los tratamientos farmacológicos realizados en la UD fueron: prescripción de opioides de novo en un 28,9 %, rotación de opioides en el 50 %, reducción de dosis de opioides en el 35,5 % y suspensión de opioides en el 2,6 %. La EDM durante el seguimiento en la unidad fue de 212,69 ± 170,16 mg.
Respecto a los fármacos de rescate: al 18,4 % se iniciaron rescates de opioides de liberación rápida y se les redujo a un 27,6 %. Los opioides de liberación rápida se pudieron suspender en el 14,5 % de los pacientes.
Con respecto a los antineuropáticos, se prescribieron de novo en el 68,4 % de los pacientes, al 53,9 % se le aumentaron, en el 11,8 % se disminuyeron y en un 6,6% se suspendieron.
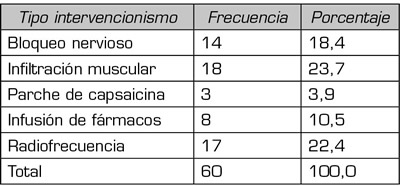
Se realizó intervencionismo menor en el 56,6 % (43) de los pacientes (Tabla V) y mayor en el 2,6 % (2).
Tabla V. Tipos de intervencionismos menores y su frecuencia.
Tras la llegada a la Unidad, un 72,4 % de los pacientes refirieron haber mejorado su dolor, no presentaron ninguna mejoría el 9,2% y el 31,6 % empeoró durante su estancia.
El periodo de seguimiento de los pacientes en la UD fue de 185,7 ± 62,97 días.
A la finalización del estudio, el 11,8 % continuaba en seguimiento por la UD, el 22,4 % habían sido dados de alta y el 65,8 % de los pacientes habían fallecido.
DISCUSIÓN
El dolor asociado al proceso oncológico sigue siendo un problema no resuelto. Sirva como ejemplo algunos datos extraídos de la literatura. En el trabajo clásico de Van den Beuken y cols. (6) se nos indica que, antes del 2004, el 33 % de los pacientes presentaban dolor después de los tratamientos curativos, el 59 % de los que estaban en tratamiento oncológico, y el 64 % de los que se encontraban en fases avanzadas, metastásicas o terminales de la enfermedad. De los pacientes con dolor, más de un tercio lo calificaban de moderado o severo. La prevalencia acumulada de dolor en pacientes con todo tipo de cáncer es superior al 50 %, alcanzando el 70 % en los de cabeza y cuello. Las escalas de calidad de vida asociadas a la salud (en inglés HRQOL), que entre otros parámetros contemplan el grado de dolor y anorexia, aportan información pronóstica sobre supervivencia en pacientes con cáncer. Así, en aquellos que presentaban dolor severo, la supervivencia media era de 27,24 meses frente a los 70,83 en los que los pacientes referían no tener dolor (7). En otro estudio realizado en cáncer de pulmón, también se encontró que las HRQOL, en las que se incluían tanto dolor como disfagia, predecía la supervivencia de los pacientes, siendo la supervivencia en el grupo con menores puntuaciones para esas variables del 50 % al año, del 30,6 % para el grupo intermedio y del 18,3 % para el grupo con puntuaciones más altas (8). En este sentido, el trabajo clásico de Smith indica que un tratamiento adecuado del dolor mediante terapia intratecal puede mejorar la supervivencia en pacientes oncológicos (9). Respecto al manejo del dolor en estos pacientes, la literatura nos permite ver tanto los avances obtenidos como los posibles obstáculos en la mejora de su manejo. En una revisión realizada entre 2007 y 2013 (10) se estimó que el infratratamiento del dolor había descendido en un 25 % en ese periodo temporal con respecto a referencias previas. En ese mismo trabajo se indica que, en el periodo de estudio comprendido entre 1994 y 2013, hasta un tercio de los pacientes no recibieron medicación analgésica ajustada a su grado de dolor. La revisión de van den Beuken y cols. que analiza el periodo 2005-2015 (11) nos muestra que en el periodo de tiempo de 10 años transcurridos con respecto al trabajo realizado en 2004, los datos epidemiológicos apenas habían cambiado. Uno de los problemas que se detectan en el mal control del dolor es el escaso porcentaje de pacientes que son tratados en unidades de dolor o en centros con los conocimientos y medios adecuados. En una revisión realizada en 11 países europeos e Israel entre 2006 y 2007 (12), sobre un total de 5084 pacientes, un 56 % sufría dolor de moderado a severo al menos de forma mensual; en un subgrupo de 573 pacientes, escogidos de forma aleatoria de ese mismo estudio, un 77 % recibía analgesia prescrita. Esta analgesia consistía en opioides mayores solos y en el 41 % asociados a otros fármacos analgésicos. De aquellos que tenían analgesia prescrita, un 63 % presentaba dolor irruptivo y un 69 % presentaba dolor relacionado con actividades de la vida diaria. En ese mismo estudio se nos indica que los profesionales que tratan el dolor con mayor frecuencia son: oncólogos médicos (42 %), médicos de atención primaria (19 %), cirujanos (4 %) y solo un 3 % son atendidos por especialistas en dolor.
Este marco formal del estado del dolor oncológico y de su manejo será el que nos permita realizar la interpretación de los datos obtenidos en nuestro estudio.
Analizaremos en primer lugar los datos de los pacientes antes de ser recibidos en nuestra UD. Respecto a los servicios remisores, encontramos que un 44,7 % de los casos la realizaron servicios quirúrgicos. Si consideramos que oncología médica y atención primaria son los profesionales que más se ocupan del tratamiento del dolor, tanto en Europa como en Israel (12), al igual que en nuestro país (13) (oncólogos 65 %, seguido de atención primaria 11 %, paliativistas 5,1 %, UD 4,9 % y oncólogo radioterapeuta 4,6 %), los resultados obtenidos en nuestro estudio indican que en nuestro medio sanitario debemos tomar medidas correctoras para conseguir que aquellos servicios que atienden mayor número de pacientes oncológicos sean también los que remitan más a nuestra unidad. En este sentido, hemos creado un comité hospitalario de dolor oncológico multidisciplinar para mejorar este problema.
Para mejorar la situación desde atención primaria, hemos sido pioneros en nuestro país en la implementación de la e-consulta (14). disponiendo actualmente de una implantación en el 100 % de los centros de salud de nuestra área sanitaria, y siendo el paciente oncológico un paciente preferente, esperamos conseguir una mayor tasa y fluidez en la remisión.
Un 30,3 % de los pacientes presentan dolor neuropático, lo que está en concordancia con las estimaciones de la literatura, donde se indican valores entre el 19 y 39,1 % (15). El 60,5 % presentaba dolor de tipo mixto, que es el perfil más habitual en las fases avanzadas de la enfermedad.
Respecto al tratamiento de los pacientes en el momento de la remisión, observamos que un 60 % recibía opioides mayores, lo cual deja un 40 % de pacientes sin este tipo de tratamiento. Para comparar estos datos hemos de recordar que hasta un tercio de la población no recibe medicación analgésica ajustada a su grado de dolor (10). En otra de las revisiones citadas (12), encontramos que solo el 41 % de los pacientes recibía tratamiento con opioides mayores. En nuestro estudio, el 60 % de pacientes tratados con opioides antes de la remisión parece mejorar la estadística, pero sigue poniendo de manifiesto el infratramiento del dolor oncológico. El hecho de que en el 22,4 % de los pacientes se hubiese intentado una rotación de opioides puede indicarse como un indicador de preocupación por el manejo de dolor. El que solo se hayan prescrito fármacos antineuropáticos al 38 % de los pacientes lo consideramos un dato negativo. El 50 % de los pacientes tenían prescrito opioides de liberación rápida para el dolor irruptivo. Esto es posiblemente un dato positivo ya que, según datos recientes, la estimación de pacientes que padecen dolor irruptivo en nuestro país oscila entre el 48 (16) y el 69 % (13).
Antes de llegar a la UD, en un 75 % de los pacientes, el dolor en los momentos de mayor intensidad era moderado o severo. Esto es un porcentaje notablemente mayor que el tercio de los pacientes relatado en la revisión de van de Beuken (6) o el 56 % indicado en la revisión de Breivik (7). Sin duda, este es un mal dato epidemiológico y debe ser corregido.
La EDM media antes de la remisión fue de 163,57 ± 167,10 mg. La evaluación de estos datos es compleja, ya que la literatura no establece unos límites claros en la población oncológica. Muchos médicos, no especialistas en dolor, todavía consideran que los opioides no tienen techo analgésico. Si revisamos las recomendaciones sobre dosis empleadas en pacientes con dolor crónico no oncológico, podemos encontrar cifras que oscilarían entre 50 y 200 EDM. En líneas generales, los datos de seguridad aconsejan reducir en la medida de lo posible la cantidad y la duración del tratamiento con opioides, tanto en pacientes no oncológicos como oncológicos (17) y limitar las dosis a valores entre 50 y 90 EDM en no oncológicos (18). En un artículo donde se revisan los factores predictores de éxito en un bloqueo celiaco, se identificó que dosis de opioides inferiores a 150 EDM eran uno de los predictores independientes de eficacia (19). Por estas razones, abogamos por un uso más restrictivo de los opioides, y creemos que los pacientes deberían ser remitidos antes de superar cifras de 100 EDM.
La rotación de opioide es una práctica clínica habitual, con la cual se pretende o bien mejorar la eficacia analgésica o reducir los efectos secundarios de estos fármacos. En una revisión publicada sobre esta práctica (20), se apreció una mejoría en los grados de analgesia y toxicidad al realizar la rotación. Al no encontrarse estudios aleatorizados se le otorgó un grado de evidencia D. En este sentido, en un 22,4 % de los pacientes estudiados se había probado una rotación antes de su llegada a la unidad y se realizó en un 50 % de ellos una vez admitidos en nuestro servicio.
En lo referente a los tiempos de atención a los pacientes, las recomendaciones de la IASP (21) sobre tiempos de atención preferente sugieren que para pacientes con dolor por proceso oncológico terminal sea de 7 días. Nuestra media de espera es de 9,18 ± 9,73 días para cualquier tipo de paciente oncológico, independientemente de su estado, con lo cual creemos que nos ajustamos de forma razonable a este parámetro de calidad.
Tras la remisión y aceptación del paciente en la Unidad del dolor, se realizó un intervencionismo menor en el 56,6 % (43) de los pacientes y un intervencionismo mayor en el 2,6 %. Para interpretar estos datos, podemos compararlos con los publicados por el grupo de Pérez y cols. (22), donde nos indica que un 28,2 % de los pacientes recibieron terapia intervencionista. En otra publicación del mismo grupo (23), realizada posteriormente, se realizaron intervencionismos en 126 pacientes de 398 atendidos (31,65 %).
Entre las técnicas aplicadas en nuestra unidad, destaca que la más empleada fue la desactivación miofascial (23,7 %). Es una técnica sencilla y con escasos riesgos que ha demostrado utilidad en el manejo de pacientes en fases avanzadas, con pocos PG y restringidos a zonas asociadas al dolor oncológico (24). Tanto la RF como los bloqueos nerviosos fueron las siguientes en frecuencia y aunque no se indica evidencia en la literatura, existe una tendencia a su mayor empleo, ya que el advenimiento de la ecografía permite una aplicación más segura y en general se recomienda su uso como alternativa de tratamiento (25). Se realizaron un 2,6 % de intervencionismos mayores, lo que representa un total de 2 pacientes, a los que se implantaron bombas de infusión intratecal, cifra que se encuentra entre las referencias de la literatura que ofrecen un abanico entre el 2 y 5 % de los pacientes refractarios, en los que esta técnica sería una alternativa plausible (26). Otros intervencionismos con evidencia demostrada, como los bloqueos del plexo celiaco, la vértebro o cifoplastia, no están representados en nuestra muestra y eso nos indica un campo donde debemos mejorar.
En nuestra UD consideramos que el intervencionismo no se debe contemplar como un cuarto escalón, que se aplica solo cuando nada funciona; y pensamos que debe ser considerado en cualquier momento del manejo del paciente si se prevé una mejoría en la funcionalidad y calidad de vida (27,28).
A modo de resumen, la aportación que realizamos en el manejo farmacológico se puede sintetizar de la siguiente manera: optimización de los tratamientos farmacológicos para ajustarlos al grado de dolor del paciente. Se inició tratamiento opioide en un 28,9 % de la muestra, rescate en el 18,4 % y se añadió antineuropáticos al 53,9 %. Estos datos nos indican que hay un cierto margen en la implementación de los tratamientos, concretamente un 40 % de pacientes remitidos no tenían tratamiento con opioides. El análisis de estos datos podemos realizarlo mediante al Pain Management Index (PMI[s]). Este es un índice de calidad analgésica que pretende establecer una relación entre el grado de dolor del paciente y si la pauta de opioides es adecuada a ese grado de dolor. El hecho de haber iniciado tratamiento con opioides mayores en un 28,9 % de los pacientes y añadir rescates en el 18,4 %, nos hace pensar que hemos mejorado este índice, pero la aplicación de intervencionismos y ajuste de antineuropáticos no permite una valoración clara en la mejora del PMI, ya que son aspectos no contemplados en la elaboración de dicho índice. El otro aspecto donde se aprecia un déficit terapéutico es en la indicación de antineuropáticos. Los iniciamos a un 68,4 % de los pacientes. Sabemos que la prevalencia de dolor neuropático o mixto en la muestra es alta (30,3 %, y 60,5 %, respectivamente). Por ello, consideramos que realizar labores de formación en la detección, diagnóstico e inicio de tratamiento del dolor neuropático es un área de actuación fundamental.
Las variaciones en los consumos de fármacos son un posible indicador del resultado de las acciones de una UD. Así, hasta en el 35,5 % de los casos se pudo reducir las dosis de opioides, al 2,6 % se les suspendió su administración sistémica (los 2 pacientes con terapia intratecal). En el 27,6 % de los pacientes se logró reducir la cuantía de los rescates y se lograron suspender en el 14,5 %. En nuestra opinión, esto es un indicador indirecto de mejoría en la calidad asistencial.
Globalmente el consumo de opioides mayores aumentó de forma significativa de 162,21 ± 166,41 mg antes de su llegada al 212,69 ± 170,16 mg durante su estancia en nuestra unidad. Este dato es un reflejo del progreso de la enfermedad y del incremento de dolor asociado a la misma.
Una de las modificaciones más claras en el manejo de fármacos fue la necesidad de iniciar los antineuropáticos [t]en el 68,4 % de los pacientes, en un 53,9 fue necesario aumentarlos y solo se pudo reducir en el 11,8 % y suspender en 6,6 %. El resultado de los antineuropáticos nos está indicando que sigue siendo un problema infratratado, y que además se vuelve más relevante con el progreso de la enfermedad y ello hace que su consumo aumente durante el seguimiento.
El seguimiento medio de los pacientes en la unidad fue de 185,7 ± 162,97 días.
A la finalización del estudio, un 11,8 % continuaban en seguimiento, un 22,4 % habían sido dados de alta y el 65,8 % habían fallecido.
A modo de síntesis: un 72,4 % de los pacientes refirieron haber mejorado de su dolor durante algún periodo de su seguimiento, un 9,2 % no observó ningún cambio y el 31,6 % empeoraron en algún momento de la evolución. Son resultados de difícil interpretación por la falta de referencias claras en nuestro medio hospitalario, pero nos habla de la naturaleza cambiante en el tiempo del dolor oncológico, donde en ciertos pacientes se puede encontrar una estabilización clínica debido al control de la enfermedad de base, pero en una amplia proporción (recordar que hasta el 65,8 % fallecieron) la evolución es hacia el incremento del dolor y del consumo de fármacos según nos vamos acercando a las fases terminales y paliativas.
Puntos relevantes del trabajo
Permite conocer los datos de remisión de los pacientes y tomar medidas correctoras sobre aspectos importantes. En nuestro caso hemos detectado problemas en: servicios de procedencia de los pacientes, nivel de dolor a su llegada, manejo farmacológico previo.
Nos permite conocer aspectos mejorables en el manejo en nuestra unidad: aplicación de mayor número de intervencionismos con evidencia de eficacia.
Puntos débiles
La mala calidad de los datos recogidos que provienen de las referencias encontradas en la historia clínica. En este sentido nos indica campos de mejora, como sería enviar protocolos de remisión fáciles de rellenar y que contengan información que se pueda procesar estadísticamente. También hemos detectado una mala praxis a la hora de reflejar en nuestras notas evolutivas aspectos tan importantes como: medición del nivel del dolor, reflejar los cambios en las medicaciones y sus causas, así como una sistemática falta de registro de la impresión del paciente en la evolución de su cuadro.
A modo de resumen, pensamos que la dirección que se debe tomar en el cuidado de los pacientes con dolor relacionado con su proceso oncológico, deben ceñirse en la mediada de lo posible a las recomendaciones de calidad y evidencias realizadas por la EFIC (29), lo que permitirá una unificación en los criterios asistenciales a esta población.
CONCLUSIONES
BIBLIOGRAFÍA