DOI: 10.20986/resed.2019.3681/2018
ORIGINAL
Deshabituación rápida de opioides
M. J. Pujante Tortosa1 , M. C. Ribera Montés1 , C. Embid Román1 , F. Pascual Pastor2 y C. Sánchez Pérez3
1Médico Adjunto Servicio de Anestesiología. Cuidados Intensivos y Unidad de Dolor. Hospital General Universitario de Elda. 2Coordinador de Unidad de Conductas Adictivas. UCA Departamento de Salud de Alcoi. 3Jefe del Servicio de Anestesiología, Cuidados Intensivos y Unidad de Dolor Hospital General Universitario de Elda. Alicante, España
Recibido: 26-04-2018
Aceptado: 14-11-2018
Correspondencia: Calixto Andrés Sánchez Pérez
sanchez_cal@gva.es
ABSTRACT
Introduction: For the last 15 years we have witnessed a steady increase in opioid consumption. Being aware of an undertreatment in certain pain situations, many health care providers have encouraged their physicians to prescribe opioids to avoid unnecessary suffering. Such encouragement, also by means of switching from the traditional paper prescription to the current electronic one, has led to a wide spread in opioid prescription even among those medical specialities which never did before. Besides, new synthetic opioids with apparently less side effects, favourable kinetics and easer to take, might have arosen a wrong impression of unreal harmlessness. Therefore, the increased prescription and its obvious consequence of consumption has led to an alarming increase in the number of side effects, proving our patients not to be so well controlled. We have perceived in our Health Department several different patients with opioid consumption abuse derived from medical prescription with potential life threatening side effects, that´s why we have conducted a medical path for their detoxification.
Aim: To perform a safe fast opioid detoxification (FOD) in our fully monitored patients.
Method and materials: To perform our FOD path we previously admit the patients in our ICU unit. After a careful clinical, psychological, social and biological assessment, and having requested their informed consent, we monitor all their vital constants in bed and we start a deep polymodal sedation up to the required level for each patient, getting even ready for oral intubation and mechanical ventilation if needed. Our regular vital maintenance is based on fluids, deep vein thrombosis prophylaxis, digestive prophylaxis, physiotherapy, urine output and blood tests for 96 hours. Having achieved our goal, regarding the patients are stable, they are discharged to the ward for an additional 48 hours period, with psyquiatric treatment and under the care of the Addictive Conducts Unit. The patients are finally discharged from hospital with a multimodal supervision and treatment conducted by our Pain Unit, Addictive Conducts Unit and Physical Rehabilitation.
Results: We describe the results achieved with two different drug approaches which combine different pharmacological groups frequently used for detoxification: midazolam, propofol, ketamine, clonidine and naloxone, for our aim of succeeding in keeping the patients opioid-free without endangering their haemodynamic, breathe or biology.
Conclusions: FOD has proved to be a successful treatment in rescuing the patients from a living hell out of which they would have found it impossible to leave without qualified help. We deem it safe with the right ICU surveillance, since no major complications have occurred, but a thereafter following and help is mandatory, since, like any other patient attended at a Pain Clinic, they require a favouring social and familiar environment to avoid any relapse. Finally, and given our results, we consider this detoxification method right and safe but highly costly in resources.
Key words: Opioids, opioids abuse, fast opioid detoxification, FOD.
RESUMEN
Introducción: En estos últimos 15 años, el incremento del uso de analgésicos opioides ha sido progresivo y elevado. La percepción de la existencia de cuadros de dolor mal tratados ha provocado que muchos sistemas de salud incentiven a los profesionales en el uso de opioides, para evitar episodios de sufrimiento inútiles y estériles. Dicha incentivación, el uso de receta electrónica, la facilitación y simpleza de prescripción tras la desaparición de receta de estupefacientes tradicional, supuso una liberalización significativa y uso de opioides progresivo entre todas las especialidades médicas que habitualmente no los prescribían. Además, la aparición de nuevos opioides sintéticos, con aparentemente menores efectos secundarios, fáciles de usar y con buen perfil farmacocinético, quizás ha suscitado una confianza irreal en la inocuidad de dichos fármacos.
Estos últimos años han sido años de alta prescripción y de hallazgo de efectos no deseados por los elevados consumos y prescripciones un tanto quizá alejadas de la idoneidad y poco control sobre los pacientes. Nosotros detectamos en nuestro departamento de salud varios casos de pacientes con problemas reales derivados del consumo de opioides, de origen iatrogénico, siempre por prescripción médica legal y con gravísimos efectos secundarios, que conllevaban riesgo vital.
Objetivo: Realizar una deshabituación rápida del consumo de opioides, sin poner en riesgo la salud y vida del paciente, de un modo rigurosamente monitorizado y controlado.
Material y métodos: Nuestra comunicación científica se basa en la descripción del trabajo realizado sobre un grupo de pacientes afectados por un elevado consumo de opioides. Nuestro método de deshabituación a los opioides consiste en el ingreso de los pacientes en la Unidad de Cuidados Intensivos del Servicio de Anestesiología de nuestro hospital para la retirada absoluta de los mismos. Se realiza en primer lugar una valoración basal clínica, psicológica, social y biológica, y tras solicitar un consentimiento informado, se procede a una retirada de los opioides, con monitorización avanzada e inicio de sedación profunda multimodal, hasta el nivel que sea necesario para cada paciente, incluso con previsión de posible intubación orotraqueal y asistencia ventilatoria. Realizamos mantenimiento vital convencional de cuidados intensivos, con fluidoterapia, profilaxis antitrombótica, protección digestiva, fisioterapia, control de diuresis y control bioquímico, metabólico y nutricional durante 96 horas. Posteriormente, el paciente, tras asegurar su estabilidad y seguridad, pasa a una planta de hospitalización convencional durante unas 48 horas, con tratamiento de perfil psiquiátrico manejado por la Unidad de Conductas Adictivas. Tras ser dado de alta hospitalaria, se continúa tratamiento y control por Unidad de Conductas Adictivas, Unidad de Dolor y Unidad de Rehabilitación Física.
Resultados: Describimos los resultados obtenidos con el uso de dos pautas en las que se combinan distintos grupos farmacológicos usados para la deshabituación: midazolam, propofol, ketamina, dexmedetomidina, clonidina y naloxona, en la consecución del mantenimiento del paciente libre de opioides garantizando la estabilidad hemodinámica, respiratoria y la seguridad biológica del paciente.
Conclusiones: La desconexión rápida de opioides es un tratamiento eficaz, que recupera al paciente de un infierno vital grave del que difícilmente se puede salir sin una ayuda externa. Lo consideramos un método seguro, ya que no se nos ha presentado ninguna complicación severa, aunque son pacientes que precisan de unos cuidados médicos de vigilancia intensiva. El posterior seguimiento y ayuda es imprescindible, aunque como pacientes de dolor, precisan de un buen entorno social y familiar, para conseguir el apoyo necesario y no volver a recaer. Por todo ello, y en base a los resultados obtenidos en nuestro estudio, consideramos que es un método adecuado y eficaz, aunque caro en recursos.
Palabras clave: Opioides, abuso de opioides, deshabituación rápida de opioides, DRAO.
INTRODUCCIÓN
El uso de terapia a largo plazo con opioides para el dolor crónico no oncológico (DCNO) ha aumentado significativamente en las últimas décadas, así como la posterior introducción de formulaciones de opioides de liberación rápida en estos casos podría haber producido un aumento de los casos de adicción en pacientes con DCNO (1). La proporción de pacientes con adicción yatrogénica a opioides es muy difícil de estimar debido a la ausencia de definiciones y criterios específicos para pacientes con dolor crónico y uso de opiodes (2).
Los criterios utilizados para el diagnóstico del trastorno por consumo de opioides (TCO) se basan en el Diagnostic and Statistical Manual of Mental Disorders (DSM), 5.ª edición (DSM-5) (3).
El DSM-5 define el trastorno por consumo de opioides como un conjunto de síntomas cognitivos, conductuales y psicológicos que llevan a un individuo al uso continuado de una sustancia a pesar de los problemas relacionados con el uso de la misma (4).
El abuso de los opioides produce alteraciones de los circuitos cerebrales, que son las causas subyacentes para el desarrollo de la dependencia y la adicción a estas sustancias. La dependencia se refiere a la necesidad imperiosa de continuar el consumo de opioides para evitar el síndrome de abstinencia, y la adicción se define como una enfermedad crónica y recurrente del cerebro que se caracteriza por la búsqueda y el consumo compulsivo de sustancias a pesar de sus consecuencias nocivas, incapacidad para dejar de usar la sustancia, incumplimiento de las obligaciones laborales, sociales o familiares y, en ocasiones, y según la sustancia, la tolerancia y la privación o abstinencia.
Se han descrito factores de riesgo que se asocian a un incremento del uso inapropiado de los analgésicos opioides cuando son prescritos para el manejo del dolor crónico, como el trastorno por abuso de sustancias, la historia familiar de abuso de sustancias, enfermedad mental asociada, historia de problemas legales o encarcelamiento, raza blanca y edad menor de 40-45 años (5).
En las unidades de dolor se tratan pacientes derivados por otras especialidades, diagnosticados de diversas patologías, con dolor crónico en general valorado de moderado a severo, que en su evolución precisan del uso de opioides. Estos tratamientos, en potencia, pueden provocar cuadros adictivos, por lo que precisan por parte de los profesionales especialistas en el tratamiento del dolor un seguimiento exhaustivo para detectar los casos que pudieran desarrollar dichos cuadros.
Otros conceptos importantes a tener en cuenta son los de tolerancia y dependencia. La tolerancia es el estado de adaptación en el que se requiere incremento en las dosis del opioide para obtener el efecto deseado, o bien se produce disminución del efecto de la sustancia en el tiempo (6).
El uso continuado de opioides para el control del dolor crea dependencia. En la dependencia física a opioides existe una alteración en la respuesta fisiológica resultante de la adaptación de la unión opioide-receptor, debido al consumo crónico, caracterizado por la presencia de abstinencia que se produce tras el cese abrupto, la reducción rápida, el descenso del nivel del fármaco en la sangre y/o la administración de un antagonista (7). Es importante diferenciar este término de adicción, que describe un desorden neurobiológico crónico que conlleva un uso aberrante del opioide y un comportamiento social inadaptado que implica una pérdida de autocontrol que conduce a un uso compulsivo y muchas veces autodestructivo (8).
En el presente artículo describimos seis casos de deshabituación rápida de opioides realizados en la unidad de reanimación de nuestro hospital, entre los años 2011 y 2016, de pacientes en los que se detectaron síntomas de adicción a los mismos.
DRAO: MÉTODO DE DESHABITUACIÓN
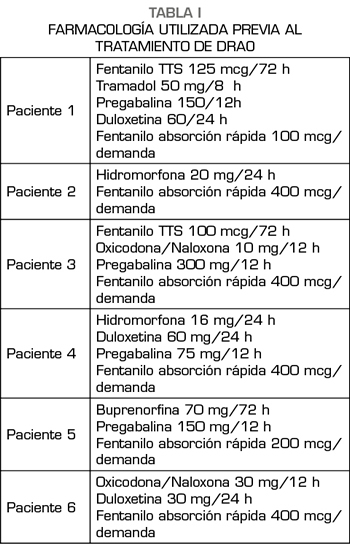
Todos los pacientes habían sido diagnosticados de dolores de tipo neuropático, de años de evolución, con valores de > 7 respecto a su intensidad en la escala analógica EVA, en los que se habían utilizado distintos neuromoduladores así como opioides, desde menores a mayores, como indica la escalera analgésica de la OMS (Tabla I).

Se trata de dos mujeres y cuatro hombres de edades comprendidas entre los 36 y los 53 años (en el año en el que se realizó el DRAO) integrados socialmente con familiares que les apoyaban, y sin antecedentes médicos que contraindicasen la deshabituación.
Los casos descritos en el presente estudio fueron diagnosticados en su totalidad en la consulta de la Unidad del Dolor de nuestro Departamento de Salud (220.000 habitantes), cuatro de ellos derivados de atención primaria y después de tratados en nuestra unidad, y dos de ellos tras ser derivados desde atención primaria con tratamientos ya instaurados por sus médicos de familia.
Todos ellos tuvieron un punto en común, que consistió en la utilización de fentanilo de acción rápida para el tratamiento del dolor irruptivo no oncológico un tiempo antes de comenzar a aumentar sus demandas asistenciales para la prescripción de los mismos, ya que su consumo fue en aumento no solo en las dosis diarias administradas sino en la cantidad de microgramos prescrita. Este hecho, junto con la aparición de inquietud y agresividad en las consultas y la negación de que su tratamiento de base fuese efectivo, constatada por los anestesiólogos, por nuestra enfermería que atiende consultas telefónicas en la UDO, así como por los familiares, fueron los síntomas que nos hicieron llegar al diagnóstico de síndrome de adicción y plantearnos una solución a la misma (4).
Tras el diagnóstico de síndrome de adicción (DSM5 nivel 3, trastorno por consumo de opioides de carácter grave), en todos los casos se citó al paciente junto con un familiar directo y se les informó exhaustivamente sobre la adicción que padecía y sobre la posibilidad de ingresar en la unidad de reanimación, donde se le trataría durante unos días, los fármacos que se utilizarían, la monitorización de constantes vitales y los riesgos a los que se exponía. Todos los pacientes aceptaron y firmaron un consentimiento informado junto con su familiar y un anestesiólogo de nuestra unidad.
MÉTODO
Los pacientes ingresaron en todos los casos por la mañana de un lunes en ayunas, se les canalizó una vena periférica, se les colocó una sonda nasogástrica y una sonda urinaria y se les extrajo sangre para una analítica basal que constó de hemograma, bioquímica y coagulación.
Se monitorizaron la TA no invasiva, el ECG, la saturación de O2, la diuresis y la temperatura horaria.
Se establecieron dos grupos de tratamiento (Tabla II).
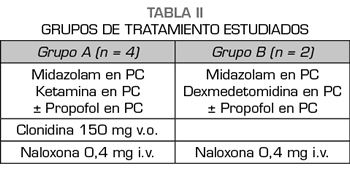
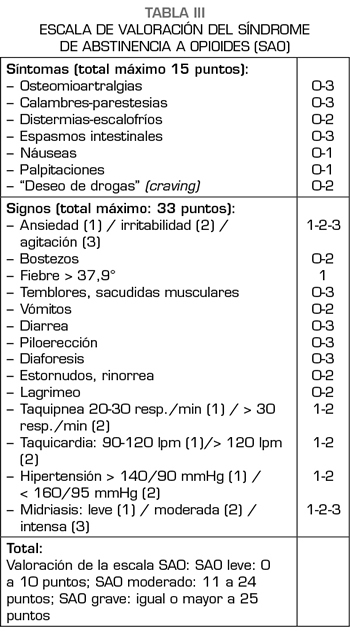
En cuatro de los pacientes el tratamiento de base consistió en una perfusión de ketamina y midazolam más propofol, que se reservó como fármaco a utilizar, si tras horas de ingreso sin la administración de ningún opioide el paciente precisaba una sedación más profunda. A estos cuatro pacientes se les administró clonidina 150 mg 1 comprimido a través de la SNG cada 12 h, enoxaparina s.c. cada 24 h a dosis profilácticas de TVP y omeprazol 40 mg i.v. cada 24 h. Para los síntomas y signos esperables de una abstinencia a opioides (Tabla III) (tales como HTA, diarrea, mialgias, vómitos, ansiedad, etc.), protocolizamos la administración de labetalol, loperamida, paracetamol/desketoprofeno y ondansetrón, según fuesen apareciendo dichos síntomas y signos, siempre que no hubiesen contraindicaciones individuales para su uso.
En los dos casos restantes, los fármacos utilizados para la sedación durante el proceso de deshabituación fueron la dexmedetomidina y el midazolam, dejando al propofol, como en los cuatro primeros casos, para aumentar el nivel de sedación cuando comenzasen los signos de abstinencia. Asimismo, se les realizó la protección gástrica, la profilaxis de la TVP con heparina de bajo peso molecular por inmovilización prolongada, pero en estos últimos dos casos no se utilizó clonidina por vía oral, ya que es una molécula que actúa a nivel central sobre los mismos receptores que la dexmedetomidina (9).
A todos los pacientes, durante el proceso, se les valoró mediante la escala de valoración del síndrome de abstinencia a opiáceos (SAO) hasta que cesaron los signos de deshabituación (Tabla III) (10).
RESULTADOS
Las dosis utilizadas siempre fueron individualizadas según las necesidades de cada paciente y en dosis crecientes, según precisaron:
– Midazolam: se inició la perfusión de 0,05 a
0,1 mg/kg/h, alcanzándose dosis máximas de 7 mg/h.
– Ketamina: inicio a 0,1 mg/kg/h llegando a dosis máximas de 20 mg/h.
– Dexmedetomidina: se inició a 0,2 mcg/kg/h y se alcanzaron dosis de 1,4 mcg/kg/h.
– Propofol: se inició según necesidad de los pacientes y sus dosis oscilaron entre 1 mg/kg/h y
2 mg/kg/h.
Los dos pacientes tratados con midazolam y dexmedetomidina precisaron perfusión de propofol entre las diez y doce horas tras el inicio del proceso de deshabituación, mientras que de los 4 pacientes tratados con midazolam, ketamina y clonidina, un caso no precisó perfusión de propofol y en los 3 restantes la perfusión de propofol se inició más tardíamente, entre las 30 y las 36 h del inicio del proceso de deshabituación.
En los 4 casos en los que la sedación consistió en una perfusión de midazolam y de ketamina, los signos de abstinencia fueron menos marcados que en los dos casos en los que utilizamos perfusiones de midazolam y dexmedetomidina, y además las dosis de perfusión de propofol en los 4 primeros casos fueron menores que las del grupo midazolam-dexmedetomidina (Tabla IV).

Tanto las perfusiones de ketamina como las de dexmedetomidina no se mantuvieron más de 72 horas, y siempre se fueron disminuyendo progresivamente hasta la suspensión, manteniéndose la perfusión de midazolam y propofol que, posteriormente, se fueron disminuyendo poco a poco hasta la suspensión.
Con respecto al cese de los síntomas y signos de abstinencia, estos ocurrieron en todos los casos entre las 72 y las 96 horas, momento en el cual se les administró una dosis de 0,4 mg de naloxona i.v. y se observaron las respuestas de cada paciente, sin que ninguno de los casos manifestase signos de deprivación de opioides.
La duración del ingreso en la unidad de reanimación fue de cinco días en todos los pacientes, excepto un caso que permaneció ingresado en la unidad durante 8 días. En este último caso, el paciente era adicto también a la nicotina y con antecedente de enolismo moderado asociado. No hubo ningún caso de depresión respiratoria ni de dolor severo o agitación psicomotriz que precisase de la intubación del paciente.
Los pacientes se dan de alta habitualmente al quinto día a planta de hospitalización convencional, donde se mantienen 48 horas cumpliendo tratamiento alternativo, y observando si se produce algún tipo de complicación.
Tras el alta, se iniciaron tratamientos con neuromoduladores, olanzapina y en dos casos además con THC (tetrahidrocannabinol) en spray sublingual para crisis de dolor neuropático en “salvas”.
Todos los pacientes, tras la deshabituación, fueron remitidos a la unidad de conductas adictivas para seguimiento evolutivo y continuaron con las revisiones periódicas en nuestra unidad.
DISCUSIÓN
La adicción a opioides es una compleja enfermedad difícil de tratar. El tratamiento se divide en tres procesos: estabilización, desintoxicación y mantenimiento (11). La estabilización consiste en la sustitución del opioide por tratamientos que garanticen que el uso de la droga sea independiente del estado mental y de las circunstancias. La desintoxicación consiste en la retirada del opioide de forma segura y efectiva, minimizando el síndrome de abstinencia (con fármacos agonistas de los receptores de opiáceos, como metadona o buprenorfina o bien con agonistas de los receptores alfa-2 adrenérgicos como la clonidina o dexmedetomidina). El mantenimiento consiste en la prevención de las recaídas (generalmente con la administración de antagonistas de los receptores de opioides, como la naloxona o naltrexona).
Los problemas que la experiencia clínica nos ha ayudado a observar son que, desde la introducción en los tratamientos fuera de ficha técnica (pacientes no oncológicos) de los “fentanilos rápidos”, la “fascinación” que produce el efecto del fármaco a través de áreas de estimulación cerebral (con gran sentimiento de gratificación) es mayor que la analgesia en sus primeros momentos. Ello produce que casi todos nuestros pacientes no oncológicos, incluidos en el programa DRAO, tendieran a abandonar el tratamiento de base, opioides, coadyuvantes, etc., en favor de realizar analgesia mediada por el opioide rápido exclusivamente y en dosis absolutamente mayores a las recomendadas por su médico, tanto en cantidad por dosis como en frecuencia de las mismas. De hecho, es la mayor recomendación que hacemos: el seguimiento farmacoterapéutico exhaustivo de los pacientes que lleven tratamiento con fentanilo rápido fuera de ficha técnica, así como la realización de un pacto de tiempo y valoración de la eficacia terapéutica mientras se evalúan otras alternativas que nos permitan retirar precozmente estos fármacos. En general, podemos decir que la incidencia de sobredosificación y problemas iatrogénicos con este fentanilo rápido es casi inexistente cuando se prescribe y controla desde nuestra Unidad de Dolor, no así cuando es prescrito por otras especialidades médicas, con menor conocimiento del problema generado por el uso crónico de opioides.
El manejo tradicional en la década de los 1970 de este síndrome implicaba o bien la sustitución por un opioide de larga duración como la metadona y su posterior retirada gradual, o la no utilización de opioides (clonidina con adyuvantes como analgésicos, hipnóticos y benzodiacepinas). Generalmente, en ambos procesos posteriormente se introducía de forma gradual un antagonista de los receptores mu como la naltrexona (12,13). La tasa de fracaso y recaídas en ambos casos era elevada debido al malestar y desasosiego que durante el procedimiento experimentaban los pacientes; por ello, en la década de 1980, Loimer y cols. (14) desarrollaron por primera vez este proceso de desintoxicación con anestesia general e intubación, basándose en las publicaciones de la Universidad de Yale (15) acerca de los métodos de desintoxicación rápida a opiáceos.
A partir de este momento, distintos grupos de investigadores han ido introduciendo mejoras y modificaciones en la técnica ultra-rápida de desintoxicación a opiáceos (16).
Los estudios de eficacia de los métodos de retirada paulatina de opioides mediante tratamiento con metadona o buprenorfina versus los nuevos métodos de desintoxicación rápida y ultrarrápida no han podido demostrar los claros beneficios en cuanto una técnica u otra. Los clínicos deben guiarse por la respuesta de los pacientes para determinar la duración del periodo de retirada de opioides (17).
Johnson y Carr (18), muy posteriormente en 2003, proponen la siguiente clasificación:
– En la deshabituación a opioides ultra-rápida, el uso de anestesia general se emplea durante menos de 6 horas.
– En la deshabituación rápida a opioides, se utiliza una sedación profunda que varía entre 6 y 72 horas en los estudios descritos.
Varios estudios han descrito las técnicas de deshabituación rápida a lo largo de los años, todos ellos utilizando agentes anestésicos potentes que inducen una hipnosis profunda para mitigar los síntomas de la abstinencia. No se conoce exactamente por qué mecanismos los agentes anestésicos son capaces de bloquear la expresión de la retirada de opioides, pero una de las explicaciones podría estar en la interferencia de estos fármacos con el glutamato, el cual está íntimamente asociado a una hiperactividad noradrenérgica que en parte está debajo de la fisiopatología del síndrome de abstinencia (19).
Los resultados de eficacia de las deshabituaciones ultrarrápidas no son nada claros y, por tanto, las recomendaciones sobre su uso son controvertidas. En una revisión reciente publicada en 2015 no se recomiendan las técnicas de deshabituación ultrarrápida a opioides bajo anestesia general debido al registro de serias complicaciones en la bibliografía, incluyendo parada cardiaca y muerte (20,21). En una revisión sistemática de 5 estudios randomizados, concluyen que no es aconsejable su uso debido a la falta de beneficio y los riesgos documentados potenciales y los grandes costes que generan los ingresos en los pacientes en unidades de cuidados intensivos en base a realizar anestesia general o sedaciones profundas (22).
Otro punto a discutir son los diferentes fármacos que hemos utilizado en la elaboración de nuestro protocolo de DRAO.
En las técnicas de deshabituación a opioides mediante inducción a la anestesia general se aprueba la utilización de fármacos como la clonidina y la dexmedetomidina, fármacos que en nuestra unidad de cuidados intensivos utilizamos de manera protocolizada. Describimos a continuación los motivos farmacológicos por los cuales estos fármacos resultan efectivos, aunque su indicación está fuera de ficha técnica.
Debido a la gran actividad noradrenégica que se desencadena tras la retirada de opioides (síndrome de abstinencia característico), la utilización de α2 agonistas, como la clonidina o la dexmedetomidina, ha sido exitosa en gran cantidad de estudios publicados. Su principal limitación a la utilización es el efecto antihipertensivo. Sus efectos beneficiosos en este cometido son su actividad sedante, la reducción de la activación del sistema nervioso simpático y la disminución en los requerimientos de opioides descrita por mecanismos escasamente conocidos pero que parecen estar relacionados con su actividad sobre el núcleo ceruleus.
Los fármacos α2 agonistas suelen combinarse con otro tipo de fármacos, que también empleamos de manera protocolizada en nuestro estudio. Dichos fármacos son las benzodiacepinas, en nuestro caso perfusión continua (PC) de midazolam, ideales para la reducción de los niveles de ansiedad y mejoría de los niveles de sedación, ondansetrón para la disminución de las náuseas y vómitos y la loperamida para el tratamiento de la diarrea que presentan los pacientes con síndrome de abstinencia. Otros fármacos utilizados en nuestro estudio son el propofol, hipnótico que en PC controlada por TCI (Target Controled Infusion) resulta ideal en sedaciones donde se pretende mantener la ventilación espontánea, y la ketamina, cuya actividad simpática podría resultar conflictiva en su uso para las deshabituaciones a opioides pero que, como hemos observado en nuestro estudio, su potencia analgésica nos resulta de utilidad en combinación con el resto de fármacos utilizados.
La ketamina es un fármaco ampliamente utilizado en anestesia. Es clasificado como antagonista de los receptores NMDA pero tiene otras muchas acciones sobre los receptores de los opioides mu, delta y kappa, y además inhibe la recaptación de serotonina, dopamina y norepinefrina (23). Este mecanismo de acción ha sido utilizado en anestesia para disminuir la tolerancia a los opioides, reduce el consumo de analgésicos y además aumenta el tiempo en el que se comienzan a consumir analgésicos en el periodo postoperatorio (24). Más aún, tiene sentido su utilización en pacientes que presentan dolor crónico establecido.
Existen casos de publicaciones de deshabituaciones a opioides exitosas con ketamina, incluso con ketamina vía oral (23). En un grupo de 58 pacientes también fue exitosa la administración de perfusiones continuas de ketamina en dosis subanestésicas, dosis de
0,5 mg/kg/h. El grupo que fue tratado con ketamina experimentó un mejor control de síntomas del síndrome de abstinencia (25). Estos datos concuerdan con los hallazgos observados en nuestro estudio que, pese a las limitaciones del tamaño muestral, el grupo tratado con ketamina presentó menos signos y síntomas asociados al síndrome de abstinencia por la deprivación de opioides y menor consumo de propofol.
La observación de nuestros resultados a medio y largo plazo sobre los pacientes tratados nos ratifican en la necesidad de hacer ver al paciente:
1. El riesgo permanente de recaída que van a tener a lo largo de su vida.
2. Que debe informar inmediatamente a su anestesiólogo si va a ser intervenido quirúrgicamente.
3. Que va a ser controlado frecuentemente por los especialistas de unidad de dolor, conductas adictivas, psiquiatría y psicología, dado que ha salido de una enfermedad muy grave y su salud debe ser vigilada.
En general, nuestros pacientes refieren haber tenido una “segunda oportunidad” de vida. Siguen con cuadros de dolor pero, en general, refieren ser menos intensos que antes del tratamiento, pero sobre todo refieren haber ganado infinitamente en calidad de vida, ya que se encontraban inmersos en la espiral de efectos secundarios de los opioides a todos los niveles, empeorando incluso severamente la percepción dolorosa. Nosotros creemos que estos pacientes necesitarán tratamiento analgésico/coadyuvante quizá de por vida, pero nuestra limitación en número de pacientes y en el tiempo postratamiento no nos permite en la actualidad conocer la evolución a largo plazo.
Desgraciadamente, hemos tenido un fracaso terapéutico en una paciente joven, en la que tras un éxito inicial extraordinario con una mejora en calidad de vida y ausencia de dolor (lo que la impulsó, además, a querer crear un grupo de ayuda a pacientes similares para que se sometieran a tratamiento DRAO), comenzó a los 6 meses con un cuadro de rechazo a todo, siendo evaluada por todo nuestro colectivo multidisciplinar asistencial, sin conseguir pasar el bache, y comenzó a usar opioides fuera de la prescripción de nuestro entorno, apartándose de la terapia guiada y recomendada para ella.
CONCLUSIONES
– Según la duración de nuestro método de deshabituación a opioides, podríamos clasificarla dentro del grupo definido como deshabituación rápida a opioides.
– En todos los casos se ha mantenido un buen nivel de sedación (medida mediante la escala de RASS) sin precisar asistencia invasiva de la vía aérea y manteniéndose la ventilación espontánea.
– Ningún paciente del estudio presentó complicaciones severas. Solo en uno creemos que tuvo una pequeña broncoaspiración sin consecuencias clínicas.
– Es reseñable la amnesia de los pacientes de prácticamente todo el periodo de ingreso en nuestra unidad de cuidados intensivos, incluso del tiempo en que se encontraron despiertos y colaboradores con el personal de enfermería.
– Los dos casos que precisaron mayor consumo de fármacos fueron los que basalmente tenían mayor consumo de opioides. Estos fueron tratados en el grupo de dexmedetomidina y midazolam, no administrándose ketamina, dato que cabe reseñar por el efecto analgésico e hipnótico de la misma. Además, los pacientes en esta línea de tratamiento presentaron mayores síntomas y signos de abstinencia. Estos datos son meramente observacionales debido al escaso tamaño muestral de nuestro estudio.
– Se precisa estudios con tamaño muestral mayor para lograr conclusiones con más calidad y evidencia científica.
– Recomendamos exhaustivamente, seleccionar muy bien a los pacientes para realizar la técnica, para que sean capaces de asimilar el esfuerzo y riesgo a que se van a someter, para que tomen conciencia de que se va a producir un cambio drástico en su vida, y lo acepten.
– Creemos sinceramente que la iatrogenia generada por el uso poco controlado de opioides debe solucionarse con una mayor formación sobre su uso, y la detección precoz de los pacientes susceptibles a desarrollar problemas con estos fármacos.
– Pensamos que esta técnica representa “una segunda oportunidad” de la que se pueden beneficiar pacientes seleccionados.
CONFLICTO DE INTERESES
No existencia de conflicto de intereses en la publicación. Esta publicación no tiene ningún apoyo financiero ni institucional.
BIBLIOGRAFÍA