
DOI: 10.20986/resed.2018.3661/2018
ORIGINAL
Proyecto ADAPTA: adecuación del tratamiento en dolor irruptivo oncológico
C. Álamo1, L. Cabezón-Gutiérrez2 y grupo de trabajo del Proyecto ADAPTA*
1Departamento de Farmacología. Universidad de Alcalá. 2Servicio de Oncología Médica. Hospital Universitario de Torrejón. Madrid. *Grupo de trabajo Proyecto ADAPTA: G. Carrera Domenech, M. Múgica Estébanez, A. Moreno Paul, P. Garrido Valtierra, A. Yubero Esteban, V. Alcolea Fuster, A. Cotes Sanchís, R. Lara López, C. Molins Palau, A. M. Jiménez Gordo, E. Vicente Rubio, L. Iglesias Rey, R. Molina Villaverde, M. Lázaro Quintela, A. García Velasco, F. Gálvez Montosa, A. Marisol Sánchez, M. Corral Subias, E. Elez Fernández, A. L. Irigoyen Medina, M. Alsina Maqueda, A. Gómez Rueda, C. Álvarez Fernández, R. Sánchez-Escribano Marcuende, M. Sereno, B. Rodríguez Alonso, A. C. Virgili Maqueda, C. Delgado Fernández, A. Barba Joaquín, O. Higuera Gómez, J. L. Sánchez Sánchez, T. Fernández Rodríguez, M. Gil Martin, R. A. Albino Pérez, J. Muñoz Luengo, R. Afonso Gómez, M. L. Soriano Tabares de Nava, M. Dorta Suarez, L. M. Rodríguez Rodríguez, M. Selvi Miralles, A. Rodríguez-Vida, A. I. León Carbonero, I. Morilla Ruíz, C. Salguero Núñez, L. Heras López, V. Amezcua Hernández, J. David Cárdenas, G. Soler González, M. González de la Peña Bohorquez, M. Arruti, M. Mangas, F. Molano Criollo, S. Saura Grau, L. Layos Romero, G. Benítez López, L. Díaz Paniagua, J. García Sánchez, A. López Jiménez, V. Alonso, E. Aguirre Ortega, A. González Vicente, M. C. Cañabate Arias, F. J. Vázquez Mazón, M. T. Quintanar Verduguez, V. Zenzola de Toma, G. Pulido Cortijo, A. V. Correa Noguera, R. V. Salgado Ascencio, M. Marín Vera, A. Manzano Fernández, J. M. Martínez Lozano, N. Mohedano, R. Luque Caro, N. Luque Caro, I. Ramos García, J. M. Gasent Blesa, R. Monfort García, P. Martín Tercero, A. Calles Blanco, A. Soria Rivas, P. Zamora, M. F. García Casabal, D. Rodríguez Rubí, L. Vázquez Tuñas, I. Lorenzo Lorenzo, J. García Gómez, J. M. Vicent Vergé, M. D. Torregrosa Maicas, L. D. Condory Farfán, J. Cristóbal, J. Pérez de Olaguer, J. Coves Sarto, I. González Maeso, M. Soria, M. Benavent, R. Morales Barrera, A. Albert Balaguer, J. Garde Noguera, G. Bruixola, M. J. Gómez Reina, J. A. Contreras Ibáñez, M. Serrano Moyano, A. Vacas Rama, A. Moreno Vega, E. Díaz Peña.
Recibido: 24-01-2018
Aceptado: 25-04-2018
Correspondencia: Cecilio Álamo
cecilioalamo@hotmail.com
ABSTRACT
Introduction: Transmucosal fentanyl has specific properties which make it ideal for the treatment of breakthrough cancer pain (BTCP). Although there is a broad consensus for the administration of transmucosal fentanyl for BTCP in Spain, there is uncertainty as to the way oncologists adjust their prescription to the patient and what are the determinants of the choice of different pharmaceutical forms.
Objectives: The main objective of this study was to analyze and prioritize the attributes that Spanish oncologists consider when assessing treatment options with transmucosal fentanyl in patients with BTCP.
Methods: A Scientific Committee performed a classification of 14 relevant attributes in the prescription of transmucosal fentanyl for BTCP. Subsequently, a dossier of scientific evidence was generated comparing these 14 attributes among the different available transmucosal fentanyl formulations, which was shared with the panel of experts (115 Medical Oncologists). After a thorough review of the document, the participants carried out an online vote for the prioritization of the attributes.
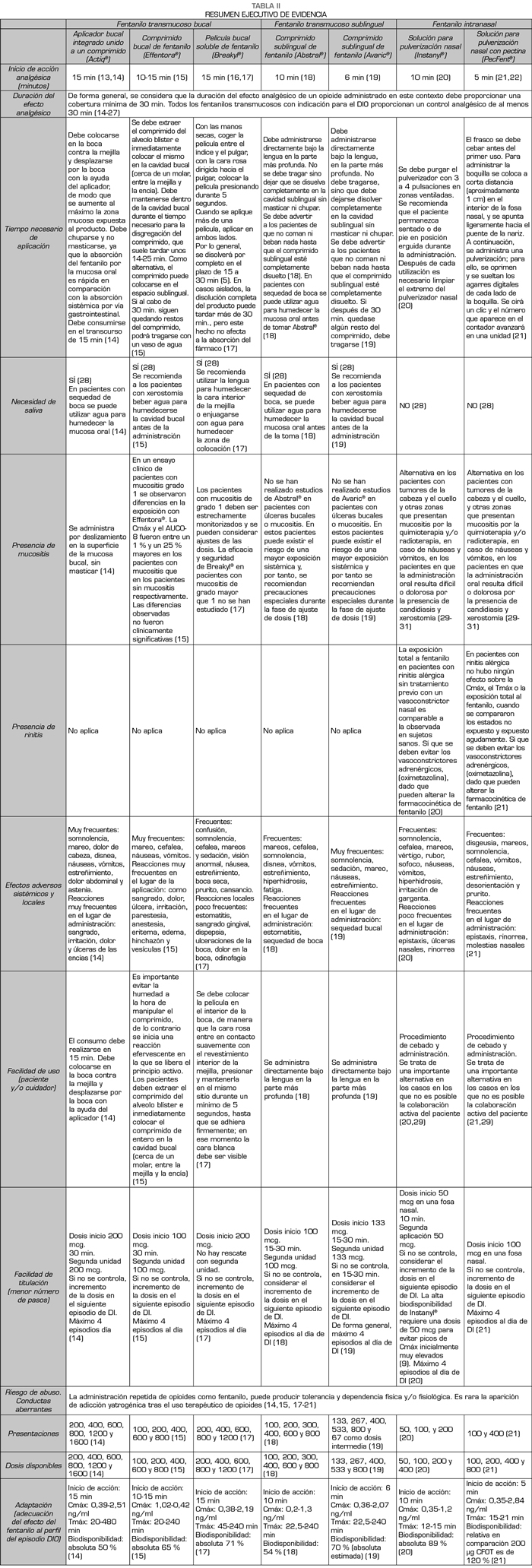
Results: Out of fourteen attributes analyzed, seven achieved a consensus of ≥ 50 % of the participants: the start of the analgesic action (84 %), the adequacy of the effect of fentanyl to the BTCP episode (72 %), the ease of use (58 %), the presence of mucositis (57 %),
the ease of titration of the optimal dose (57%), and the variety of presentations and doses available (59 %).
Conclusions: The most valued attributes were those related to the speed of action of the analgesic treatment and its adaptation to the BTCP profile, something to be expected given the spontaneous, unpredictable, and transitory nature of BTCP. As less valued attributes appear the risk of abuse or aberrant behavior and the presence of rhinitis for its administration, which indicates that the existence of these factors do not influence the choice of treatment for BTCP. These results will allow medical oncologists to know what attributes should be taken into account when customizing the patient's treatment of BTCP in order to improve the adequacy of rescue analgesia.
Key words: Breakthrough cancer pain, opioids, fentanyl, cancer pain management.
RESUMEN
Introducción: El fentanilo de administración transmucosa tiene características específicas que lo convierten en el fármaco adecuado para el tratamiento del dolor irruptivo oncológico (DIO). Aunque en España existe un amplio consenso sobre la idoneidad de la administración de fentanilo transmucoso para el DIO, es relevante conocer cómo los oncólogos adecuan su prescripción al paciente y cuáles son los factores determinantes de la elección de las diferentes formas farmacéuticas.
Objetivos: El objetivo principal de este proyecto fue identificar y priorizar los atributos que los oncólogos médicos españoles tienen en cuenta cuando valoran las opciones de tratamiento con fentanilo transmucoso en pacientes con DIO.
Métodos: Un comité científico realizó una tipificación de 14 atributos relevantes en la prescripción de fentanilo
transmucoso para el DIO. Posteriormente se generó un dossier de evidencia científica comparando estos 14 atributos entre los distintos fentanilos transmucosos disponibles, que se compartió con el panel de expertos (115 oncólogos médicos). Tras una exhaustiva revisión del documento, los participantes realizaron una votación online de priorización de los atributos.
Resultados: De catorce atributos analizados, siete consiguieron un consenso de ≥ 50 % de los participantes: el inicio de la acción analgésica (84 %), la adecuación del efecto del fentanilo al perfil del episodio de DIO (72 %), la facilidad de uso por los pacientes y cuidadores (69 %), la duración del efecto (58 %), la presencia de mucositis (57 %),
la facilidad de titulación de la dosis óptima (57 %) y las presentaciones y dosis disponibles (59 %).
Conclusiones: Los atributos más valorados fueron los relativos a la rapidez de acción del tratamiento analgésico y su adaptación al perfil del DIO, algo esperable dadas las características clínicas del episodio de DIO. Como atributos menos valorados aparecen el riesgo de abuso o conductas aberrantes y la presencia de rinitis para su administración, lo que indica que la existencia de estos factores no tiene tanta influencia en la elección del tratamiento para el abordaje del DIO. Estos resultados permitirán a los oncólogos médicos conocer qué atributos deben ser tenidos en cuenta a la hora de personalizar los tratamientos del paciente con DIO con el objetivo de mejorar la adecuación de la analgesia de rescate.
Palabras clave: Dolor irruptivo oncológico, opioides, fentanilo, manejo del dolor oncológico.
INTRODUCCIÓN
El dolor irruptivo se define como una exacerbación transitoria del dolor que se manifiesta espontáneamente o se relaciona con un factor desencadenante específico, predecible o impredecible, a pesar del dolor basal estable y adecuadamente controlado (1). Aunque el dolor irruptivo puede ocurrir en el contexto de varios dolores basales (2), es en el ámbito oncológico donde ha sido mejor caracterizado. El dolor irruptivo oncológico (DIO) puede aparecer como una consecuencia directa del tumor (70-80 % de todos los casos), como resultado de la terapia oncológica (10-20 % de los pacientes) o sin relación con el tumor o el tratamiento (< 10 % de todos los casos) (3). El factor o factores desencadenantes específicos del DIO se pueden identificar en aproximadamente la mitad de los casos (4).
En 2013, un grupo de expertos españoles que incluía especialistas de Oncología Médica, Oncología Radioterápica, Unidades de Tratamiento del Dolor y Unidades de Cuidados Paliativos adoptaron un documento de consenso sobre el diagnóstico y tratamiento del DIO, que definieron como “una exacerbación aguda del dolor de rápida aparición, corta duración y de moderada a elevada intensidad, que sufre el paciente cuando este presenta un dolor basal estabilizado y controlado con opioides” (5). Según este documento de consenso, el fármaco ideal para el tratamiento del DIO debería cumplir las siguientes especificaciones: a) ser un analgésico potente; b) tener un inicio de acción rápido de 10 minutos o menos; c) tener una corta duración del efecto (2 horas o menos); d) poseer mínimos efectos secundarios; y e) ser de fácil administración (cómodo, no invasivo y autoadministrable) (5). Estos atributos se han visto reflejados en otros estudios tanto de oncólogos españoles (6) como extranjeros (7,8), y el documento de consenso ha sido adoptado por la Sociedad Española de Oncología Médica (SEOM), la Sociedad Española de Oncología Radioterápica (SEOR), la Sociedad Española de Cuidados Paliativos (SECPAL) y la Sociedad Española de Dolor (SED).
Las diversas formulaciones de fentanilo transmucoso, en sus variantes de administración bucal o nasal, han supuesto una mejora notable a disposición del facultativo para la terapia del dolor irruptivo de pacientes oncológicos (9). Estas formulaciones han mejorado la eficacia y rapidez de acción de los opioides clásicos, incluida la morfina, y su tolerabilidad por los pacientes es equivalente. Así, el documento de consenso antes citado, indica que “el fentanilo, al presentar una elevada potencia analgésica y alta lipofilia, es el principio activo que más se ajusta a las necesidades analgésicas del dolor irruptivo en el momento actual, con independencia del opioide mayor utilizado para el control del dolor basal” (5).
En 2010, la Declaración de Montreal propuesta en la Cumbre Internacional sobre el Dolor valoró el acceso al manejo del dolor como “un derecho humano fundamental” (10). No obstante, se ha estimado que la prevalencia de DIO puede alcanzar hasta un 95 % dependiendo del tipo de cáncer y los criterios diagnósticos, y alrededor del 60-90 % de los pacientes con cáncer mueren con dolor (11). En España, teniendo en cuenta que la prevalencia del dolor es muy alta en las etapas avanzadas del cáncer (70-90 %), se estima que cada año, al menos 75.000 personas se enfrentan al dolor causado por cáncer, siendo el dolor el síntoma más temido entre estos pacientes (12).
Claramente la definición de DIO, su diagnóstico, evaluación y seguimiento pueden influir en la elección de un tratamiento y, en consecuencia, los resultados del paciente. Por ello es importante obtener un consenso sobre estos temas de un amplio grupo de expertos en este tipo de dolor. Los objetivos de este estudio han sido, por un lado, revisar la evidencia disponible para analizar y diferenciar los atributos que los oncólogos consideran para valorar las opciones de tratamiento con fentanilo transmucoso en el paciente con DIO y, por otro, priorizar y generar unas recomendaciones sobre qué atributos deben ser tenidos en cuenta a la hora de personalizar los tratamientos del paciente con DIO con el objetivo de mejorar la adecuación de la analgesia de rescate.
MÉTODOS
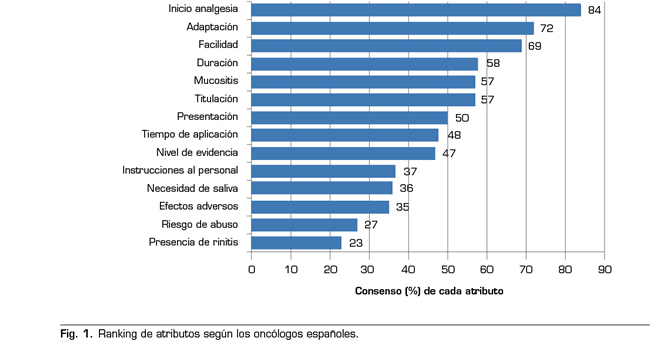
Este proyecto se realizó entre el 21 de mayo y el 20 de junio de 2017 mediante el empleo de una herramienta participativa online. Esta herramienta de inteligencia colectiva se desarrolló en tres pasos. En la primera fase un Comité Científico formado por el Dr. Luis Cabezón Gutiérrez (Servicio de Oncología Médica, Hospital Universitario de Torrejón de Ardoz, Madrid) y el Dr. Cecilio Álamo González (Departamento de Farmacología, Universidad de Alcalá, Madrid) elaboró una lista de 14 atributos relevantes en la prescripción de fentanilo transmucoso para el DIO (Tabla I). En la segunda fase se realizó una revisión de la evidencia disponible basada en fichas técnicas y publicaciones que permitiese analizar y diferenciar estos atributos entre los diferentes fentanilos transmucosos disponibles. Se generó así un Dossier de Evidencia completo y un resumen ejecutivo (Tabla II) que se compartió, vía correo electrónico, con 115 oncólogos médicos de toda España. Tras la revisión del dossier se inició la tercera y última fase donde los expertos votaron online mediante una aplicación telemática para la priorización de los 14 atributos.

RESULTADOS
La pregunta clave “¿Qué atributos considera más importantes a la hora de prescribir un tratamiento con fentanilo transmucoso para el dolor irruptivo oncológico?” se realizó a 115 oncólogos, recibiéndose 105 respuestas completas (94 % de participación).
El ranking de atributos obtenido tras el análisis de la votación se muestra en la Figura 1. De los 14 atributos establecidos, 7 obtuvieron una mayoría de ≥ 50 % de los participantes: el inicio de la acción analgésica (84 %), la adecuación del efecto del fentanilo al perfil del episodio de DIO (72 %), la facilidad de uso (69 %), la duración del efecto analgésico (58 %),
la presencia de mucositis (57 %), la facilidad de titulación (57 %), y la disponibilidad de dosis y presentaciones (50 %). Por otro lado, los tres atributos que menos relevancia tuvieron a la hora de prescribir un fentanilo transmucoso para DIO fueron: la posible ocurrencia de efectos adversos (35 %), el riesgo de abuso o conductas aberrantes (27 %) y la presencia de rinitis (23 %).
DISCUSIÓN
El atributo que alcanzó un mayor nivel de consenso (84 % de los participantes) fue el “inicio de la acción analgésica”. La rapidez con que se produce la disminución o desaparición del dolor debido a la terapia es un requisito primordial en el manejo del dolor irruptivo espontáneo o incidental en el paciente oncológico. En este sentido, aunque el tiempo medio del inicio de un episodio de dolor irruptivo es de 2 a 3 minutos, el dolor puede prolongarse hasta 1 hora, aunque aproximadamente en el 73 %
de los episodios tiene una duración inferior a los 30 minutos. De las formulaciones de fentanilo disponibles en la actualidad, el fentanilo intranasal con pectina proporciona un inicio de analgesia más rápido: 5 minutos tras la administración (25). Los fentanilos transmucosos de administración oral o sublingual tienen tiempos de analgesia superiores, llegando en algunos casos hasta a los 15 minutos (11). Por otro lado, las formas orales de liberación inmediata de morfina u oxicodona muestran su efecto analgésico aproximadamente a los 30-40 minutos de su administración oral, siendo claramente insuficientes para controlar adecuadamente el DIO. A pesar de ello, una encuesta reciente mostró que estos se administran aún de forma generalizada (hasta en el 98 % de los pacientes) en algunos países del norte del Europa (32). En un estudio de 1000 pacientes con cáncer de 13 países europeos, se mostró que tan solo el 19 % de los pacientes recibían fentanilo transmucoso para el tratamiento del DIO (33).
En un estudio Delphi exploratorio realizado en España (6), la gran mayoría de los encuestados (97,8 %) también indicaron que el tiempo ideal para el inicio del efecto analgésico debe ser de un máximo de 15 minutos y el “inicio de la acción analgésica” recibió una puntuación de 6,5 en una escala de 1-7, en la que 7 era “extremadamente importante” (6).
El segundo atributo con mayor nivel de consenso (72 %) fue la “adecuación del efecto del fentanilo al perfil del episodio de DIO”. En este sentido, el fármaco ideal para el tratamiento del DIO debe ser un analgésico potente que pueda aliviar la gran intensidad de dolor. Dada la transitoriedad del dolor, debe ser un fármaco de absorción e inicio de acción rápido, cuya vía de administración sea sencilla, cómoda y con gran aceptación de pacientes. Dicho fármaco no debe añadir efectos secundarios adicionales al tratamiento de base con opioides y la duración del efecto no debe exceder los 120 minutos. Las nuevas formulaciones de fentanilo de rápida absorción se adaptan al perfil del dolor irruptivo y proporcionan una mejor eficacia y menor toxicidad (9). El número de episodios por día, la necesidad de repetir la dosis debido a un alivio insuficiente, y el grado de alivio son aspectos importantes a la hora de titular la medicación para controlar el DIO (6). Algunos autores han propuesto el establecimiento de dosis que son proporcionales a los regímenes de opioides basales para el dolor de base, porque esto parece ser efectivo y seguro en la mayoría de los pacientes (34). En cualquier caso, los distintos aspectos relacionados con la facilidad de titulación, las características clínicas de cada paciente y la necesidad de apoyo social para el paciente son críticos a la hora de escoger el tratamiento con fentanilo (6).
El tercer atributo con mayor nivel de consenso (69 %
de los participantes) fue la “facilidad de uso por el paciente o el cuidador”. Un valor añadido a la hora de seleccionar una opción terapéutica entre distintas formulaciones es la sencillez del dispositivo de administración, que facilitará la adherencia y el cumplimiento por parte de los pacientes. Los resultados de una encuesta a oncólogos españoles mostró que con frecuencia se echan en falta instrucciones e información por escrito al paciente, confirmación de si el paciente ha entendido las instrucciones y de una evaluación sistemática del dolor (35). El estudio concluyó que los oncólogos necesitan mejorar sus habilidades de comunicación, proporcionando a los pacientes información escrita y verbal sobre su enfermedad y el plan para el control del dolor (35). La formulación intranasal de fentanilo puede ser administrada fácilmente por un cuidador si el paciente no puede colaborar, evitando la necesidad de entrenamiento si el paciente es tratado en su casa. En este sentido, se ha demostrado que el fentanilo transmucoso administrado por vía nasal es generalmente más rápido que el administrado por vía bucal, al estar la mucosa nasal más vascularizada y ser más permeable (7).
El cuarto atributo con mayor nivel de consenso (58 %)
fue la “duración del efecto analgésico”. El dolor irruptivo es un dolor heterogéneo, con variaciones intra e interindividuales. Los episodios, incluso en el mismo individuo, pueden tener características muy diferentes, lo que dificulta su adecuada identificación y valoración. La duración de la analgesia fue el segundo criterio más determinante para seleccionar un fármaco para DIO en el estudio Delphi de oncólogos españoles antes mencionado (6). El 74,1 % de los encuestados señalaron que la duración del efecto analgésico debe durar como máximo de 1-2 horas (6).
El quinto atributo con mayor nivel de consenso (57 %)
fue la “presencia de mucositis”. La mucosa es una vía adecuada para la liberación de fármacos de acción rápida, pero para la correcta absorción de las distintas formas de fentanilo transmucoso bucal o sublingual es importante la integridad del epitelio de la mucosa, la vascularización y la hidratación de las superficies. La presencia de procesos oncológicos en la cavidad bucal o de alteraciones de la misma como efecto secundario de ciertos tratamientos puede interferir en la respuesta al tratamiento. Los pacientes que reciben quimioterapia y/o radioterapia pueden experimentar mucositis como una complicación de dichos tratamientos. El dolor relacionado con la mucositis dificulta la administración de fármacos orales y conduce a una reducción en la ingesta de líquidos y alimentos (36). Por ello, naturalmente, este es un atributo que influye decisivamente a la hora de escoger el tratamiento con fentanilo transmucoso. Sin embargo, un atributo relacionado, la “necesidad de saliva”, obtuvo tan solo el 36 % de consenso de los encuestados (Figura 1).
El “tiempo necesario de aplicación”, o tiempo que debe permanecer el aplicador, comprimido o película en contacto con la superficie de absorción para que esta sea máxima, no alcanzó un nivel de consenso mayoritario (48 % de los participantes). Es posible que los participantes asumieran que en todas las formas farmacéuticas de fentanilo transmucoso la aplicación es igualmente rápida, o que este factor no sea decisivo para la rapidez de la acción analgésica.
El “nivel de evidencia científica” tampoco fue mayoritario como atributo decisivo (47 % de los participantes). Son escasos los estudios en los que haya abordado de manera rigurosa la comparación entre las distintas opciones para establecer cuál o cuáles son las que presentan un mejor balance riesgo-beneficio (9). No obstante, una encuesta de ámbito español publicada en 2010 mostró que un alto porcentaje de los oncólogos desconoce algunos conceptos de potencial importancia clínica, como las acciones de los medicamentos sobre los diferentes receptores de opiáceos (37). Aunque el consenso es claro con respecto a la administración de fentanilo de absorción rápida para el tratamiento del DIO y los oncólogos españoles ven el fentanilo transmucoso como una terapia eficaz, parece prioritario un esfuerzo para divulgar los aspectos técnicos que permitan al oncólogo conocer a fondo las distintas opciones terapéuticas. Además, a pesar de la prevalencia y de ser un factor pronóstico negativo en pacientes oncológicos, el DIO está infradiagnosticado y poco tratado. Un estudio cualitativo realizado en España para determinar la adherencia a la Guía Clínica del Tratamiento del Dolor Oncológico de la Sociedad Española de Oncología Médica (38) mostró que, aunque los oncólogos (n = 83)
fueron unánimes en la necesidad de tratamiento específico para el DIO (100 %), y en el uso de fentanilo como fármaco de primera elección (99 %), la guía adolece de un cumplimiento limitado, en parte debido a su baja difusión y en parte a la posible confusión en ciertas recomendaciones (39). Asimismo, un estudio realizado con oncólogos americanos mostró que una de las barreras identificadas para el tratamiento adecuado del dolor era la necesidad de formación específica en este campo (40). Por más que el fentanilo transmucoso está claramente percibido por los oncólogos españoles como una terapia contra el DIO segura y bien tolerada, es necesario continuar el esfuerzo de formación del personal sanitario a todos sus niveles.
La variedad en las formas farmacéuticas de fentanilo transmucoso facilita que a cada paciente se le pueda tratar con la formulación que más se ajuste a sus características clínicas, y sus preferencias. Por ello es necesaria la colaboración de personal sanitario capacitado para explicar cómo controlar el DIO. Aun así, el atributo “tiempo necesario para explicar la correcta administración del fentanilo transmucoso” solo alcanzó un 37 % de consenso entre los oncólogos participantes. No obstante, es claro que para garantizar la seguridad del paciente y optimizar la eficacia del tratamiento, se debe implicar al personal de enfermería, farmacéuticos, cuidadores y familiares.
Es notable que en nuestro análisis la aparición de efectos adversos locales (relacionados con la vía de administración) no pareció relevante a la hora de prescribir las distintas formas de fentanilo transmucoso (consenso de 35 % de los participantes). Es posible que entre los oncólogos se asuma que estas formas de administración son igualmente seguras y que los efectos adversos son comunes a todos los tipos de opioides (náuseas, estreñimiento, cefaleas y somnolencia). También es notorio que los participantes en nuestro estudio no vean como relevante la posibilidad de riesgo de conductas aberrantes o abuso (27 % de los participantes). Por último, la presencia de rinitis no es un atributo relevante en la decisión de la prescripción por parte de los oncólogos, concitando tan solo un nivel de consenso de 23 %.
CONCLUSIONES
Este estudio sobre las prioridades a la hora de prescribir fentanilo transmucoso para el tratamiento del DIO mostró que los oncólogos participantes valoran sobre todo la rapidez del efecto analgésico, la adecuación del fármaco al perfil del episodio de dolor, la facilidad de uso y la duración del efecto. Estas prioridades están alineadas con las necesidades del tratamiento efectivo del DIO según los documentos de consenso y guías de práctica clínica actuales. La baja priorización de atributos como la posible aparición de efectos adversos, el riesgo de abuso, o el nivel de evidencia científica disponible, destacan la percepción que los oncólogos españoles tienen de las distintas formulaciones del fentanilo transmucoso como medicamentos seguros, bien tolerados y eficaces.
CONFLICTO DE INTERESES
El Dr. Álamo, en los últimos cinco años ha participado como consultor y/o ponente en labores de Formación en actividades relacionadas con la Neuropsicofarmacología, relacionadas con las siguientes empresas: Adamed, Angelini, Casen-Recordati, Exeltis, Ferrer, Grunenthal, Indivior, Italfármaco, Janssen-Cilag, Juste SAQF, Kyowa Kiry, Lundbeck, Mudipharma, Normon, Novartis, Otsuka, Pfizer, Roche, Rovi, Rubió Servier y Shire. Asimismo, ha colaborado en labores de asesoramiento y formación con la Sociedad Española de Psiquiatría, Sociedad Española de Psiquiatría Biológica, Sociedad Española de Geriatría y Gerontología y con la Sociedad Española del Dolor.
BIBLIOGRAFÍA