doi.org/10.1002/ejp.2094
ARTÍCULO DE LA REVISTA EJP
TRAYECTORIAS DEL DOLOR EN SUJETOS CON AFECCIÓN POST-COVID-19: ESTUDIO PROSPECTIVO Y TRANSVERSAL CON EVALUACIÓN PRESENCIAL
PAIN PATHS AMONG POST-COVID-19 CONDITION SUBJECTS: A PROSPECTIVE CROSS-SECTIONAL STUDY WITH IN-PERSON EVALUATION
Gabriel T. Kubota1,2
Felipe H. C. Soares1
Alessandra S. da Fonseca1
Talita dos Santos Rosa1
Valquiria A. da Silva1,3
Gisele R. Gouveia4
Viviane G. Faria1
Pedro H. M. da Cunha1
André R. Brunoni3,5,6
Manoel J. Teixeira1
Daniel C. de Andrade1,7
1LIM-62. Centro de Dolor. Departamento de Neurología. Universidad de São Paulo. São Paulo, Brasil
2Centro de Tratamiento del Dolor. Instituto Oncológico del Estado de São Paulo. São Paulo, Brasil
3Servicio de Neuromodulación Interdisciplinario. Departamento de Psiquiatría. Instituto de Psiquiatría. Facultad de Medicina de la Universidad de São Paulo. São Paulo, Brasil
4Laboratorio de Patología Clínica. Departamento de Psiquiatría. Instituto de Psiquiatría. Facultad de Medicina de la Universidad de São Paulo. São Paulo, Brasil
5Laboratorio de Neurociencia. Departamento de Psiquiatría. Instituto de Psiquiatría. Instituto Nacional de Biomarcadores en Psiquiatría. Facultad de Medicina de la Universidad de São Paulo. São Paulo, Brasil
6Centro de Investigación Clínica y Epidemiológica. Centro Interdisciplinario de Neuromodulación Aplicada. Hospital Universitario. Universidad de São Paulo. São Paulo, Brasil
7Centro de Neuroplasticidad y Dolor (CNAP). Departamento de Ciencia y Tecnología de la Salud. Facultad de Medicina. Universidad de Aalborg. Aalborg, Dinamarca
RESUMEN
Antecedentes: El dolor crónico de nueva aparición se considera que forma parte de la condición o afección post-COVID-19. Sin embargo, los datos detallados existentes sobre el fenotipo clínico, las trayectorias y las principales características asociadas siguen siendo escasos. Describimos las distintas evoluciones temporales del dolor post-COVID-19 y sus rasgos epidemiológicos y fenotípicos.
Métodos: Estudio prospectivo y transversal de pacientes con afección post-COVID-19 (es decir, con síntomas persistentes relacionados con la COVID-19 durante 30 días desde la primera prueba positiva de laboratorio) cuyo diagnóstico de COVID-19 estuviera basado en la RT-PCR de un frotis oral/nasofaríngeo o una serología. Se sometieron a evaluaciones presenciales mediante una entrevista estructurada, cuestionarios de dolor y calidad de vida y una exploración física exhaustiva. El dolor crónico (DC) y el dolor neuropático (DN) probablemente se definieron conforme a los criterios IASP.
Resultados: El presente estudio incluyó 226 individuos, 177 (78,3 %) de los cuales se presentaron pasados más de 3 meses desde el primer síntoma de COVID-19. Tenían dolor de nueva aparición 170 (75,2 %) de los participantes y dolor crónico 116 (68,2 %). El curso crónico se asociaba a hospitalización por COVID-19, fatiga de nueva aparición, menor rendimiento cognitivo, déficits motores y sensitivos térmicos, alteraciones del ánimo y el sueño, y niveles generalmente inferiores de calidad de vida. El DN probable afectaba a solo el 7,6 % de los pacientes con dolor de nueva aparición y se asociaba a cronificación del dolor, fatiga de nueva aparición, déficits motores y de sensación térmica, alodinia mecánica y tasas menores de vacunación frente al SARS-CoV-2. Referían DC previo 86 (38,1 %) individuos, y este había empeorado tras la infección en 66 (76,7 %) de ellos, lo que se asociaba a hipotensión ortostática.
Conclusiones: Los fenómenos dolorosos post-COVID siguen diferentes trayectorias que se asocian a rasgos clínicos y epidemiológicos específicos, y posiblemente a distintos mecanismos de base y diferentes implicaciones pronósticas y terapéuticas.
Significado: El dolor relacionado con la COVID-19 sigue normalmente un curso crónico y no es neuropático. Los posibles cursos y fenotipos se asocian a rasgos clínicos y epidemiológicos distintos. Esto sugiere que los mecanismos de base difieren, lo que podría tener implicaciones pronósticas y terapéuticas importantes.
ABSTRACT
Background: New-onset chronic pain has been acknowledged as part of the post-COVID-19 condition. However, available fine-grained data about its clinical phenotype, trajectories and main associated characteristics remain scarce. We described the distinct temporal evolutions of post-COVID-19 pain and their epi- demiological and phenotypical features.
Methods: A prospective cross-sectional study enrolled post-COVID-19 condition patients (i.e. who had persisting COVID-19-related symptoms over 30 days since their first positive laboratory test), whose COVID-19 diagnosis had been supported by RT-PCR of oral/nasopharyngeal swab or serology. They underwent in-person evaluations with a structured interview, pain and quality-of-life-related questionnaires and thorough physical examination. Chronic pain (CP) and prob- able neuropathic pain (NP) were defined according to IASP criteria.
Results: The present study included 226 individuals, 177 (78.3 %) of whom presented over 3 months since their first COVID-19 symptom. New-onset pain occurred in 170 (75.2 %) participants and was chronic in 116 (68.2 %). A chronic course was associated with COVID-19-related hospitalization, new-onset fatigue, lower cognitive performance, motor and thermal sensory deficits, mood and sleep impairments and overall lower quality-of-life levels. Probable NP occurred in only 7.6 % new-onset pain patients, and was associated with pain chronification, new-onset fatigue, motor and thermal sensory deficits, mechanical allodynia and lower rates of SARS-CoV-2 vaccination. Previous CP was reported by 86 (38.1 %) individuals and had aggravated after the infection in 66 (76.7 %) of them, which was associated with orthostatic hypotension.
Conclusions: Post-COVID pain phenomena follow different paths, which are as- sociated with specific clinical and epidemiological features, and possibly distinct underlying mechanisms, prognostic and therapeutic implications.
Significance: COVID-19-related pain usually follows a chronic course and is non-neuropathic. Its possible courses and phenotypes are associated with distinct clinical and epidemiological features. This suggests differing underlying mechnisms, which may have significant prognostic and therapeutic implications.
Recibido: 11-12-2022
Aceptado: 12-02-2023
Correspondencia: Gabriel T. Kubota
gabriel.kubota@hc.fm.usp.br
INTRODUCCIÓN
Desde que se describió por vez primera en diciembre de 2019 la COVID-19, ha producido más de 600 millones de casos y 6 millones de muertes en todo el mundo a fecha de octubre de 2022 (1). Aunque la letalidad es < 1 % (2), alrededor de tres cuartas partes de los supervivientes presentan síntomas persistentes y a menudo gravosos (3,4). A esta afección se la ha denominado con varios términos, como “COVID-19 larga” y “síndrome post-COVID-19”, estando codificada en la Clasificación Internacional de Enfermedades (CIE-10) desde septiembre de 2020 como “afección post-COVID-19” (APC, código U09.9) (1,5).
APC es un término amplio que abarca más de 50 síntomas que a menudo se solapan entre sí (3,6). Se ha comprobado que el dolor crónico de nueva aparición es uno de ellos. Un estudio transversal de 273.618 supervivientes de COVID-19 del Reino Unido encontró incidencias del 5,71 % para el dolor torácico/de garganta, del 4,63 % para la cefalea y del 7,19 % para otros dolores pasados 3-6 meses de la infección (6). Además, se observaron cefaleas y mialgias 1 año después del alta hospitalaria en el 2,3 % y 7,9 % de los supervivientes de la COVID-19 de Wuhan, China, respectivamente (7). Un metanálisis recientemente publicado observa que casi el 10 % de los infectados por el SARS-CoV-2 acaban presentando dolor musculoesquelético post-COVID-19 en algún momento durante el primer año de la infección (8,9,10,11).
Sin embargo, pocos estudios han aportado detalles sobre el dolor crónico nuevo de la APC. Estos han comunicado incidencias que van del 15,1 % al 45,1 % (8,9,10,11,12,13,14). No obstante, la mayoría de ellos se basaron en entrevistas telefónicas y se centraron en el dolor musculoesquelético (8,9,10,11,12,14,15), habiendo pocos datos referentes al dolor neuropático (16,17).
Además, la relación entre la COVID-19 y el dolor persistente es compleja. La infección puede producir nuevos síntomas de dolor crónico directa (por ejemplo, daño tisular e inflamación mediados por el virus) (18) o indirectamente (por ejemplo, complicaciones relacionadas con el tratamiento) (19). Aunque las evaluaciones únicamente mediante entrevistas permiten investigar la frecuencia del dolor post-COVID-19, posiblemente se limitan a describir las características fenotípicas y los factores epidemiológicos asociados. Hasta la fecha existe poca información pormenorizada procedente de evaluaciones presenciales más amplias de los tipos de dolor de la COVID-19. Además, los datos siguen siendo escasos con respecto a la magnitud de los pacientes con dolor crónico que verán sus síntomas agravados por infección, la incidencia del dolor crónico nuevo entre las poblaciones no europeas y el número que tendrán dolor neuropático basado en la exploración clínica.
Por tanto, realizamos el presente estudio con el objetivo de describir las características distintivas de las diferentes evoluciones del dolor post-COVID-19, tanto musculoesquelético como neuropático, y su asociación con las características epidemiológicas y clínicas del dolor mediante evaluaciones presenciales normalizadas. Estos datos originales podrían arrojar luz sobre los mecanismos de base, posiblemente diferentes, que pueden provocar dolor en estos pacientes y contribuir a configurar tanto tratamientos a nivel individual como estrategias de prevención.
MÉTODOS
Diseño del estudio
Este fue un estudio prospectivo y transversal, realizado en el centro de dolor del Hospital das Clínicas de la Universidad de São Paulo, Brasil. Forma parte de un proyecto mayor, el Pain in the Pandemic Initiative, cuyo objetivo es examinar la epidemiología, las características clínicas y el pronóstico de los fenómenos dolorosos de los supervivientes de la COVID-19. El protocolo del estudio fue aprobado por el comité de revisión institucional local (# 4.258.387).
Sujetos
Se invitó a los pacientes a participar en el estudio a través de anuncios abiertos publicados en medios digitales y el periódico de la universidad local, y del contacto con los facultativos de Atención Primaria. El reclutamiento se produjo entre marzo y noviembre de 2021. Se consideró a los sujetos elegibles sí cumplían los criterios siguientes: (i) diagnóstico de COVID-19 avalado por una reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) a partir de muestras de frotis orales/nasofaríngeos y/o por una serología efectuada al menos 1 mes antes de la inclusión en el estudio; y (ii) que hubieran referido cualquier síntoma de COVID-19 que persistiera pasados 30 días desde la fecha de la primera RT-PCR o serología positiva (es decir, APC). Se consideró síntoma de la COVID-19 todo síntoma que el paciente considerase que había aparecido de novo tras la infección. Esta definición de APC está respaldada por la anteriormente propuesta por los Centers for Disease Control and Prevention de Estados Unidos (20). La presencia de dolor, crónico o no, no era criterio de inclusión y no se mencionaba en concreto en los anuncios de búsqueda de participantes. Se excluyó a los individuos incapaces de otorgar su consentimiento informado o de comprender los cuestionarios del estudio (por ejemplo, por presentar discapacidad cognitiva grave). Se obtuvo el consentimiento informado por escrito de todos los sujetos incluidos antes de que se sometieran a las evaluaciones del estudio.
Evaluaciones presenciales y recogida de datos
Todos los sujetos se evaluaron en persona al mismo tiempo por dos investigadores y todos los casos fueron revisados por otros dos especialistas en dolor y COVID-19. Estos investigadores evaluaron juntos a cada sujeto como panel y siguiendo un protocolo normalizado; en caso de incertidumbre con respecto a la clasificación de los síntomas del participante, esta se discutió con un comité de neurólogos, especialistas en dolor y médicos con experiencia en el manejo de la COVID-19 hasta alcanzar una postura unánime. Los participantes se sometieron inicialmente a una entrevista estructurada que recogió datos sobre características demográficas, diagnóstico y tratamiento de la COVID-19, vacunas, afecciones médicas y dolor crónico previo. Durante la entrevista se investigó también si había aparecido algún dolor de novo durante la infección por SARS-CoV-2 y, en tal caso, su localización, duración y características. El dolor de novo en relación con la COVID-19 se definió como todo dolor de nueva aparición que hubiera empezado hasta 1 mes después del inicio de los síntomas de COVID-19. A los pacientes con dolor crónico previo (DCP) se les preguntó también por la localización y la evolución después de la infección (es decir, se resolvió, mejoró, persistió más o menos igual o empeoró). Los individuos con DCP que hubieran desarrollado dolor de nueva aparición claramente diferente del dolor previo (p. ej., que afectara a una parte del cuerpo distinta o que tuviera características diferentes) y que cumplieran los citados criterios se consideró que también presentaban dolor de novo en relación con la COVID (DNC).
Este tipo de dolor se consideró como probablemente neuropático si cumplía los criterios y el sistema de graduación previamente publicados por la International Association for the Study of Pain (IASP) después del examen neurológico (21). El dolor crónico se definió conforme a la IASP como un dolor persistente o recurrente de más de 3 meses de duración (22), clasificándose como agudo el dolor de < 3 meses de duración. La calidad de vida y del sueño, los niveles de ansiedad y depresión y las características e interferencias del DNC se examinaron con los cuestionarios e instrumentos que se presentan a continuación. Se recogieron también datos sobre la aparición de fatiga de novo y la pérdida del olfato y/o el gusto.
Después, todos los sujetos se sometieron a una exploración física presencial normalizada, realizada simultáneamente por dos neurólogos expertos con experiencia en medicina del dolor. En esta exploración, estos investigadores examinaron la fuerza motora de los miembro superiores e inferiores y la sensibilidad térmica a estímulos fríos conforme a un protocolo que se describe en detalle en Datos S1. La frecuencia cardiaca y la presión arterial se midieron también en decúbito horizontal y al cabo de 2 minutos en posición de pie. La hipotensión ortostática se definió como una diferencia ≥ 20 mm Hg en la presión arterial sistólica o ≥ 10 mm Hg en la diastólica entre estas dos posiciones, y la variación significativa de la frecuencia cardiaca como un aumento ≥ 30 lpm entre las mismas. Se analizó también el deterioro cognitivo con la prueba de la fluidez verbal semántica en la categoría de ‘nombres de animales’ (S-VFT). La alodinia térmica y mecánica se evaluó objetivamente mediante la exploración sensitiva del lugar en el que los sujetos referían dolor.
Todos los datos recogidos se almacenaron y gestionaron mediante las herramientas REDCap (Research Electronic Data Capture) disponibles en el Hospital das Clínicas de la Universidad de São Paulo. REDCap es una plataforma segura de software con base en la Red, diseñada para la captura de datos en estudios de investigación (23,24).
Cuestionarios y otros instrumentos de evaluación
Los sujetos reclutados se examinaron con los instrumentos siguientes:
En este estudio se utilizaron las versiones previamente validadas en portugués brasileño del BPI (25), el DN-4 (26) y el NPSI (27).
Análisis de los datos
Incluimos una muestra por conveniencia de pacientes consecutivos con evidencia de COVID-19 asociada a síntomas de larga duración. Los participantes se dividieron primero entre aquellos que no habían desarrollado dolor de novo (sin DNC) y aquellos otros que sí. Estos últimos se clasificaron después, según la evolución del dolor de nueva aparición hasta el día de la entrevista, en: agudo resuelto, agudo persistente, crónico resuelto y crónico persistente. Se examinaron entonces las proporciones relativas de sujetos en cada uno de estos grupos y sus rasgos demográficos generales. Secuencialmente, los datos de los sujetos sin DNC actual (es decir, DNC agudo, resuelto o no) se agruparon y compararon con los de quienes tenían dolor crónico en el momento de la entrevista (es decir, con dolor de nueva aparición crónico persistente).
Además, se describió la incidencia del dolor neuropático probable en cada uno de estos grupos. El fenotipo de dolor clínico y las características demográficas se compararon entre los sujetos con dolor crónico persistente de nueva aparición, neuropático y no neuropático. Se examinó también el subconjunto de pacientes con DCP sin DNC actual. Estos individuos se dividieron en dos grupos: los que habían referido que el dolor previo había empeorado después de la infección por SARS-CoV-2 (DCP agravado) y los que no (DCP no agravado). Los datos de estos grupos se compararon y describieron. Finalmente, entre los sujetos con dolor crónico actual, las características demográficas y el fenotipo clínico se compararon entre aquellos con dolor relacionado con la (DNC sin DCP) y aquellos otros con dolor no relacionado con la COVID (DCP no agravado sin DNC).
Para el análisis estadístico inferencial, las variables categóricas se compararon con la prueba del Chi cuadrado o la prueba exacta de Fisher, según el caso. Se comprobó la normalidad de las variables cuantitativas mediante las pruebas de Kolmogorov–Smirnov y de Shapiro–Wilk, así como mediante la inspección visual de los histogramas y las gráficas Q-Q normales. Las variables paramétricas se analizaron con la prueba de la t de Student y las no paramétricas con la U de Mann-Whitney y la prueba de Kruskal-Wallis. Las correlaciones se examinaron mediante la prueba de Spearman.
La significación estadística se estableció en p < 0,05.
Por otro lado, las variables clínicas y epidemiológicas que se encontró que eran significativamente diferentes entre los grupos comparados se seleccionaron para los análisis de regresión logística. Para estos, tan solo las variables independientes con más de 15 casos se incluyeron en la ecuación de regresión, excluyéndose los valores atípicos. Estos se definieron como los casos con valores residuales normalizados > 2,5 DT. Por cada regresión se examinó la multicolinearidad mediante la inspección de los coeficientes de correlación y los valores de tolerancia. La suficiencia del modelo se comprobó con la prueba de la bondad de ajuste de Hosmer y Lemeshow, y la variación explicada se calculó con el método R2 de Nagelkerke. Se comunicaron la sensibilidad y la especificidad de la ecuación de regresión, así como la contribución de cada una de sus variables independientes. Todos los análisis se efectuaron con el programa estadístico IBM SPSS para Windows, versión 20.0.
RESULTADOS
Datos demográficos generales
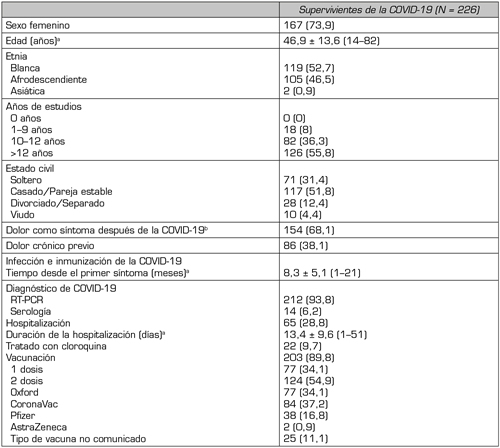
Se cribaron en total 325 sujetos y 226 resultaron elegibles y se inscribieron en el estudio. En quienes no se llevó a cabo la inscripción, el motivo fue en todos los casos que no había análisis clínicos que respaldaran el diagnóstico de COVID-19. Las características demográficas generales de los pacientes incluidos se presentan en la Tabla 1. La mayor parte de la muestra eran mujeres (n = 167, 73,9 %) y la media de edad era de 46,9 ± 13,6 años. El diagnóstico de COVID-19 se basaba en una RT-PCR de frotis naso/orofaríngeos en 212 individuos (93,8 %), y habían sido hospitalizados por COVID-19 65 (28,8 %), con una estancia media de 13,4 ± 9,6 días. El tiempo medio transcurrido desde el primer síntoma de COVID-19 hasta la inclusión fue de 8,3 ± 5,1 meses, y habían pasado más de 3 meses desde la aparición de los síntomas hasta la presente evaluación en 177 sujetos (78,3 %) (Figura 1).
Tabla I. Demografía general y características de la COVID-19.

Nota: Datos presentados como n (%), a menos que se especifique lo contrario. aDatos presentados como media ± DT (mínimo–máximo). bDefinido como dolor de novo tras la COVID-19 o agravamiento del dolor crónico previo.
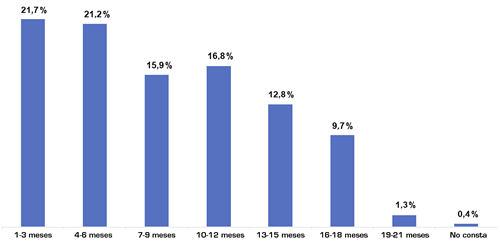
Fig. 1. Distribución del tiempo desde el primer síntoma de COVID-19 hasta la inclusión en el estudio. Esta gráfica muestra la distribución de los supervivientes de la COVID-19 incluidos conforme a categorías de tiempo entre el primer síntoma de COVID-19 y la inclusión en el estudio.
Trayectorias del dolor en los supervivientes de la COVID-19
Refirieron DNC 170 participantes (75,2 %); era agudo en 69 individuos (30,5 %) y ya se había resuelto totalmente en 54 (23,9 %) en el momento de la evaluación. Por otra parte, el dolor era crónico en 100 sujetos (44,2 %) y seguía presente en el momento de la evaluación en 97 casos (42,9 %). El dolor crónico previo (DCP) fue referido por 86 sujetos (38,1 %) y se había agravado tras la COVID-19 en 66 de ellos (76,7 %). Se incluyen más detalles sobre los subtipos de dolor de la muestra estudiada en la Tabla 2.
Tabla II. Sinopsis de los fenómenos dolorosos entre 226 supervivientes de la COVID-19.

Nota: Datos presentados en forma de n (%), a menos que se especifique lo contrario. aDatos presentados en forma de media ± DT (mínimo-máximo).
Características clínicas y demográficas del dolor crónico persistente de novo tras la COVID-19
Los rasgos clínicos y la carga del DNC crónico persistente se describen en la Tabla 3. Refirieron que había estado presente la mayoría de los días del mes anterior 84 sujetos (88,4 %), con una intensidad media 7,3 ± 1,4. Los focos de dolor más frecuentes fueron los miembros inferiores (n = 46, 47,4 %) y la cabeza/cuello (n = 27, 27,8 %). Usaban analgésicos 71 de los que presentaban este tipo de dolor (73,2 %). Sin embargo, el uso de opioides era relativamente poco frecuente (n = 11, 11,4%). El DNC crónico persistente interfería moderadamente en las actividades generales, el ánimo, la ambulación, el rendimiento laboral y el sueño (Tabla 3).
Tabla III. Características clínicas y carga del dolor crónico persistente de nueva aparición de la COVID-19.
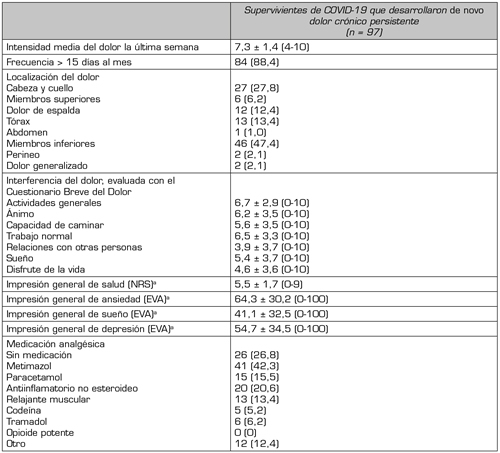
Nota: Datos presentados como n (%), a menos que se especifique lo contrario. aDatos presentados como media ± DT (mínimo-máximo).
En comparación con los sujetos sin DNC (es decir, aquellos que no desarrollaron dolor de nueva aparición o solo presentaron dolor agudo que luego se resolvió por completo), los individuos con dolor crónico persistente de novo tenían más probabilidades de haber sido hospitalizados por COVID-19 (35,4 % frente a 19,1 %, p = 0,008) y de haber presentado fatiga de nueva aparición tras la infección (95,2 frente a 83,3, p = 0,012), y menos probabilidades de tener DPC (25,8 % frente a 49,1 %, p = 0,001) (Tabla 4). El rendimiento cognitivo era menor en estos sujetos (16 ± 4,4 frente a 17 ± 4,8, p = 0,021). Las frecuencias de los déficits motores (6,5 % frente a 2,8 %, p = 0,013) y sensitivos térmicos (13,4 % frente a 2,7 %, p = 0,004) eran también mayores en esos pacientes, aunque la distribución espacial no difería significativamente de la de los sujetos sin DNC actual.
Tabla IV. Comparación entre sujetos con dolor crónico persistente y sin dolor de novo actual en relación con la COVID-19
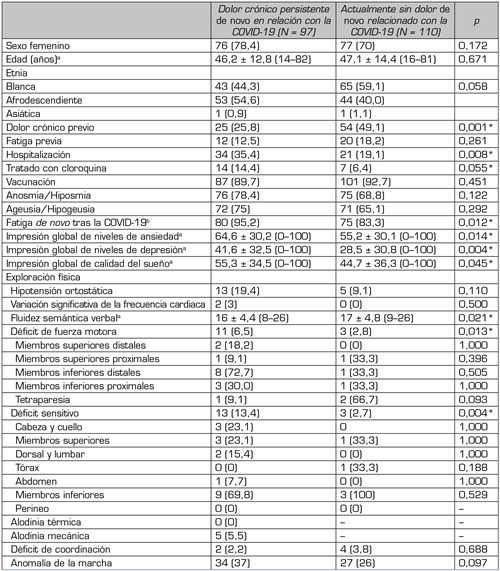
Nota: Datos presentados como n (%), a menos que se especifique lo contrario. En este análisis, el grupo actualmente sin dolor de novo relacionado con la COVID-19 estaba compuesto por los sujetos que no habían desarrollado dolor de novo después de la COVID-19 y por aquellos que habían desarrollado dolor de novo agudo que se había resuelto totalmente en el momento de la inclusión. aDatos presentados como media ± DT (mínimo–máximo). bEste análisis solo tuvo en cuenta a los sujetos que no habían referido fatiga previa. *p < 0,05.
Por otra parte, los individuos con DNC actual referían niveles más altos de ansiedad (64,6 ± 30,2 frente a 55,2 ± 30,1, p = 0,014) y depresión (41,6 ± 32,5 frente a 28,5 ± 30,8, p = 0,004), y más alteraciones graves del sueño (55,3 ± 34,5 frente a 44,7 ± 36,3, p = 0,045) que los pacientes sin DNC, respectivamente. Los individuos con DNC referían también una peor impresión general de su estado de salud (5,5 ± 1,7 frente a 6,8 ± 1,6, p < 0,001) y niveles menores de calidad de vida en todas las dimensiones evaluadas: movilidad (p < 0,001), autocuidado (p = 0,035), actividades habituales (p < 0,001), dolor y molestias (p < 0,001), y ansiedad y depresión (p = 0,007) (Tabla S1) en comparación con aquellos son DNC, respectivamente.
En el análisis de regresión logística se incluyeron todas las variables antes citadas excepto los déficits motores y sensitivos térmicos, debido al bajo número de casos. No se encontró evidencia de multicolinearidad entre ellas. El modelo resultante presentaba un ajuste suficiente (prueba de Hosmer y Lemeshow, p = 0,282) y explicaba el 28,4 % de la varianza observada para el desarrollo de DNC crónico persistente, con una sensibilidad del 64,6 % y una especificidad del 70,5 %. La hospitalización (OR: 3.01; IC 95 %: 1,36-6,67), la fatiga de nueva aparición tras la COVID-19 (OR: 5,22; IC 95 %: 1,33–20,51), el dolor crónico previo (OR: 0,41; IC 95 %: 0,19-0,89) y la fluidez verbal semántica (OR: 0,87; IC 95 %: 0,80-0,94) contribuyeron significativamente a este modelo (Tabla S2).
Para evaluar si la presencia de pacientes con dolor crónico previo (DCP) en el grupo con DNC no motivaba los hallazgos antes descritos, efectuamos análisis para comparar a los pacientes con DNC con los pacientes sin DNC, retirando a los pacientes con DCP. Curiosamente, excepto las puntuaciones de ansiedad, todos los hallazgos siguieron siendo significativos en estos análisis ad hoc (Tabla S3).
Dolor neuropático en los supervivientes de la COVID-19
Los criterios del dolor neuropático probable los cumplían 13 (7,6 %) sujetos con DNC. Este tipo de dolor era significativamente más frecuente en los pacientes con DNC crónico persistente (10,3 %) que en aquellos otros sin dolor de novo actual (1,8 %, p = 0,009). Notablemente, el DN-4 fue muy preciso para identificar el dolor neuropático probable en nuestra muestra de sujetos con DNC crónico persistente (sensibilidad = 90 % y especificidad = 90,8 %, Figura S1). Tres pacientes con dolor neuropático probable tenían dolor agudo que persistía hasta la fecha de la evaluación (dolor persistente) mientras que en 10, el dolor tenía un curso insidioso y crónico persistente.
Entre los sujetos con DNC crónico persistente, los que tenían dolor neuropático probable presentaban menos probabilidades de haber sido vacunados del SARS-CoV-2 (60 % frente a 93,1 %, p = 0,009) y de haber desarrollado fatiga de nueva aparición después de la COVID-19 (75 % frente a 97,4 %, p = 0,044). Por otro lado, los déficits motores (40 % frente a 8,4 %, p = 0,016) y sensitivos térmicos (100 % frente a 3,4 %, p < 0,001), y la alodinia mecánica en el foco del dolor (40 % frente a 1,2 %, p < 0,001) eran más frecuentes entre estos individuos (Tabla S4). El dolor neuropático probable se asociaba a una mayor interferencia con el endimiento laboral (8,1 ± 3,0 frente a 6,4 ± 3,3, p = 0,022) y más depresión (13,7 ± 15,4 frente a 45 ± 32,5, p = 0,004), así como a una calidad del sueño menos afectada (26,3 ± 33,5 frente a 58,8 ± 31,2, p = 0,006), en comparación con aquellos sin él (Tabla S4). El dolor neuropático probable se producía la mayoría de los días del mes en nueve individuos (90 %) y tenía una intensidad media de moderada a alta (7,6 ± 7,5). Los descriptores más frecuentes eran: urente (n = 8, 80 %) y con hormigueo (n = 8, 80 %). Los grupos más frecuentes del NPSI en el dolor neuropático probable eran “dolor profundo” (n = 5, 50 %) y “dolor puntiforme” (n = 4, 40 %, Tabla S5).
No fue posible emplear el análisis de regresión logística para predecir el dolor neuropático probable en aquellos con DNC crónico persistente debido a la escasa frecuencia de pacientes con esta afección (n = 10).
Agravamiento del dolor crónico previo en sujetos sin dolor de novo actual relacionado con la COVID-19
El dolor crónico previo (DCP) fue referido por 54 sujetos (49,1 %) sin DNC actual, de los que 36 (66,6 %) habían sufrido un importante agravamiento del dolor tras la infección (Tabla S6). La hipotensión ortostática era más frecuente entre los individuos con DCP agravado (8,8 % frente a 33,3 %, p = 0,047). Otros hallazgos de la exploración física no eran significativamente distintos entre estos grupos (Tabla S6).
Aunque la frecuencia del dolor neuropático probable no difería significativamente entre los pacientes con CP agravado y no agravado, los primeros tenían puntuaciones DN-4 más altas (2,0 ± 2,9 frente a 3,5 ± 2,6, p = 0,001) tendencia a puntuaciones NPSI también más altas (9,7 ± 8,4 frente a 4,2 ± 3,7, p = 0,050) (Tabla S6). El DCP agravado se asociaba también a una mayor intensidad media del dolor (5,4 ± 2,9 frente a 3,5 ± 2,6, p = 0,020) y a una mayor interferencia con el ánimo (5,8 ± 3,6 frente a 3,2 ± 3,7, p = 0,022), el rendimiento laboral (5,5 ± 3,5 frente a 2,9 ± 3,4, p = 0,027), las relaciones sociales (3,9 ± 3,6 frente a 2,3 ± 3,1, p = 0,031), el sueño (5,8 ± 3,7 frente a 3,0 ± 3,5, p = 0,006) y el disfrute de la vida (4,6 ± 3,5 frente a 1,3 ± 3,0, p = 0,004) en comparación con el DCP no agravado (Tabla S6). Los pacientes de este grupo referían también niveles más altos de ansiedad (59,3 ± 28,3 frente a 44,3 ± 27,8, p = 0,024) y depresión (39,7 ± 35,9 frente a 15,2 ± 18,1, p = 0,012), y un deterioro del sueño más pronunciado (59,1 ± 35,6 frente a 30,2 ± 34,4, p = 0,005) (Tabla S6). Aunque la impresión del estado de salud no difería significativamente entre estos grupos, el DCP agravado se asociaba a una mayor carga sobre las siguientes dimensiones de la calidad de vida: actividades habituales (p = 0,002) y ansiedad y depresión (p = 0,006) (Tabla S6).
La regresión logística incluyó las impresiones generales de ansiedad, depresión y calidad del sueño. La hipotensión ortostática no se eligió para este análisis debido a su baja frecuencia en la muestra (n = 8). No se detectó ninguna multicolinearidad entre las variables incluidas. El modelo resultante presentó un ajuste suficiente (prueba de Hosmer y Lemeshow, p = 0,745) y explicó el 55,9 % de la varianza observada en el agravamiento del DCP, con una sensibilidad del 53,3 % y una especificidad del 88,9 %. La impresión global de los niveles de ansiedad (OR: 1,04, IC 95 %: 1,01–1,07) y la impresión global de la calidad del sueño (OR: 1,04; IC 95 %: 1,01-1,07) contribuyeron significativamente a este modelo (Tabla S7).
Comparación entre sujetos con dolor crónico persistente exclusivamente relacionado con la COVID-19 y exclusivamente no relacionado con la COVID-19
Los datos de los participantes con dolor crónico actual exclusivamente relacionado con la COVID-19 (es decir, individuos con DNC crónico persistente que nunca antes habían tenido dolor crónico; n = 72) se compararon con los de sujetos con dolor crónico actual sin relación alguna con (ni influencia de) la COVID-19 (es decir, pacientes con DCP no agravado y sin DNC; n = 18) y los resultados se presentan en la Tabla S6. El grupo con dolor crónico relacionado con la COVID refirió una mayor intensidad media del dolor (5,6 ± 2,0 frente a 3,9 ± 2,4, p = 0,002) y significativamente más síntomas de dolor neuropático (Tabla S8) en comparación con el de dolor crónico relación con la COVID. El funcionamiento cognitivo se vio más afectado (15,9 ± 4,3 frente a 19,1 ± 4,7, p = 0,023) y la aparición de fatiga de nuevo cuño tras la infección fue más frecuente entre los sujetos con dolor crónico relacionado con la COVID (96,9 % frente a 70 %, p = 0,016) que entre aquellos otros con dolor crónico sin relación con la COVID (Tabla S8). Más aún, los individuos con dolor crónico relacionado con la COVID refirieron una impresión más baja de su estado de salud (5,7 ± 1,6 frente a 6,6 ± 1,5, p = 0,027); una mayor carga sobre las actividades habituales de las dimensiones de calidad de vida (p < 0,001) y de dolor y molestias (p = 0,008, Tabla S6); niveles más altos de ansiedad (65,0 ± 30,3 frente a 37,8 ± 29,4, p = 0,001) y depresión (34,4 ± 30,8 frente a 13,6 ± 17,1, p = 0,002), y un deterioro más grave del sueño (54,6 ± 34,1 frente a 29 ± 34,2, p = 0,010), en comparación con aquellos que tenían dolor crónico sin relación con la COVID.
Además, al compararlos con los pacientes de dolor crónico sin relación con la COVID, quienes tenían dolor crónico relacionado con la COVID presentaban una mayor interferencia con las actividades en general (6,4 ± 2,9 frente a 4,4 ± 3,3, p = 0,014), el ánimo (6,3 ± 3,3 frente a 3,6 ± 3,4, p = 0,004), la ambulación (5,3 ± 0,7 frente a 3,1 ± 3,7, p = 0,042), el rendimiento laboral (6,4 ± 3,3 frente a 3,2 ± 3,4, p = 0,001), las relaciones sociales (4,1 ± 3,8 frente a 2,9 ± 3,5, p = 0,024), el sueño (5,1 ± 3,7 frente a 2,9 ± 3,5, p = 0,036) y el disfrute de la vida (4,7 ± 3,5 frente a 1,7 ± 3,0, p = 0,002), respectivamente (Tabla S8).
DISCUSIÓN
Nuestro estudio hizo una detallada caracterización de la posible evolución del dolor después de la COVID-19 (Figura 2). Aproximadamente, un tercio del DNC se resolvió del todo, generalmente en el plazo de 12 semanas. Mientras, en más de la mitad de los casos hubo un curso crónico, persistiendo en la mayoría (97 %) durante varios meses, estando aún presente en el momento de la evaluación. Esto se asoció a la hospitalización por COVID-19, al desarrollo de fatiga de nueva aparición, a un menor rendimiento cognitivo, a déficits motores y sensitivos térmicos, y a alteraciones del ánimo y el sueño, originando una menor calidad de vida. En particular, la hospitalización, la fatiga de nueva aparición y el menor rendimiento cognitivo contribuían de forma menor a moderada a la probabilidad de cronificación del dolor. El dolor neuropático se asoció a una mayor probabilidad de cronificación y estuvo presente en el 7,6 % de los pacientes con DNC, asociándose a fatiga de nuevo cuño, déficits motores y sensitivos térmicos, alodinia mecánica en el foco del dolor e índices menores de vacunación frente al SARS-CoV-2. Observamos también que el DN-4 era muy preciso para identificar el probable dolor neuropático en nuestra muestra. Finalmente, el dolor crónico relacionado con la COVID se vio que era más intenso, generando un mayor gravamen sobre la funcionalidad general, el ánimo y el sueño, y más deterioro cognitivo en comparación con el dolor no relacionado con la COVID.
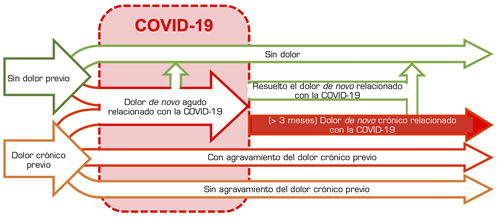
Fig. 2. Vías del dolor en los pacientes tras la COVID-19. Esta figura ilustra las posibles vías clínicas que los fenómenos dolorosos pueden seguir en los pacientes que han tenido COVID-19. Los sujetos sin dolor crónico previo pueden desarrollar de novo dolor agudo en relación con la COVID-19 o seguir sin síntomas dolorosos. Por su parte, aquellos con dolor crónico previo pueden también desarrollar dolor agudo de nueva aparición en relación con la COVID-19 y, en ellos, el dolor previo puede agravarse o no. La mayor parte del dolor de novo que aparece tras la COVID-19 es de curso crónico, es decir, persiste incluso pasadas 12 semanas desde la infección. Sin embargo, en algunos casos, el dolor de nueva aparición puede resolverse antes de este periodo de tiempo. Además, una minoría de los casos de dolor crónico de nuevo cuño por la COVID-19 también pueden resolverse posteriormente.
El dolor se observó que afectaba al 30-70 % de los pacientes durante la COVID-19 aguda (14,34,35,36,37,38,39,40,41). Sin embargo, hay pocos estudios sobre su historia natural más allá de los primeros meses de la infección. De hecho, hasta donde sabemos, son cinco las investigaciones que han abordado concretamente la incidencia del DNC. La primera fue un estudio prospectivo de casos y controles relativamente pequeño en el que publicamos que alrededor del 20 % de los supervivientes de la COVID-19 desarrollaban dolor crónico de nueva aparición tras una media de 4 meses desde el alta hospitalaria (42). Cuatro cohortes de mayor tamaño que se publicaron posteriormente, y donde se valoraron sujetos al cabo de 6 a 13,2 meses desde la infección, hallaron incidencias que iban del 15,1 % al 45,1 % (8,9,10,11,12,13,14). El sexo femenino (13,14), la anosmia (42), la mialgia y/o la cefalea al ingreso (12,13), la duración de la hospitalización y los antecedentes de dolor musculoesquelético (13) se asociaron a dolor crónico de nueva aparición. Los datos reunidos por estos informes pioneros tienen un gran valor, pero persisten los vacíos de conocimiento. Todos los estudios citados se realizaron mediante entrevistas telefónicas a sujetos previamente hospitalizados, y los de mayor tamaño se centraron concretamente en el dolor musculoesquelético. Por tanto, no aportaron información detallada sobre los resultados de la exploración física, las poblaciones no europeas y los subtipos de dolor. Por otra parte, los datos sobre la historia natural del DNC, las distintas trayectorias que puede seguir y sus rasgos fenotípicos individuales han sido abordados por pocos de estos estudios, existiendo solo en relación con el dolor musculoesquelético (13).
Actualmente, la mayoría de los estudios disponibles han examinado el DNC atendiendo a dos categorías concretas: el dolor musculoesquelético y el neuropático. El dolor musculoesquelético ha sido investigado por la mayoría de los estudios en este campo y los de mayor magnitud entre ellos (8,9,10,11,13,14,15). Observaron que afecta sobre todo a la columna y los miembros inferiores, y que tiene una distribución generalizada en hasta dos tercios de los casos. Se vio también que el DNC musculoesquelético se asociaba a fatiga y mialgia en el momento del ingreso (8,9,10,11). Aunque datos previos indicaban que este subtipo de dolor podía asociarse a una respuesta inflamatoria más grave (es decir, leucopenia y elevación del dímero D) durante la fase aguda (15), un reciente estudio de mayor envergadura encontró que los biomarcadores séricos de gravedad de la COVID-19 aguda presentan una escasa asociación con el DNC, si bien este último trabajo no examinó directamente los marcadores inflamatorios. La mayoría de los sujetos de nuestro estudio con DNC crónico persistente presentaban dolor no neuropático (89,7 %, 87/97) y, coincidiendo con investigaciones anteriores, referían fatiga de nueva aparición con más frecuencia que aquellos con mecanismo neuropático. Observamos también que tenían niveles mayores de ansiedad y depresión, y una menor calidad del sueño, lo que se ha descrito en modelos de dolor inflamatorio crónico como, por ejemplo, la fibromialgia asociada a afecciones reumatológicas (43).
En cambio, existen muy pocos datos sobre el dolor neuropático. Un metanálisis recientemente publicado ha estimado que afecta al 10 % (IC 95 %: 5-15 %) de los pacientes durante la COVID-19 aguda/subaguda (44), pero pocos estudios han evaluado su frecuencia y características en el largo plazo. El dolor neuropático crónico se ha observado en el 24,6 % de los pacientes con DNC (16). Sin embargo, nuestro estudio encuentra que esta frecuencia es significativamente menor (7,6 %). Esto puede explicarse por el hecho de que la mayor parte de nuestra muestra no había necesitado ingreso hospitalario, mientras que los estudios previos habían examinado a sujetos que habían estado hospitalizados (16). Además, la definición de dolor neuropático fue diferente, ya que nosotros usamos los criterios IASP en exploraciones realizadas presencialmente en lugar de con cuestionarios autocumplimentables (16). Por el contrario, de acuerdo con los datos publicados actualmente (17), el dolor neuropático fue más frecuente en los miembros y fue descrito la mayoría de las veces como ‘urente’. Más aún, el dolor neuropático se ha asociado a la depresión, al uso de azitromicina, a la gravedad y duración de la COVID-19, a los mayores niveles séricos de ferritina durante la fase aguda, y a los niveles de ansiedad y cinesofobia (16,17). Aunque nuestros resultados no avalan esta asociación con la ansiedad o la depresión, sí observamos índices menores de vacunación en estos pacientes. Este hallazgo puede ser indirecto, pues se ha visto que la vacunación se correlaciona con una menor duración y gravedad de la enfermedad (45,46) y, por tanto, posiblemente con una menor incidencia de dolor neuropático. No obstante, la vacunación podría también producir una viremia menor y menos invasión del tejido nervioso por el SARS-CoV-2.
Aun así, no hay ningún mecanismo claro que se haya mostrado capaz de explicar las afecciones post-COVID-19. Las hipótesis más discutidas son las siguientes: i) las secuelas de la invasión vírica directa y la destrucción de los tejidos nerviosos y de otro tipo; y ii) el desequilibrio inmunológico persistente tras la infección. Se han aislado partículas de SARS-CoV-2 de neuronas y otras células de la corteza, la sustancia negra, el tronco encefálico y lo pares craneales en hasta un 53 % de las autopsias de pacientes (18). Sin embargo, la infección parece limitarse solamente a un subconjunto de células y la asociación entre carga vírica tisular y gravedad de las alteraciones neuropatológicas parece poco firme (18,47,48). Mientras tanto, un creciente número de datos parecen apuntar hacia la presencia de anomalías inflamatorias persistentes tras la COVID-19. Una cohorte recientemente publicada observó anomalías persistentes en una serie de citocinas al cabo de una mediana de 8 meses desde la infección; entre ellas, las elevaciones de TNF-a, IL-1b e IL-6 estaban asociadas a la afección post-COVID-19 (49). Puede producirse una desregulación inmunitaria de larga duración por muchas causas posibles, como reservorios víricos persistentes, desequilibrio del sistema renina-angiotensina, disbiosis de la microbiota gastrointestinal y reprogramación crónica de las células inmunitarias, especialmente de los macrófagos pulmonares (49,50).
Los datos de nuestro estudio y de otros trabajos publicados parecen indicar que el DNC crónico musculoesquelético y neuropático tienen distintos perfiles clínicos, lo que podría apuntar hacia una fisiopatología de base distinta. El dolor musculoesquelético parece asociarse a una localización más generalizada y una plétora de síntomas multisistémicos (por ejemplo, fatiga, depresión, ansiedad y trastornos del sueño) normalmente observados en las afecciones crónicas inflamatorias. Por el contrario, el dolor neuropático parece correlacionarse con factores que apuntarían hacia una lesión tisular más grave: uso de sustancias potencialmente neurotóxicas (por ejemplo, azitromicina) (51), niveles séricos mayores de cadenas ligeras de neurofilamentos (17) y posible viremia más alta (indicada por la asociación con índices menores de vacunación y mayor gravedad de la enfermedad). Evidentemente, es improbable que estos subtipos de dolor puedan explicarse, cada uno de ellos, por un único mecanismo, pero sí es posible que haya un mecanismo que predomine sobre los demás.
Un aspecto importante es que la evolución del DCP post-COVID-19 se ha estudiado muy poco. En efecto, solo dos estudios han presentado datos del DCP separados de los relativos al DNC (8,9,10,11,12). Coincidiendo con nuestros resultados, observaron que la mayoría de los sujetos con DCP referían un empeoramiento persistente del dolor previo tras la infección (12). En nuestra muestra, los niveles globales de ansiedad y calidad del sueño contribuían moderadamente al riesgo de que empeorase el DCP. Además, encontramos que el empeoramiento del DCP se asociaba a hipotensión ortostática. Este es un resultado novedoso que podría indicar cierto papel de la invasión del sistema nervioso central a través del nervio vago, que influye en el equilibrio vegetativo cardiovascular. Esta hipótesis ya la plantearon los estudios iniciales de autopsias, que aislaron el SARS-CoV-2 en las fibras y núcleos del nervio vago y en el bulbo raquídeo (47,52,53). Sin embargo, hay que reconocer que, si esto fuera verdad, la frecuencia de la hipotensión ortostática probablemente sería también mayor en los individuos con DNC, lo que no ha podido observarse. Por otro lado, las diferencias halladas entre el DNC y el DCP agravado en términos de los factores epidemiológicos y clínicos asociados podría indicar que se trata de entidades distintas con mecanismos de base distintos.
Nuestros datos deben interpretarse teniendo en cuenta algunas limitaciones importantes. Este fue un estudio transversal y, por tanto, no es capaz de determinar si existe causalidad, ni de evaluar la incidencia de los subtipos de dolor posteriores a la COVID-19. Algunos aspectos de nuestra muestra deben tenerse presentes al comparar nuestros resultados con los de estudios previos y/o futuros: (i) aunque la definición de DCP empleada en nuestro estudio se basó en la bibliografía disponible cuando se diseñó, los umbrales temporales difieren de los propuestos más recientemente por la Organización Mundial de la Salud (5); (ii) menos de un tercio de nuestra muestra precisó hospitalización y, por consiguiente, la gravedad promedio de la COVID-19 aguda fue probablemente menor que la de los estudios publicados anteriormente; y (iii) estudios publicados recientemente han indicado que la cepa vírica puede influir en el riesgo de APC (8,9,10,11), y nuestra muestra se infectó mayoritariamente con el SARS-CoV-2 entre 2020 y principios de 2021, cuando la mayoría de los casos brasileños de COVID-19 estaban causados por el virus inicial y su variante gamma (54). El dolor neuropático se definió conforme a criterios clínicos bien establecidos, pero no se hicieron otros análisis complementarios para evaluar la presencia o no de lesiones en la vía somatosensorial. El número de individuos que habían presentado este subtipo de dolor era relativamente pequeño, limitando la potencia estadística de nuestros análisis para este grupo. Además, no es posible excluir la posibilidad de un sesgo de selección en tanto que el reclutamiento se dirigió a pacientes con APC y aquellos con síntomas más graves se podrían haber incluido preferentemente en el estudio.
CONCLUSIONES
Nuestros datos parecen indicar que los pacientes con DNC crónico persistente y DCP agravado tras la COVID podrían presentar características clínicas diferentes y surgir de mecanismos de base nociceptivos o neuropáticos, lo que es bastante probable que tenga implicaciones terapéuticas y pronósticas. Junto con la bibliografía existente, esto podría avalar la siguiente fase del estudio del dolor crónico relacionado con la APC: el diseño de ensayos terapéuticos y de posibles acciones preventivas dirigidas a los pacientes con riesgo elevado de presentar dolor crónico después de la COVID.
CONTRIBUCIÓN DE LOS AUTORES
GTK ha contribuido a la concepción y el diseño del estudio, el análisis e interpretación de los datos y el borrador del manuscrito. FHCS ha contribuido a la concepción y el diseño del estudio, y a la adquisición e interpretación de los datos. ASF, TSR, GRG, VGF y PHMC han contribuido a la concepción del estudio y la adquisición de los datos. ARB y MJT han contribuido al diseño del estudio y la interpretación de los datos. DCA ha contribuido a la concepción y el diseño de esta investigación, a la interpretación de los datos y al borrador del manuscrito. Todos los autores han discutido los resultados y han revisado y comentado el manuscrito. La versión final del manuscrito la han aprobado todos los autores.
AGRADECIMIENTOS
Los autores desean dar las gracias al equipo investigador de la Pain in the Pandemic Initiative, así como a sus colaboradores externos, por su ayuda en la recogida de datos y la inclusión de pacientes.
INFORMACIÓN DE FINANCIACIÓN
Esta investigación no ha recibido ninguna subvención específica de agencias de los sectores públicos, comercial y sin ánimo de lucro.
DECLARACIÓN DE CONFLICTOS DE INTERESES
Los autores no tienen conflictos de intereses que declarar.
ORCID
Gabriel T. Kubota https://orcid.org/0000-0001-7790-8111
Felipe H. C. Soares https://orcid.org/0000-0003-0497-2248
Alessandra S. da Fonseca https://orcid.org/0000-0003-3785-4176
Talita dos Santos Rosa https://orcid.org/0000-0001-8997-6584
Valquiria A. da Silva https://orcid.org/0000-0002-4113-1766
Gisele R. Gouveia https://orcid.org/0000-0002-1627-4490
Viviane G. Faria https://orcid.org/0009-0003-7632-2663
Pedro H. M. da Cunha https://orcid.org/0000-0002-7957-4714
André R. Brunoni https://orcid.org/0000-0002-6310-3571
Manoel J. Teixeira https://orcid.org/0000-0002-7974-6045
Daniel C. de Andrade https://orcid.org/0000-0003-3411-632X
BIBLIOGRAFÍA
INFORMACIÓN SUPLEMENTARIA
Se puede consultar otra información suplementaria en la Red, en el apartado “Información suplementaria” al final del artículo original https://onlinelibrary.wiley.com/doi/10.1002/ejp.2094.