10.20986/resed.2025.4120/2023
NOTA CLÍNICA
Síndrome de parsonage-turner: presentación atípica posterior a vacuna para covid-19. reporte de un caso y revisión de la literatura
Atypical parsonage-turner syndrome after covid-19 vaccine. A case report and literature review
Rene A. Linares Giraldo1
José I. Linares Vasquez2
Hernando Rubiano Daniel3
Jorge E. Gutiérrez Godoy4
1Servicio de Anestesiología. Clínica Sebastián de Belalcázar. Colsanitas. Cali, Colombia
2Universidad de los Andes. Bogotá, Colombia
3Servicio de Neurología. Clínica Sebastián de Belalcázar. Colsanitas. Cali, Colombia
4Medicina Física y Rehabilitación. Neurofisiólogo. Cali, Colombia
RESUMEN
El síndrome de Parsonage-Turner (SPT) se define como una neuropatía periférica axonal de comienzo agudo. Con mayor frecuencia se caracteriza por dolor severo, paresia progresiva unilateral en los miembros superiores y atrofia muscular. Es incapacitante en su fase aguda y puede producir discapacidad prolongada, que podría reducirse con un tratamiento oportuno. El SPT adquirió relevancia en el contexto de la pandemia por SARS-CoV-2 ya que ha sido asociado con múltiples desencadenantes que incluyen infección viral y vacunas, pero debido a su baja frecuencia suele no diagnosticarse. Aunque la electromiografía y la neurografía por resonancia magnética son útiles para confirmarlo, la clínica continúa siendo el método diagnóstico más fácil, confiable y costo-efectivo. Presentamos un paciente con SPT posterior a la vacuna contra COVID-19, cuyo diagnóstico inicial se basó en los hallazgos clínicos y la electromiografía. Se realizó además una revisión de la literatura relacionada.
Palabras clave: Amiotrofia neurálgica, síndrome de Parsonage-Turner, vacunación COVID-19
ABSTRACT
IParsonage-Turner syndrome (PTS) is described as an acute onset axonal peripheral neuropathy. Severe pain, progressive unilateral upper limb paresis and muscle atrophy are common features. It is disabling in the acute phase and can lead to long-term disability, which can be reduced with prompt treatment. PTS became relevant in the context of the SARS-CoV-2 pandemic as it has been associated with multiple triggers, including viral infections and vaccines, but due to its low frequency it often goes undiagnosed. Clinical examination remains the simplest, most reliable and cost-effective diagnostic method, although electromyography and magnetic resonance neurography are useful for confirmation. We present a case of PTS following COVID-19 vaccination. The initial diagnosis was based on clinical findings and electromyography. A review of the relevant literature was also undertaken.
Key words: Neuralgic amyotrophy, Parsonage-Turner syndrome, COVID-19 vaccination
Correspondencia: Rene A. Linares Giraldo
renelinaresgiraldo@gmail.com
Recibido: 24-11-2023
Aceptado: 17-04-2025
Linares Giraldo RA, Linares Vasquez JI, Rubiano Daniel H, Gutiérrez Godoy JE. Síndrome de parsonage-turner: presentación atípica posterior a vacuna para covid-19. reporte de un caso y revisión de la literatura. Rev Soc Esp Dolor. 2024;31(3):169-175
INTRODUCCIÓN
El síndrome de Parsonage-Turner (SPT), también conocido como amiotrofia neurálgica, síndrome de la cintura escapular o neuropatía braquial idiopática, fue descrito por Parsonage y Turner en 1948 (1). Afecta con mayor frecuencia al plexo braquial de manera unilateral, pero puede comprometer ambos miembros superiores, los miembros inferiores y nervios aislados. Se caracteriza por dolor severo de comienzo abrupto, paresia progresiva en parches y atrofia muscular (2).
Con una incidencia de 1,64 por 100.000, el SPT se considera muy raro, lo cual retarda e incluso evita su diagnóstico (3). No obstante, se ha reportado que con educación en los niveles primarios de atención su incidencia podría aumentar hasta 1 por 1000 (4). La fisiopatología del SPT no se conoce por completo, pero ha sido relacionado con múltiples desencadenantes que incluyen trauma, cirugía, infección, vacunas y predisposición genética (2,3,4,5). Se considera una entidad con buen pronóstico, ya que algunos pacientes mejoran por completo durante los primeros 3 meses, no obstante, hasta en un 70 % de los casos la recuperación puede tardar entre 2 y 3 años, persistiendo algún grado de debilidad y dolor (2,5).
En familias europeas y norteamericanas con historia de SPT se han descrito mutaciones a nivel del gen septina SEPT9 cromosoma 17q25 (6,7,8), por lo que se consideran 2 tipos: hereditario e idiopático. Son iguales desde el punto de vista clínico (2), pero el tipo hereditario tiene peor pronóstico, ya que se presentan ataques recurrentes con mayor frecuencia y su recuperación es más lenta o incompleta (2,3,5).
La pandemia por SARS-CoV-2 y las campañas de vacunación masiva requeridas para controlarla aumentaron la exposición a 2 desencadenantes del SPT; infección viral e inmunizaciones (9,10,11), por lo que no es de extrañar que se note un aumento de los casos potencialmente relacionados con estos eventos (12).
MATERIALES Y MÉTODOS
Se presenta un paciente con diagnóstico de SPT posterior a la vacuna contra SARS-CoV-2, sustentado en los criterios clínicos, el tiempo de inicio de los síntomas y los datos aportados por la electromiografía (EMG). Con el objetivo de evaluar la posible relación causal del SPT con la vacunación, se realizó una búsqueda no exhaustiva de literatura en PubMed, entre enero de 2020 y julio de 2023.
PRESENTACIÓN DEL CASO
Paciente de sexo masculino, con 28 años de edad, que consultó al servicio de urgencias por dolor severo en hombros y miembros superiores, con marcada limitación para la movilidad, iniciando 5 días después de recibir la primera dosis de la vacuna Vaxevria-ChAdO1-X (AstraZeneca). Como antecedente de importancia mencionó 3 ataques previos (a los 5, 15 y 24 años) con dolor unilateral en los miembros superiores y paresia de rápida progresión, de los cuales se recuperó por completo.
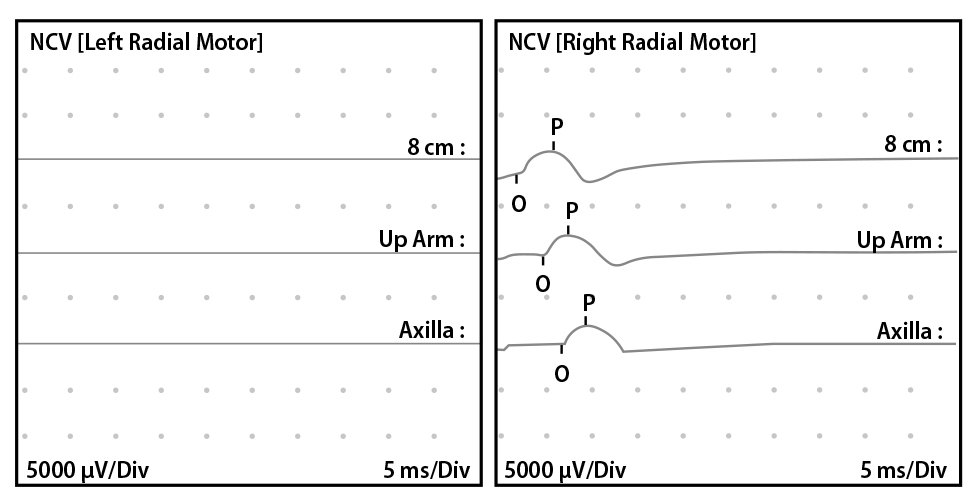
Los estudios diagnósticos realizados durante la fase aguda fueron normales, incluyendo resonancia magnética (RM) de cerebro, plexo braquial bilateral y columna cérvico-dorsal. Los estudios de laboratorio, que incluyeron hemograma, glucemia, proteína C reactiva, creatinina y análisis del líquido cefalorraquídeo, no reportaron anormalidad, no obstante la EMG de los miembros superiores, evidenció ausencia para potencial motor del nervio radial izquierdo (Figura 1).

Figura 1. Compara el potencial motor a nivel de los nervios radiales, demostrando su ausencia para el nervio radial izquierdo.
La severidad del dolor hizo difícil su evaluación neurológica durante los primeros 3 días, a pesar de recibir pregabalina, tramadol e hidromorfona, por lo que se propuso un bloqueo epidural cervical (metilprednisolona 40 mg y lidocaína al 0,125 %) que fue aceptado por el paciente, obteniendo mejoría en las primeras 12 h. Con el dolor controlado, el examen físico mostró paresia (Medical research Council) ? para la abducción y rotación interna y externa en ambos hombros, ? para la flexión y prono-supinación en ambos antebrazos, y del lado izquierdo, paresia ? para la extensión del carpo, la flexo-extensión de los dedos y la extensión y oposición del pulgar. Con base en los hallazgos clínicos, el informe de la EMG y el antecedente descrito, se diagnosticó un SPT bilateral, y se continuó manejo ambulatorio con prednisona oral 40 mg al día durante 10 días, terapia física y ocupacional.
Con excepción de la paresia radial izquierda, el paciente recuperó la movilidad de la cintura escapular y los miembros superiores durante los primeros 30 días. En la semana 8 de seguimiento se evidenció disquinesia escapular bilateral con atrofia de los músculos supra e infraespinoso derechos y paresia total del radial izquierdo (Figura 2). La EMG de control mostró una plexopatía bilateral, comprometiendo los 3 troncos del plexo braquial, con ausencia del potencial motor para el nervio radial izquierdo. Se realizó seguimiento hasta la semana 44, observando persistencia de la paresia radial.
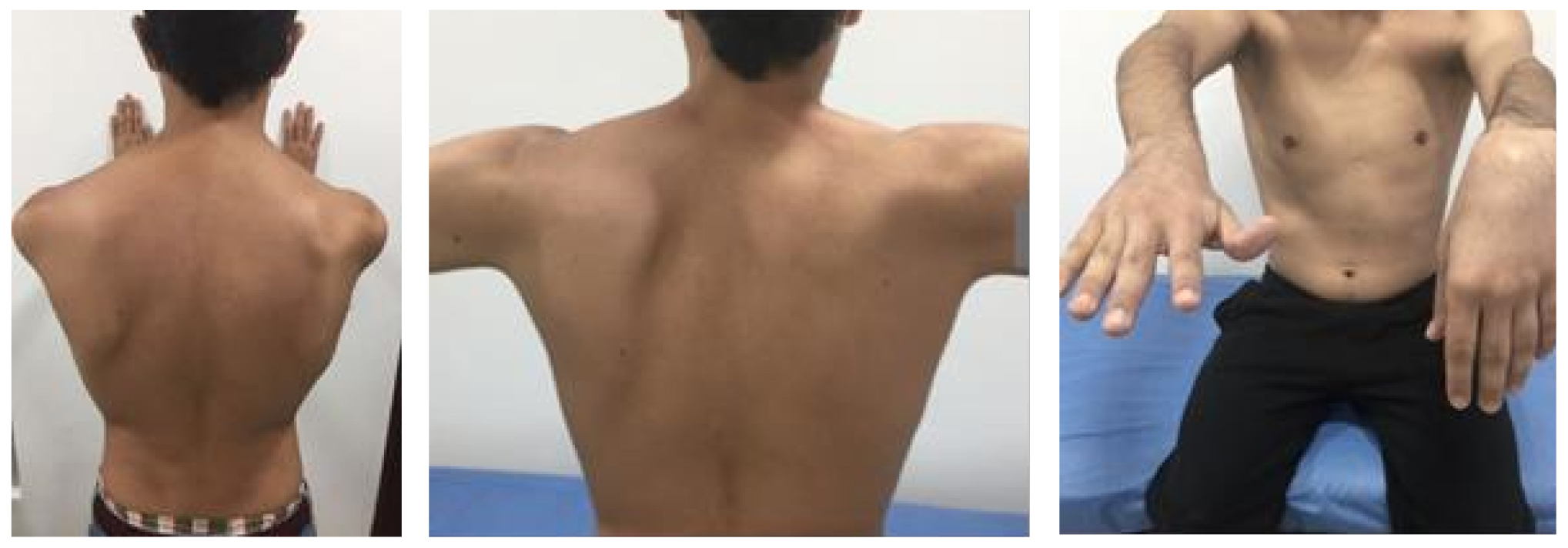
Figura 2. Disquinesia escapular, con escápula alada y atrofia de músculos supra e infraespinoso derechos y paresia radial izquierda con mano caída.
Una vez informado sobre el diagnóstico y su posible relación de la vacuna contra COVID-19, el paciente tomó la decisión de suspender el esquema de vacunación programado.
DISCUSIÓN
El paciente presentado cumple con los criterios (clínicos y por EMG) para diagnosticar un SPT (2). Fueron descartadas otras causas de dolor y neuritis como infección, VIH, diabetes, enfermedad reumática y vasculitis, así como radiculopatía cervical y tendinitis del hombro (2,13,14); el único factor identificado fue la inmunización, que junto a la infección viral se consideran los desencadenantes más comunes (14). En la semana 8 de seguimiento se evidenció atrofia de los músculos supra e infraespinoso derechos, lo cual fue confirmado por una RM de control. De otra parte, la presencia de escápula alada, aunque no fue evaluado por la EMG, sugiere compromiso del nervio largo torácico, presente hasta en un 70 % de los casos (13,14).
Dentro del amplio espectro en la presentación del SPT, se describe en orden de frecuencia el compromiso unilateral de los músculos infraespinoso, serrato mayor, supraespinoso, músculo cutáneo, frénico y fascículos distales como el interóseo posterior (radial), el anterior (mediano) y con menor frecuencia el nervio ulnar (13,14), pero también se ha descrito compromiso bilateral asimétrico y de fascículos o nervios aislados (14).
Aunque el diagnóstico del SPT se basa en la clínica, la RM se considera útil para confirmarlo y descartar otras causas de dolor con presentación similar. La EMG puede no mostrar alteraciones en un 80 % de los pacientes con SPT en estado subagudo, por lo que su sensibilidad se considera limitada (13,14). No existe ningún tratamiento validado para el SPT, pero se reporta que la administración temprana de esteroides (15) y el uso de inmunoglobulina (16) pueden ser útiles.
El SARS-CoV-2 afecta al sistema nervioso central y periférico por mecanismos fisiopatológicos que no están claramente definidos. Se sugiere que el virus puede cruzar la barrera hemato-nerviosa y producir daño por invasión directa o respuesta inmunológica (9). Se han reportado múltiples complicaciones asociadas con las vacunas contra COVID-19 (10,11), para el tipo ARNm (17), la hipótesis sugiere que pueden inducir inflamación por diferentes mecanismos autoinmunes, como síntesis de IgG patógena, inflamación por antígenos cruzados (mimetismo molecular), inflamación por segundas señales (activación por espectador) y la emergencia de enfermedades autoinmunes preexistentes en pacientes con predisposición genética.
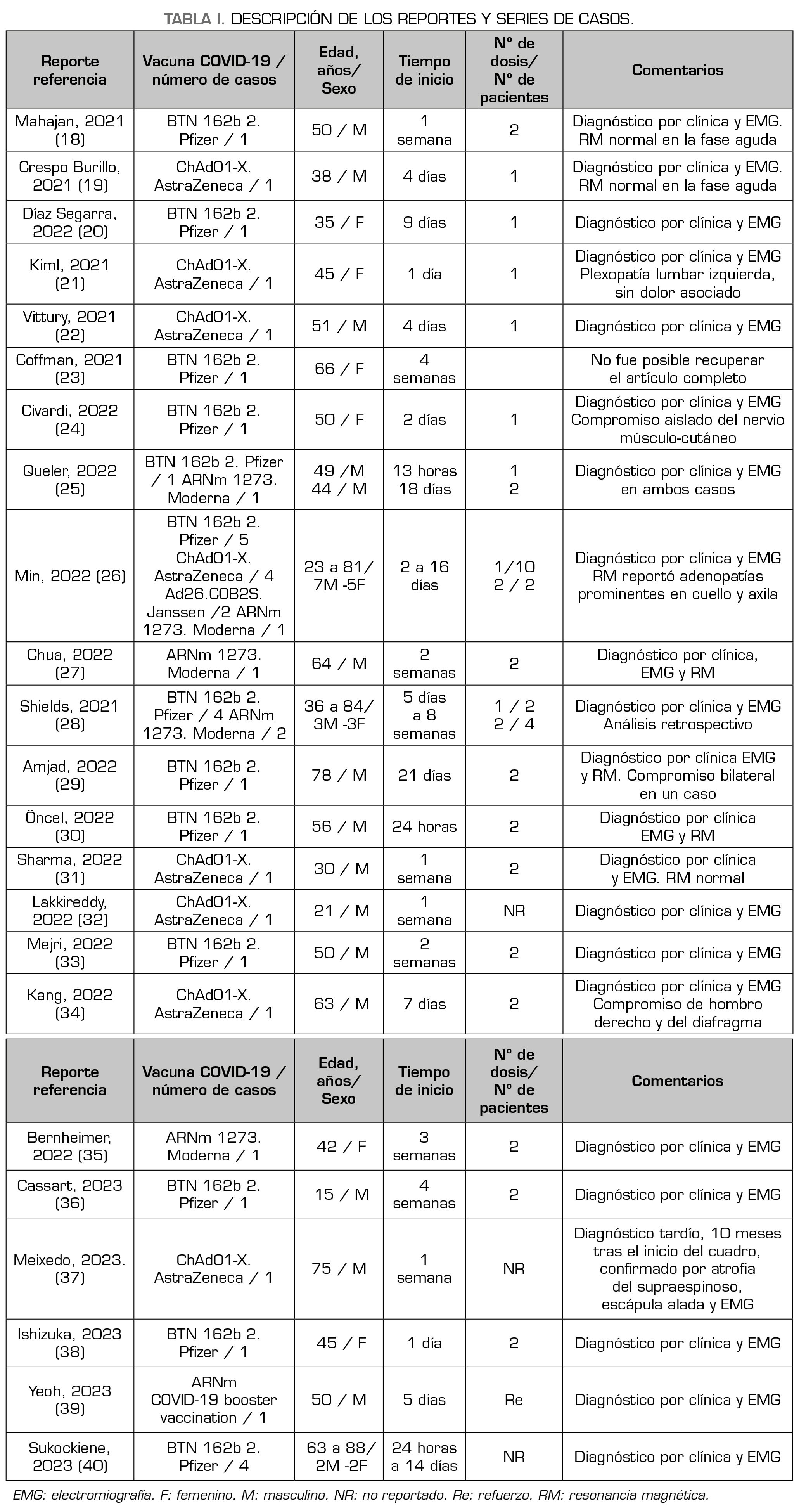
Con el objetivo de aclarar la relación entre las vacunas contra COVID-19 y el SPT, realizamos una búsqueda en PubMed entre enero de 2020 y julio de 2023. Aunque nuestra búsqueda no fue exhaustiva, encontramos 43 informes de SPT relacionados con las vacunas, ya que los síntomas se presentaron entre 1 y 56 días después de su aplicación y fueron descartadas otras causas de dolor y neuritis (Tabla 1). Nuestros datos son similares a los de una reciente revisión sistemática de la literatura (12), que reporta mayor número de casos relacionados con las vacunas ARNm, compromiso más frecuente a nivel del plexo braquial unilateral y mayor incidencia en hombres. Aunque se reporta el uso de la RM como estudio confirmatorio en algunos pacientes, en todos los casos el diagnóstico se basó en los hallazgos clínicos y la EMG.
De los 43 reportes encontrados, 23 se asocian con la vacuna BNT162b2 (Pfizer), 11 con ChAdO1-X (AstraZeneca), 6 con mRNA-1273 (Moderna) y 2 con Ad26.COB2S (Johnson & Johnson/Janssen). Veintisiete casos fueron de sexo masculino y 16 de sexo femenino, la edad varía entre 15 y 88 años, 21 casos se presentaron con la primera dosis, 17 con la segunda y uno con la vacuna de refuerzo.
La relación causal entre el SPT y las vacunas contra COVID-19 ha sido analizada con base en los datos obtenidos en The Vaccine Adverse Event Reporting System (VAERS) (25,41). Si bien se discute el riesgo de sesgo en los datos obtenidos mediante la consulta de esta base, se encontraron 335 reportes de amiotrofia neurálgica ocurridos durante los primeros 30 días después de la inmunización, sugiriendo predominio de los casos relacionados con vacunas ARNm, lo cual es similar a lo encontrado por nosotros (Tabla 1). No obstante lo anterior, el análisis de desproporción realizado no sustenta una relación causal entre las vacunas contra COVID-19 y la ocurrencia de SPT. De otra parte, mediante el uso de los reportes en VigiBase (42), se evaluó la frecuencia de 3 neuropatías inflamatorias (Guillain-Barré, parálisis facial y SPT) potencialmente asociadas con las vacunas COVID-19, en relación con otro tipo de vacunas virales. De 808.906 reportes, 57 (0,01 %) corresponden a SPT; 3320 (0,4 %) a parálisis facial y 632 (0,1 %) a Guillain-Barré. Se concluyó que la posibilidad de que ocurra SPT con las vacunas COVID-19 es muy baja, similar a la de otras vacunas virales o la influenza.
Si bien en Colombia fue previamente reportado un caso de SPT asociado con SARS-CoV-2 (43), hasta donde sabemos, este es el único caso relacionado con la vacuna contra COVID-19 que se ha reportado en nuestro país.
CONCLUSIÓN
Aunque no es posible demostrar una asociación causal entre las vacunas contra COVID-19 y el SPT, se reportó un aumento importante de los casos durante la pandemia por SARS-CoV-2 y la campaña de vacunación, lo cual permite mantener una sospecha razonable sobre su papel como desencadenantes de esta neuropatía inflamatoria.
En pacientes con historia familiar de SPT o con múltiples ataques previos, debe informarse que con los datos actuales no es posible definir la conveniencia de continuar o suspender los esquemas de vacunación contra COVID-19.
CONSIDERACIONES ÉTICAS
Los autores declaran que no tienen conflicto de intereses, que se realizó el proceso para obtener el consentimiento informado y que el reporte ha sido aprobado por el Comité de Ética en Investigación de la Fundación universitaria Sanitas-UNISANITAS.
CONFLICTO DE INTERESES
Ninguno.
FINANCIACIÓN
Ninguna.
BIBLIOGRAFÍA