DOI: 10.20986/resed.2018.3689/2018
ORIGINAL
Tratamiento con fentanilo sublingual del dolor irruptivo asociado a reacciones alérgicas durante la infusión de quimioterapia
J. M. Gasent Blesa1, P. Olmo Ortega1, E. Reche Santos1, J. Poquet Jornet2, A. Munilla Das2, J. R. Berenguer Marí3, C. Cuesta Grueso2 y A. Llombart Cussac4
1Servicio de Oncología Médica, 2Servicio de Farmacia y 3Departamento de Biología Molecular. Hospital de Dénia Marina Salud. Dénia, Alicante. España. 4Servicio de Oncología Médica. Hospital Arnau de Vilanova. Valencia. España
Recibido: 18-05-2018
Aceptado: 23-09-2018
Correspondencia: Joan Manel Gasent Blesa
joanmagasent@telefonica.net
ABSTRACT
Introduction: Drug hypersensitivity reactions (DHR) are events that can occur during the administration of several chemotherapeutic agents and which could potentially be life-threatening. These events may present with intense pain, in some cases known as breakthrough cancer pain (BTCP). There are no currently available treatment guidelines for this specific type of pain.
Objectives: To assess the efficacy of sublingual fentanyl citrate 100 mcg in cancer patients in the treatment of DHR-related BTCP during chemotherapy infusion.
Material and methods: A retrospective study with patients receiving chemotherapy in the Medical Oncology Department of Hospital de Denia between 2013 and 2016 who were treated with fentanyl due to DHR-related BTCP (VAS [Visual Analogue Scale] > 7). BTCP severity was determined via a VAS before and after fentanyl administration. Student's t-test was used to compare VAS scores before and after the treatment.
Results: A total of 34 patients were included (73.53 %
women; mean age: 59.68 y/o). The chemotherapy treatments that were most frequently associated with the occurrence of DHR-related BTCP were docetaxel and oxaliplatin (both 35.29 %), followed by paclitaxel (20.59 %). On average, patients had a baseline VAS score of 8.55 (SD 0.79) before being treated with fentanyl. After treatment, the mean pain intensity was 1.48 (SD 1.50), which represented a significant difference (p < 0.001). The mean duration of the BTCP episode was of 5.29 minutes (SD 2.25), and the mean time to achieve pain relief was 1.52 minutes (SD 0.71).
Conclusions: Sublingual fentanyl is an effective drug in the management of DHR-related BTCP during the infusion of taxanes and oxaliplatin, as it provides for a rapid and significant pain relief. Its role in this context should be further investigated by means of controlled clinical trials.
Key words: Infusion allergic reactions, breakthrough cancer pain, fentanyl, sublingual.
RESUMEN
Introducción: Las reacciones de hipersensibilidad a fármacos (RHF) son eventos potencialmente mortales que se producen durante la administración de diversos agentes quimioterápicos. Pueden cursar con un dolor intenso, considerado en algunos casos como dolor irruptivo oncológico (DIO). Actualmente no existen guías para el tratamiento de este tipo específico de dolor.
Objetivos: Evaluar, en pacientes oncológicos, la eficacia del citrato de fentanilo sublingual 100 mcg en el tratamiento del DIO asociado a RHF durante la infusión de quimioterapia.
Material y métodos: Estudio retrospectivo con pacientes que recibieron quimioterapia en el servicio de Oncología Médica del Hospital de Denia entre 2013 y 2016 y que fueron tratados con fentanilo por DIO asociado a RHF (EVA > 7). Se estableció la gravedad del DIO mediante una escala EVA antes y después de administrar fentanilo. Se utilizó la t de Student para comparar las puntuaciones EVA antes y después del tratamiento.
Resultados: En total, se incluyeron 34 pacientes (73,53 % mujeres, edad media 59,68 años). Los tratamientos quimioterápicos asociados a una mayor frecuencia a la aparición de DIO por RHF fueron docetaxel y oxaliplatino (ambos 35,29 %), seguidos de paclitaxel (20,59 %). En promedio, los pacientes tuvieron un valor basal de EVA de 8,55 (DE 0,79) antes de ser tratados con fentanilo. Tras el tratamiento, la intensidad media del dolor fue de 1,48 (DE 1,50), siendo la diferencia significativa (p < 0,001). La duración media del episodio de DIO fue de 5,29 minutos (DE 2,25), y el tiempo medio hasta el inicio del alivio del dolor de 1,52 minutos (DE 0,71).
Conclusiones: Fentanilo sublingual es un fármaco efectivo en el manejo del DIO asociado a RHF durante la infusión de taxanos y oxaliplatino, donde permite un alivio rápido y significativo del dolor. Se debe seguir investigando su papel en este contexto mediante ensayos clínicos controlados.
Palabras clave: Reacciones de hipersensibilidad a fármacos, dolor irruptivo oncológico, fentanilo, sublingual.
INTRODUCCIÓN
Las reacciones de hipersensibilidad a fármacos (RHF) se definen como reacciones adversas e imprevistas cuyos signos y síntomas no pueden explicarse por la toxicidad conocida de estos fármacos (1). Suponen la participación del sistema inmunitario y pueden ser de dos tipos: las anafilácticas suelen estar mediadas por inmunoglobulina E (IgE) (2), mientras que las anafilactoides, no mediadas por IgE, no son verdaderas reacciones alérgicas (3). Ambos tipos de RHF comparten manifestaciones clínicas y requieren de una evaluación rápida y precisa para evitar complicaciones agudas que puedan tener consecuencias graves, incluida la muerte del paciente.
El amplio uso en la última década de estrategias de quimioterapia ha dado lugar a un aumento significativo en la incidencia de RHF. Las reacciones exantemáticas, el dolor abdominal y el dolor de espalda son síntomas comunes que pueden llegar a cursar incluso con anemia hemolítica (4-7). Las RHF pueden aparecer con casi todos los tipos de fármacos oncológicos sistémicos (citotóxicos y anticuerpos monoclonales). Se ha descrito que pueden afectar a un tercio de los pacientes tratados con fármacos biológicos (8). De todos ellos, rituximab causa la mayoría de RHF (9), seguido por los taxanos y las sales de platino. Así, se ha notificado una incidencia de RHF de hasta el 26,7 % en pacientes que han recibido más de 7 ciclos de sales de platino (10). La mayoría de las reacciones a la infusión notificadas (95 %) son de grado 1-2 (de leve a moderada) (11).
El DIO se define como una exacerbación pasajera del dolor que se produce bien espontáneamente, o bien en relación con un desencadenante específico predecible o impredecible a pesar de un dolor de base relativamente estable y adecuadamente controlado (12). Se ha estimado una prevalencia del 59 %, a pesar de la introducción de tratamientos específicos (13), y su tratamiento es un objetivo primario en la mejora de los cuidados del paciente oncológico (14). Hay pacientes que pueden experimentar DIO sin dolor de base debido a procedimientos (15). El DIO (torácico, dorsolumbar) se encuentra entre los síntomas de los pacientes que experimentan RHF, y puede llegar a ser de gran intensidad. Otros síntomas habituales de la HRF, como la disnea, las sibilancias, el edema de glotis o el exantema (16) pueden contribuir a empeorar el cuadro.
A pesar de reconocerse al DIO como un posible síntoma de las RHF (17), este carece de un manejo claramente definido y no se han publicado guías para tratarlo en este contexto. El tratamiento del DIO debe tener en cuenta la brevedad de sus episodios y la rapidez con la que se alcanza el pico máximo de dolor. En términos generales, las guías de práctica clínica recomiendan el uso de un opiáceo de liberación rápida, como podría ser el fentanilo transmucoso en cualquiera de sus especialidades (18-20).
Los pacientes que experimentan una RHF asociada a DIO suelen ser tratados inicialmente en el Hospital de Día, donde son monitorizados. Nuestra experiencia previa con el uso de cloruro mórfico subcutáneo, fármaco habitualmente empleado en estos casos, presentaba dos inconvenientes. Por una parte, el prolongado tiempo que requiere su preparación y administración y, por otra, el tiempo necesario para conseguir un control del dolor. Por ello, decidimos valorar otras pautas analgésicas, en este caso los comprimidos de citrato de fentanilo sublingual.
El presente estudio tuvo como objetivo obtener datos sobre la eficacia de citrato de fentanilo sublingual 100 mcg (Abstral, Kyowa Kirin Ltd.) en el tratamiento del DIO asociado a una reacción alérgica a fármacos quimioterápicos en pacientes oncológicos.
MATERIAL Y MÉTODOS
Estudio observacional retrospectivo, realizado en pacientes que recibieron tratamiento quimioterápico en el Servicio de Oncología Médica del Hospital de Denia, entre 2013 y 2016. Se obtuvo el consentimiento informado de todos los pacientes y este se realizó según las normas de buena práctica clínica.
Criterios de inclusión y exclusión
Se identificó a todos los pacientes ≥ 18 años que presentaron DIO asociado a una RHF durante la quimioterapia con un régimen basado en platino (carboplatino u oxaliplatino) o taxanos (paclitaxel o docetaxel). Se seleccionaron aquellos sujetos con un valor de EVA > 7.
Los pacientes recibieron tratamiento con dexclorfeniramina (5 mg), hidrocortisona (100 mg) y famotidina (50 mg), además de soporte con las medidas vitales habituales, según el protocolo de manejo de reacciones alérgicas establecido en el Hospital de Día.
Los pacientes debían mostrar una adecuada comprensión oral y escrita, y haber firmado el consentimiento informado. Se excluyó a aquellos que presentaron alergia o contraindicación a mórficos, un trastorno psiquiátrico grave o cualquier enfermedad que impidiera la recogida de datos del estudio, o a pacientes con adicción a opioides.
Variables e instrumentos de medida
Para cada paciente del estudio se recogieron como datos iniciales el sexo, la edad, la fecha de visita y el tratamiento analgésico basal.
A aquellos pacientes con un valor EVA > 7 se les administró una dosis de citrato fentanilo sublingual (100 mcg). Se les fue evaluando mediante EVA durante los siguientes 30 minutos. En este tiempo se fue registrando la puntuación EVA y el tiempo medio hasta la aparición del alivio.
Se anotaron los efectos secundarios con el tratamiento actual, si los hubo, así como su grado (leve: no precisó tratamiento sintomático ni obligó a suspender el tratamiento analgésico; moderado: precisó tratamiento específico, pero bastó con reducir la dosis de analgésico; o grave: la intensidad del síntoma obligó a suspender el tratamiento analgésico). Se registró, cuando procedió, la toma de medicación adyuvante y su dosis.
Análisis estadístico
Para el análisis de los datos se realizó un análisis estadístico descriptivo de todas las variables recogidas en el Cuaderno de Recogida de Datos mediante la elaboración de tablas de frecuencias para las variables de tipo nominal, y medidas de tendencia central y dispersión para las variables continuas. En el caso de estas últimas se estimaron los intervalos de confianza al 95 % (IC 95 %).
Para la comparación entre los valores de EVA pretratamiento y postratamiento se utilizó la prueba t de Student para datos pareados, estableciendo un nivel de significación en p < 0,05.
RESULTADOS
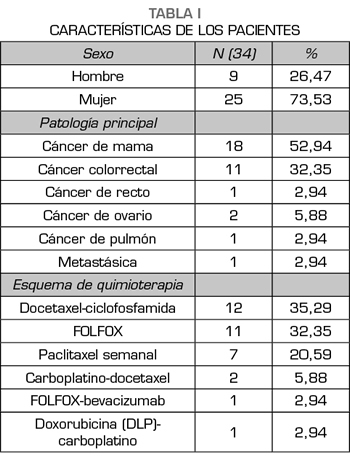
Un total de 34 pacientes cumplieron los criterios de selección y fueron incluidos en el estudio. La edad media fue de 59,68 años (rango 39-80). El 73,53 % fueron mujeres. El 64,69 % tenían tumores en estadios iniciales (siendo el más frecuente el T3N1M0; 23,53 %)
y estaban siguiendo pautas de neoadyuvancia o adyuvancia. La mayoría de los tumores eran de mama (50 %,
n = 17) y colorrectales (23,53 %; n = 8) (Tabla I).

La HRF se debió a una reacción a la infusión de quimioterapia en todas las cohortes. Los tratamientos quimioterápicos asociados con mayor frecuencia a la aparición de DIO fueron docetaxel-ciclofosfamida y oxaliplatino (ambos 35,29 %; n = 12), seguidos de paclitaxel (20,59 %; n = 7).
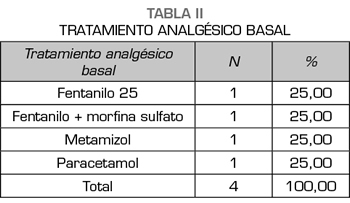
De la población del estudio, un 11,76 % (n = 4) estaban siendo tratados con analgésico basal (un caso con fentanilo 25 mcg/h, otro con fentanilo y morfina oral, otro con metamizol y otro con paracetamol) (Tabla II).
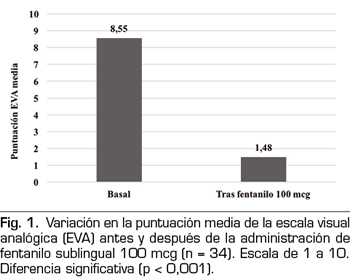
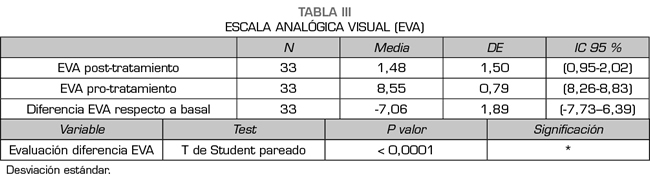
En promedio, los pacientes tuvieron un valor EVA basal de 8,55 (DE 0,79) antes de ser tratados con fentanilo sublingual 100 mcg (Figura 1). Después del tratamiento, la intensidad media del dolor fue de 1,48 (DE 1,50), siendo la diferencia significativa (p < 0,001) (Tabla III).
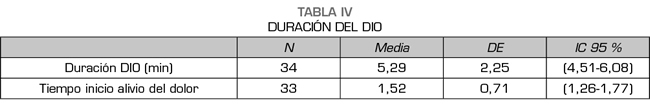
La duración media del episodio de DIO fue de 5,29 minutos (DE 2,25), y el tiempo medio hasta el inicio del alivio del dolor fue de 1,52 minutos (DE 0,71). En ningún paciente hubo que repetir la dosis de fentanilo sublingual, y en todos ellos se consiguió aliviar el dolor (Tabla IV).
No se registraron acontecimientos adversos asociados al uso de fentanilo.
DISCUSIÓN
El creciente uso de los regímenes quimioterápicos ha dado lugar a un aumento significativo en la incidencia de RHF. Los tratamientos que incluyen oxaliplatino se utilizan en primera línea de numerosos tumores malignos, tales como los colorrectales o el cáncer de páncreas (4-7). Los taxanos son de uso habitual en el manejo de neoplasias de mama, pulmón y ovario. La hipersensibilidad al carboplatino suele ser mayor entre los 6-21 ciclos; los síntomas varían desde prurito leve y eritrodermia hasta anafilaxia (6). Estos pueden manifestarse desde minutos hasta días después de la infusión del fármaco e impedir su uso posterior en la terapia de rescate. Aunque esto rara vez ocurre durante el tratamiento en primera línea (aproximadamente un 1 % de los casos), entre un 8 % y un 44 % de los pacientes experimentarán una RHF durante la segunda o tercera línea de tratamiento (10,21,22). Con docetaxel, el porcentaje de reacciones ha demostrado ser del 5 al 20 %, y del 2 % para reacciones graves, a pesar del uso de premedicación estándar (23).
En este estudio, los tratamientos quimioterápicos asociados con mayor frecuencia a la aparición de DIO como síntoma de una RHF fueron docetaxel y oxaliplatino. Ambos afectaron acerca de la tercera parte de la población analizada.
Tras la aparición de una RHF, normalmente se suspende la infusión y se inicia tratamiento sintomático, que suele incluir el uso de antihistamínicos, corticoides, famotidina y analgésicos. Una vez se han resuelto los síntomas de la RHF, se puede retomar el tratamiento con el mismo quimioterápico si dicha reacción ha sido leve o moderada, aunque las administraciones posteriores deberían incluir premedicación, reducción de la velocidad de infusión y/o un protocolo de desensibilización. En reacciones graves, la infusión debe interrumpirse y se iniciará terapia de soporte (2,24).
El DIO es una entidad poco conocida e infradiagnosticada; en España se ha comunicado su presencia en un 23 % en los pacientes con cáncer avanzado (25), cifra muy inferior a los datos publicados (13). Un 41 % de los pacientes oncológicos sufren al menos un episodio diario de DIO (2). Supone una elevada carga económica para la sociedad y para el sistema sanitario (26); deteriora el estado funcional y psicológico del paciente, dificultando el control del dolor basal y mermando su calidad de vida (19). Los pacientes con DIO suelen mostrar un mayor grado de ansiedad y, en general, una menor satisfacción con el tratamiento (19,27).
Por otro lado, las exacerbaciones del dolor en los pacientes oncológicos pueden ir más allá del DIO. El dolor oncológico puede ser causado por el cáncer en sí mismo o por la terapia que recibe el paciente. Asimismo, no es fácil clasificar las exacerbaciones que aparecen en los pacientes sin dolor basal (28).
No existe una estrategia específica para tratar el DIO asociado a RHF, para el que se suelen seguir las pautas analgésicas habituales. Sin embargo, deben tenerse en cuenta las peculiaridades de esta situación clínica. La aparición de RHF durante la quimioterapia representa un episodio de tensión tanto para el paciente afectado como para personal del Hospital de Día y los pacientes que allí se encuentran. Cualquier maniobra terapéutica que permita un alivio sencillo, rápido y eficaz de los síntomas, incluido el DIO, resultará por tanto de interés.
Hasta la fecha, nuestra práctica clínica para tratar el DIO asociado a una RHF incluía la administración de cloruro mórfico subcutáneo, lo que requería de más tiempo y recursos, además de no apreciarse un alivio rápido del dolor en casos de dolor intenso. Por este motivo, quisimos buscar alternativas terapéuticas más eficaces. El fentanilo sublingual está indicado para tratar el DIO en pacientes con dolor crónico oncológico en tratamiento con otros opioides (29). Se trata de una fenilpiperidina sintética con una potente actividad opioide (50-100 veces superior a la morfina), un rápido inicio de acción y un efecto de corta duración, con un paso rápido a través de la barrera hematoencefálica gracias a su naturaleza lipofílica (29). Estas propiedades hacen que el fentanilo sublingual encaje con el perfil de un episodio típico de DIO (30,31). Así, el pico de absorción se alcanza a los 20 minutos con fentanilo, frente a los 60 minutos que requiere la morfina oral (18).
Nuestros resultados no pueden ser más esperanzadores. La puntuación EVA media se vio significativamente reducida en más de 7 puntos, con un alivio del dolor que se inició en menos de 2 minutos. Estos resultados, en cuanto a eficacia y rapidez de acción, hacen del fentanilo sublingual una opción a considerar en el paciente que sufra una RHF durante la quimioterapia en el Hospital de Día.
La dosis inicial de fentanilo sublingual se debe ajustar en cada paciente. Se comienza con una dosis única de un comprimido de 100 mcg, que se va aumentando en caso de no obtenerse una analgesia adecuada. Cabe destacar que en este estudio ningún paciente requirió una segunda administración de fentanilo y que no se registraron efectos adversos asociados, lo cual es indicativo de la seguridad del fármaco en este contexto. Además, todos los pacientes se beneficiaron de su administración. Esto concuerda con los datos publicados, que muestran una mejoría significativa de la vía sublingual frente a placebo, con una buena tolerabilidad (32,33), mejora en la calidad de vida y en comorbilidades asociadas como la ansiedad y la depresión (31), con un perfil de seguridad similar al del resto de opiáceos (18).
Finalmente, cabe recordar la importancia de que los médicos informen a los pacientes del riesgo de hipersensibilidad de los regímenes quimioterápicos, especialmente después de múltiples infusiones. Los pacientes que estén informados apropiadamente podrán reconocer los síntomas con rapidez y ajustar sus expectativas al éxito del tratamiento (34).
Puede concluirse que el fentanilo sublingual es un fármaco efectivo en el manejo del DIO asociado a una RHF durante una infusión de quimioterapia, ya que permite un alivio rápido y significativo del dolor. Dada la naturaleza observacional de este estudio, y en ausencia de directrices sobre el tratamiento específico del DIO en este contexto, se debe seguir investigando con ensayos clínicos controlados su papel en el control del DIO asociado a RHF.
AGRADECIMIENTOS
Quisiéramos agradecer su colaboración a los pacientes que han accedido participar en el ensayo clínico.
BIBLIOGRAFÍA