DOI: 10.20986/resed.2021.3826/2020
ORIGINAL
PERFIL EPIDEMIOLÓGICO DEL DOLOR SECUNDARIO A NEUROPATÍA PERIFÉRICA MODERADA DIABÉTICA
EPIDEMIOLOGICAL PROFILE OF PAIN SECONDARY TO MODERATE DIABETIC PERIPHERAL NEUROPATHY
P. B. Zavala Ambriz1,2
E. Villarreal Ríos1
E. R. Vargas Daza1
L. Galicia Rodríguez1
C. Lara Maya3
1Unidad de Investigación Epidemiológica y en Servicios de Salud Querétaro. Instituto Mexicano del Seguro Social. Querétaro, México
2Residencia de Medicina Familiar. Unidad de Medicina Familiar No. 9 Querétaro. Querétaro, México. 3Servicio de Medicina Física y Rehabilitación. Hospital General Regional No. 1 Querétaro. Instituto Mexicano del Seguro Social. Querétaro, México
RESUMEN
Antecedentes y objetivo: La neuropatía diabética es una complicación de la diabetes tipo 2. Afecta el entorno individual, familiar y social. El objetivo es identificar el perfil epidemiológico del dolor secundario a neuropatía periférica moderada diabética.
Materiales y métodos: Estudio transversal descriptivo del dolor utilizando como fuente de información el paciente con neuropatía periférica moderada secundaria a diabetes tipo 2. La severidad de la neuropatía periférica diabética fue establecida con la escala de Michigan. El tamaño de la muestra fue 145. El perfil epidemiológico del dolor evaluado con el cuestionario multidimensional de McGill, alfa de Cronbach de 0,88, evalúa la intensidad de dolor en tres categorías independientes (índice de valoración total -dimensión sensorial, afectiva y evolutiva-, intensidad total general e intensidad total actual) y al interior identifica las características específicas del dolor. El análisis estadístico incluyó promedios, desviación estándar, intervalo de confianza para promedios y porcentajes.
Resultados: Índice de valoración total de dolor 9,74 ± 1,40 (IC 95 %; 9,51-9,97), dimensión sensorial 5,02 ± 0,84 (IC 95 %; 4,88-5,16), dimensión afectiva 3,75 ± 0,94 (IC 95 %; 3,59-3,90) y dimensión evolutiva 0,96 ± 0,18 (IC 95 %; 0,93-1,00). Las características de la valoración total de dolor identifican sacudida 35,2 %, ardiente/quemante 31,0 %, sofocante 40,0 %, agotador 33,1 %, deprimente 29,7 % y constante 35,2 %. Intensidad total general de dolor 7,70 ± 1,29 (IC 95 %; 7,49-7,91). Intensidad total actual 40,7 % “intenso”.
Conclusión: El perfil epidemiológico del dolor es de intensidad elevada, quemante, penetrante, tirante fijo o difuso, acompañado de picor generalmente constante, con repercusión emocional negativa, entre ellas sentimiento de ansiedad, secundario a dolor deprimente, agotador, sofocante y mortificante.
Palabras clave: Dolor, perfil, neuropatía, diabetes, neuropatía diabética
ABSTRACT
Background and objective: Diabetic neuropathy is a complication of type 2 diabetes, it´s present in 95 % of patients, affecting the individual, family and social environment. The objective is to identify the epidemiological profile of pain secondary to moderate diabetic peripheral neuropathy.
Materials and methods: Descriptive cross-sectional study of pain using as a source of information the patient with moderate peripheral neuropathy secondary to type 2 diabetes. The severity of diabetic peripheral neuropathy was established with the Michigan scale. The sample size was 145 patients. The epidemiological profile of pain evaluated with the McGill multidimensional questionnaire, Cronbach's alpha 0.88; it is assesses the intensity of pain in three independent categories (total pain assessment index [sensory, affective and evolutionary dimension], overall total intensity and current total intensity) and within each of them identifies the specific characteristics of pain. Statistical analysis included means, standard deviation, confidence interval for means, and percentages.
Results: Total pain assessment index 9.74 ± 1.40 (95 % CI; 9.51-9.97), sensory dimension 5.02 ± 0.84 (95 % CI; 4.88-5.16), affective dimension 3.75 ± 0.94 (95 % CI; 3.59-3.90), and evolutionary dimension 0.96 ± 0.18 (95 % CI; 0.93-1.00). Specific characteristics of the total pain assessment Index identify shaking 35.2 %, burning 31.0 %, suffocating 40.0 %, exhausting 33.1 %, depressing 29.7 % and constant 35.2 %. Total general intensity of pain 7.70 ± 1.29 (95 % CI;7.49-7.91). Current total intensity 40.7 % "intense".
Conclusion: The epidemiological profile of pain is of high intensity, burning, penetrating, fixed or diffuse, accompanied by generally constant itching, with negative emotional repercussions, including feelings of anxiety, secondary to depressing, exhausting, suffocating and mortifying pain.
Key words: Pain, profile, neuropathy, diabetes, diabetic neuropathy
Recibido: 12-06-2021
Aceptado: 21-06-2021
Correspondencia: Enrique Villarreal Ríos
enriquevillarrealrios@gmail.com
INTRODUCCIÓN
La neuropatía periférica es una complicación en la diabetes mellitus tipo 2. Los reportes de la prevalencia son variados, 50,0 % (1), 54,5 % (2), 55,1 % (3), 69,0 % (4) y 81,1 % (5); no obstante, al estratificar, la prevalencia del estadio leve es 60,7 %, del moderado 8 % y del severo 0,3 % (4). Comúnmente el diagnóstico se realiza en estadio moderado o severo; en el estadio leve el paciente atribuye la sintomatología a las actividades propias de la vida diaria y no demandan atención médica (6).
La principal manifestación clínica es el dolor de 3 o más meses de evolución con periodicidad variable, localizado en extremidades, con patrón en “guante” o “calcetín”, de intensidad cambiante, y con diversas formas de percepción, entre ellas ardoroso, quemante, punzante, frío, lancinante, calambre, toque eléctrico o difuso; en grupos o aislado a lo largo del trayecto del nervio afectado; ante un estímulo el dolor se acompaña de hipoalgesias, disestesias, parestesias, hiperpatía, hipoestesia, hiperestesia, hiperalgesia, alodinia o anestesia (7,8,9).
Los métodos diagnósticos incluyen biopsia de piel con medición de la densidad de la fibra nerviosa, indicada en casos de neuropatía atípicas; electromiografía, poco específica porque evalúa fibras no mielinizadas; y el diagnóstico clínico, empleando para el caso diversas escalas, una de ellas y la más utilizada, es la escala de Michigan, que tiene por referencia el cuestionario en torno a la sintomatología y la exploración física completa (9,10,12).
Las características que describen el panorama o expresión de un fenómeno o entidad nosológica se definen como perfil epidemiológico (13) y en torno al dolor neuropático se han identificado características propias; sin embargo, el perfil epidemiológico del dolor neuropático diabético de tipo periférico se desconoce; no obstante se puede suponer que incluye dolor constante, ardoroso, punzante, de intensidad variable, generalmente acompañado de calambres y/o parestesias (14,15).
En este contexto el objetivo del artículo es identificar el perfil epidemiológico del dolor secundario a neuropatía periférica moderada diabética.
METODOLOGÍA
Estudio transversal descriptivo en pacientes diabéticos tipo 2 con neuropatía periférica moderada, atendidos en una institución de seguridad social del estado de Querétaro México, de junio de 2019 a febrero de 2020.
La clasificación de la neuropatía periférica diabética se determinó con la escala de Michigan. Los pacientes diagnosticados con neuropatía leve y severa fueron excluidos. Se incluyeron pacientes diagnosticados como portadores de neuropatía periférica moderada, con 5 o más años de evolución de la diabetes, edad entre 40 y 59 años e inicio del dolor neuropático posterior al diagnóstico de diabetes.
El tamaño de la muestra se calculó con la fórmula de promedio para población infinita, con nivel de confianza de 88 % (Zalfa = 1,20) para hipótesis de una cola; asumiendo como hipótesis que el promedio de la intensidad total del dolor era 3 (µ = 3), valor propuesto por los investigadores a partir de la evidencia empírica; desviación estándar de 0,3 (s = 0,3), valor que corresponde al 10 % del promedio, asumiendo que la variable dolor tiene distribución normal y que en una distribución normal la desviación estándar varía entre el 10 % y el 20 % del promedio; y margen de error de 0,03 (d = 0,03), asumiendo que el margen de error corresponde al 10 % de la desviación estándar. El total calculado correspondió a 145 pacientes.
La técnica muestral fue no aleatoria por casos consecutivos, empleando como marco muestral los pacientes atendidos en el servicio de Medicina Física y Rehabilitación, asumiendo que los pacientes atendidos en este servicio, de forma obligada, fueron valorados previamente por el servicio de Medicina Familiar, por lo tanto son reflejo del total de la población con diagnóstico de diabetes tipo 2 que solicita atención en Medicina Familiar por dolor periférico moderado.
Se identificó el tiempo de evolución de la diabetes y el tiempo de evolución del dolor neuropático medido en meses.
El perfil epidemiológico del dolor se evaluó con el cuestionario de dolor de McGill, instrumento multidimensional diseñado para medir el dolor crónico, comúnmente empleado para evaluar el dolor de origen oncológico o neuropático. Tiene alfa de Cronbach de 0,88 (16,17), y evalúa el dolor desde tres perspectivas: la intensidad total general, la intensidad total actual, y el índice de valoración total de dolor dividido en tres dimensiones (sensorial, afectiva y evolutiva), al interior de cada una de ellas conformada por subgrupos y estos por características.
1. Índice de valoración total. Medido en el rango de 0 a 14 (14 mayor índice de intensidad), puntaje obtenido de la suma de cada una de las tres dimensiones: sensorial (0 a 7 puntos), afectivo (0 a 6 puntos) y evolutivo (0 a 1 punto). El puntaje de cada dimensión se obtiene de acuerdo con la siguiente lógica:
a. Dimensión sensorial (puntuación mínima 0, puntuación máxima 7). Integrada por 7 subgrupos, se otorga un punto (1) cuando está presente una o más de las características del subgrupo:
i. Temporal I: pulsátil, latigazo o sacudida.
ii. Térmico I: frío, caliente o ardiente/quemante.
iii. Presión de constricción: opresivo, espasmo, agarrotado o pellizco.
iv. Presión puntiforme: entumecimiento, calambre o retorcijón.
v. Presión de tracción gravitativa: desgarro, pesado, tenso o tirante.
vi. Espacial: interno, profundo, irradiado, superficial, fijo o difuso.
vii. Viveza: corriente, adormecimiento, escozor, hormigueo, agujas o picor.
b. Dimensión afectiva (puntuación mínima 0, puntuación máxima 6). Integrada por 6 subgrupos, se otorga un punto (1) cuando está presente una o más de las características del subgrupo:
i. Autonómica/vegetativa: que sofoca o que irrita.
ii. Temor: temible, horrible o espantoso.
iii. Castigo: atormenta violenta o mortifica.
iv. Tensión/cansancio: extenuante, incapacitante o agotador.
v. Disgusto: consume, incomodo o irrita.
vi. Pena/ansiedad: obsesivo, desesperante, angustiante, agobiante o deprimente.
c. Dimensión evolutiva (puntuación mínima 0, puntuación máxima 1). Integrada por 1 subgrupo, se otorga un punto (1) cuando está presente una o más de las características del subgrupo:
i. Temporal II: momentáneo, intermitente, creciente, constante o persistente.
2. Intensidad total general. Medida en el rango de 0 a 10, empleando para ello la escala visual análoga de dolor (EVA). La calificación de 10 corresponde a la máxima intensidad de dolor.
3. Intensidad total actual. Se otorga puntuación en el rango de 1 a 5 de acuerdo con el siguiente criterio:
a. Leve: 1 punto.
b. Moderado: 2 puntos.
c. Intenso: 3 puntos.
d. Fuerte/extenuante: 4 puntos.
e. Insoportable: 5 puntos.
Las variables edad y tiempo de evolución de la diabetes se analizaron con promedios e intervalos de confianza para promedios; para la variable género se empleó porcentaje e intervalo de confianza para porcentaje; el índice de valoración total del dolor, las dimensión sensorial, afectiva y evolutiva, así como la intensidad general del dolor fueron analizados con porcentajes, promedios, intervalo de confianza para promedios y desviación estándar; los subgrupos y características de las dimensiones sensorial, afectiva y evolutiva se analizaron con porcentajes. Esta prueba también se empleó para analizar la intensidad total actual del dolor.
El proyecto se registró ante el Comité Local de Investigación y el Comité de Ética en Investigación institucional y se contó con el consentimiento informado de los pacientes evaluados; todos los pacientes recibieron tratamiento para el manejo de dolor en el servicio de Medicina Física y Rehabilitación.
RESULTADOS
El promedio de edad de la población estudiada es 52,63 años (IC 95 %; 51,65-53,60), predomina el género femenino 62,7 % (IC 95 %; 54,7-70,7) y el tiempo de evolución de la diabetes es 103,25 meses (IC 95 %; 96,85-109,66). El dolor neuropático se localiza en miembros inferiores, la evolución varía entre 6 y 14 meses y el tratamiento incluye carbamazepina o gabapentina.
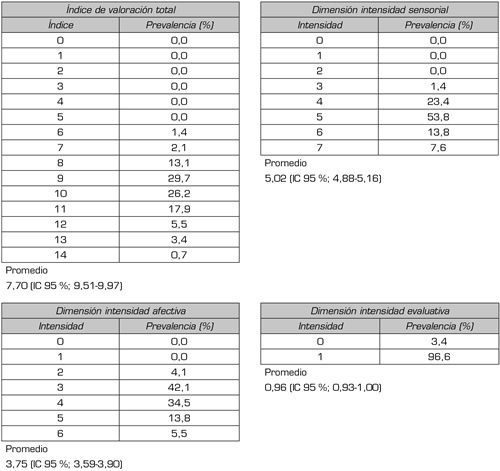
1. Índice de valoración total de dolor. En neuropatía periférica diabética moderada el promedio del índice de valoración total de dolor es 9,74 (IC 95 %; 9,51-9,97), desviación estándar 1,40, en la dimensión sensorial la calificación promedio es 5,02 (IC 95 %; 4,88-5,16), desviación estándar 0,84, en la dimensión afectiva 3,75 (IC 95 %; 3,59-3,90), desviación estándar 0,94 y en la dimensión evolutiva 0,96 (IC 95 %; 0,93-1,00), desviación estándar 0,18. En la Tabla I se presenta la prevalencia por índice de valoración total y sus dimensiones.
Tabla I. Prevalencia de intensidad de dolor neuropático periférico moderado diabético, según índice de valoración total, y dimensión sensorial, afectiva y evolutiva

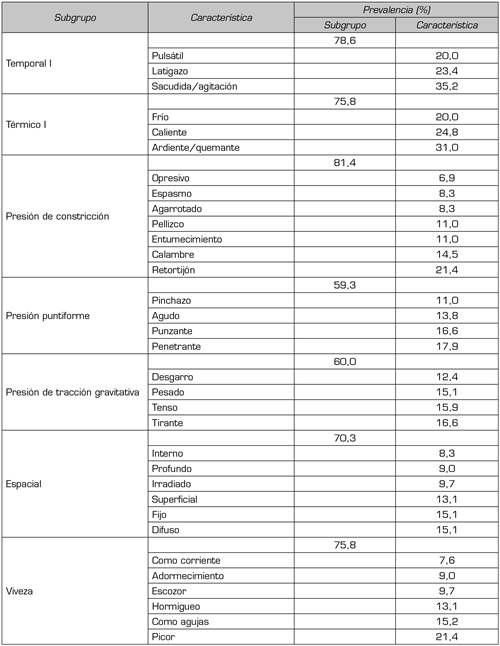
a. Dimensión sensorial. En la dimensión sensorial la prevalencia del subgrupo “presión de constricción” es del 81,4 %, y al interior de él predomina el dolor tipo “retorcijón” con un 21,4 %; la prevalencia del subgrupo “temporal I” es del 78,6 % y al interior predomina la característica “sacudida/agitación” con un 35,2 %. En la Tabla II se presenta para el índice de valoración total en la dimensión sensorial, la prevalencia por subgrupo y característica.
Tabla II. Índice de valoración total, dimensión sensorial, prevalencia del subgrupo y de la característica
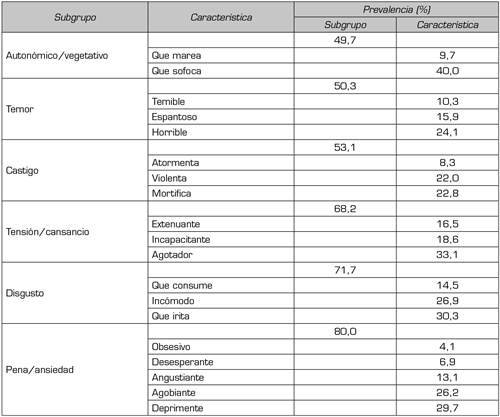
b. Dimensión afectiva. En la dimensión afectiva el subgrupo “pena/ansiedad” tiene la prevalencia más alta, 80 %, y al interior, la característica dolor “deprimente” tiene un 29,7 %; la prevalencia del subgrupo “disgusto” es del 71,7 % y al interior de él la característica “que irrita” tiene un 30,3 %. En la Tabla III se presenta para el índice de valoración total en la dimensión afectiva, la prevalencia por subgrupo y característica.
Tabla III. Índice de valoración total, dimensión afectiva, prevalencia del subgrupo y de la característica
c. Dimensión evolutiva. En la dimensión evolutiva la prevalencia del subgrupo “temporal II” es del 96,6 % y la característica predominante es “constante” con un 35,2 %. En la Tabla IV se presenta para el índice de valoración total en la dimensión evolutiva, la prevalencia por subgrupo y característica.
Tabla IV. Índice de valoración total, dimensión evolutiva, prevalencia del subgrupo y de la característica
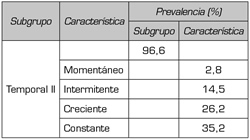
Tabla V. Intensidad total general del dolor en el paciente con neuropatía diabética moderada
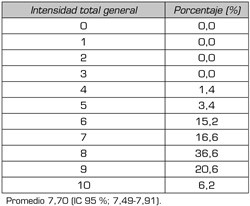
2. Intensidad total general. En la neuropatía periférica diabética moderada la intensidad total general de dolor se midió en la escala del 0 a 10, el promedio de dolor es 7,70 (IC 95 %; 7,49-7,91) y desviación estándar de 1,29; el 36,6 % se encuentra con intensidad de 8 y el 20,6 % con intensidad de 9. En la Tabla V observa la prevalencia en intensidad total general.
Tabla VI. Intensidad total actual del dolor en el paciente con neuropatía diabética moderada
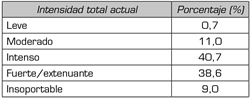
3. Intensidad total actual. En la intensidad total actual, el 40,7 % corresponde a “intenso”. En la Tabla VI se presenta la información.
DISCUSIÓN
Los métodos para la valoración de dolor incluyen escalas unidimensionales o multidimensionales que rebasan el subjetivismo del paciente y se constituyen como la mejor opción de medición. Estas escalas permiten una mejor comprensión del dolor y en consecuencia propician el adecuado manejo; aunado a ello, permiten identificar características específicas y propias del dolor (18).
En el estudio del dolor como experiencia subjetiva de difícil valoración, el abordaje multidimensional incluye los aspectos físicos, del comportamiento y biopsicosociales que contribuyen a la experiencia dolorosa, así como el impacto en la alteración de la actividad diaria; en ello radica la importancia de conocer las características del dolor (19).
Es verdad que en este trabajo el perfil epidemiológico del dolor de la neuropatía periférica diabética moderada se determinó utilizando el cuestionario de McGill. También es verdad que no es el único cuestionario que realiza el abordaje multidimensional, escenario que abre la posibilidad de identificar diferencias del perfil epidemiológico con el empleo de otros instrumentos, entre ellos el Cuestionario DN4 (DN4), la Escala de Dolor LANSS, el Cuestionario de Dolor Neuropático (NPQ) y PainDetect (19,20); pero independientemente del instrumento empleado para la valoración del dolor, lo que se revela es la complejidad de la valoración.
En torno al dolor neuropático de origen diabético, en la literatura se describe como dolor urente (sensación de quemadura), dinestésico continuo, de intensidad variable, con distribución localizada bilateral (en guante o calcetín) o con distribución generalizada (miembros superiores e inferiores, tórax, abdomen y rostro) (20), características que coinciden con lo presentado en este artículo. Aunado a ello, el dolor neuropático de origen diabético se define crónico en grado variable que transita entre moderado e intenso, y repercusión en la vida diaria del paciente (19,21), información que se presenta en este artículo y contribuye al estado del arte en torno al tema.
En la dimensión sensorial subgrupo temporal I, la característica con la prevalencia más alta correspondió a sacudida agitación (mioclónica), al respecto la explicación involucra el daño a nivel de las fibras mielinizadas (Aδ) o fibras gruesas (encargadas de sensibilidad vibratoria, presión, propiocepción, reflejos osteotendinosos e impulsos motores). Al comparar la prevalencia con lo reportado en la literatura la diferencia se hace evidente, lo publicado señala que la principal alteración en la neuropatía periférica o distal, corresponde a la disminución de la sensibilidad térmica-dolorosa (20,21,22), es decir, fibras finas o no mielinizadas (tipo C) (20).
La prevalencia de la característica ardiente/quemante, reflejo de la alteración de la sensibilidad térmica secundaria a daño de las fibras no mielinizadas, se ha descrito en la neuropatía periférica diabética y coincide con lo publicado (20,22).
En la dimensión psíquica o afectiva-emocional, el dolor neuropático genera dos tipos de sentimientos, el de repulsión y rechazo, y el sentimiento relacionado con conductas emocionales de frustración, ansiedad y depresión (19,21), características descritas en este artículo al identificarlo como dolor sofocante, agotador, irritante y deprimente, escenario que impacta negativamente en la calidad de vida del paciente con neuropatía periférica de origen diabético.
En la intensidad evolutiva el dolor constante destacó; en torno a él se puede señalar que es el resultado de la hiperactividad de nocirreceptores, que a su vez producen cambios en el asta posterior de la médula espinal, contribuyendo así en el proceso de sensibilización y mantenimiento de dolor, mecanismo que se ha demostrado responsable del dolor crónico neuropático (23,24), planteamiento que coincide con el tiempo de evolución del diagnóstico de diabetes tipo 2 de la población estudiada en esta investigación (25).
Es verdad que el perfil de dolor neuropático se ha descrito con anterioridad, descripción que involucra edad, sexo y origen (22); en este trabajo se continúa en esa línea, pero aunado a las características señaladas, se incluyen características epidemiológicas específicas del dolor neuropático, en particular de origen diabético.
En conclusión, el perfil epidemiológico del dolor secundario a neuropatía periférica diabética moderada es de intensidad elevada, quemante, penetrante, tirante fijo o difuso, acompañado de picor generalmente constante, con repercusión emocional negativa, entre ellas sentimiento de ansiedad, secundario a dolor deprimente, agotador, sofocante y mortificante.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA