doi.org/10.20986/resed.2022.4030/2022
ARTÍCULO
CANNABIS MEDICINAL EN EL TRATAMIENTO DEL DOLOR CRÓNICO VISCERAL
MEDICAL CANNABIS TREATMENT IN PATIENTS WITH VISCERAL CHRONIC PAIN
R. Abalo Delgado1
J. de Santiago Moraga2
1Área de Farmacología y Nutrición y Bromatología. Departamento de Ciencias Básicas de la Salud. Universidad Rey Juan Carlos (URJC). Alcorcón. Grupo de Investigación de Alto Rendimiento en Fisiopatología y Farmacología del Sistema Digestivo (NeuGut-URJC). Alcorcón. Unidad Asociada I+D+i del Instituto de Química Médica (IQM). Consejo Superior de Investigaciones Científicas (CSIC). Madrid. Grupo de Trabajo de Ciencias Básicas en Dolor y Analgesia de la Sociedad Española del Dolor (SED) Madrid. Grupo de Trabajo de Cannabinoides de la Sociedad Española del Dolor. Madrid, España
2Departamento de Anestesiología y Unidad del Dolor. Hospital Quironsalud Tenerife. Grupo de Trabajo de Cannabinoides de la Sociedad Española del Dolor. Madrid, España
RESUMEN
El dolor visceral crónico es muy frecuente e incapacitante. El dolor visceral secundario crónico debe distinguirse de los estados de dolor visceral primario crónico, que se consideran enfermedades por derecho propio. El dolor visceral crónico primario es una categoría del dolor de tipo nociplástico, que se caracteriza por una nocicepción alterada sin evidencia clara de daño tisular real o potencial.
El manejo del dolor visceral crónico primario es un desafío, ya sea por falta de eficacia farmacológica o por intolerancia de los efectos secundarios. En este contexto, el tratamiento con cannabinoides puede ser una alternativa útil en estos pacientes.
En esta revisión, tras explicar brevemente los mecanismos fisiopatológicos implicados en el dolor visceral crónico y su relación con el sistema endocannabinoide, revisaremos la evidencia actual sobre la utilización de cannabinoides en el tratamiento del dolor crónico visceral.
Palabras clave: Cannabis medicinal, dolor crónico, dolor visceral, evidencia
ABSTRACT
Chronic visceral pain is very common and disabling. Chronic secondary visceral pain must be distinguished from chronic primary visceral pain states that are considered diseases in their own right. Primary chronic visceral pain is a category of nociplastic-like pain, characterized by impaired nociception without clear evidence of actual or potential tissue damage. Management of primary chronic visceral pain is challenging, either due to lack of pharmacological efficacy or intolerance to side effects. In this context, treatment with cannabinoids can be a useful alternative in these patients.
In this review, after briefly explaining the pathophysiological mechanisms involved in chronic visceral pain and its relationship with the endocannabinoid system, we will show the current evidence on the use of cannabinoids in the treatment of chronic visceral pain.
Key words: Medical cannabis, chronic pain, visceral pain, evidence
Correspondencia: Raquel Abalo Delgado
raquel.abalo@urjc.es
INTRODUCCIÓN
El dolor crónico visceral es muy prevalente. Este se puede dividir, según su etiología, en orgánico o funcional. El dolor visceral crónico primario, o funcional, es el dolor sin evidencia de anomalía anatómica, inflamatoria, metabólica o neoplásica. El dolor visceral crónico primario es una categoría de dolor de tipo nociplástico (1). El dolor nociplástico se debe a una nocicepción alterada, sin evidencia clara de daño tisular real o potencial (2).
El manejo de estas afecciones de dolor crónico primario es un desafío, y los medicamentos actuales brindan en su mayoría solo un alivio modesto (3). El tratamiento con gabapentinoides, antidepresivos tricíclicos e inhibidores selectivos de la recaptación de serotonina debe titularse para evitar efectos adversos intolerables, y debe individualizarse debido a las importantes diferencias interindividuales (3). Es en este contexto en el que los medicamentos a base de cannabis pueden tener su sitio para el tratamiento del dolor visceral crónico refractario (2).
En esta revisión describiremos primero sucintamente las características básicas del dolor visceral y el papel del cannabis medicinal en este contexto. En segundo lugar, revisaremos la evidencia sobre la utilización del cannabis medicinal en el tratamiento del dolor crónico visceral.
CARACTERÍSTICAS DEL DOLOR VISCERAL
El dolor visceral se define como el tipo de dolor que se origina en los órganos internos, dentro de las cavidades abdominal y pélvica, además de la cabeza y la región del cuello (4,5). El dolor visceral es una causa frecuente de consulta y atención médica, sea por un proceso agudo, como angina de pecho, úlcera de estómago, apendicitis o cólicos biliares o nefríticos, o asociado a trastornos crónicos, sean estos de tipo funcional (sin evidencia clara de base orgánica que pueda explicar el trastorno), inflamatorio o, incluso, canceroso. Además, puede generarse también, directa o indirectamente, por tratamientos médicos, como la cirugía, la radioterapia o la quimioterapia (4).
Como se resume en la Tabla 1, el dolor visceral presenta una serie de características anatómicas y funcionales diferenciales que conviene recordar para establecer un manejo adecuado (4). Esencialmente, el dolor visceral es difícil de localizar de manera precisa, se acompaña frecuentemente de dolor referido a estructuras somáticas, produce respuestas motoras inespecíficas (regionales o de todo el organismo), así como respuestas autonómicas y afectivas intensas, por lo que se puede acompañar de ansiedad y depresión, o verse reforzado (o incluso provocado) por la presencia de estas condiciones psicológicas adversas. De hecho, aunque algunos tipos de dolor funcional podrían ser la “secuela” de una infección o inflamación previa en la víscera (habrían sido “orgánicos” en origen); otros parecen derivar de factores como el estrés (6), que parece producir una modulación epigenética de la nocicepción visceral (7).
Tabla I. Características anatómicas y funcionales del dolor visceral (4)

*Ver Figuras 1 y 2 para completar información.
ASIC3: canal iónico sensible a ácido, tipo 3. CGRP: péptido relacionado con el gen de la calcitonina. GI: gastrointestinal. GRD: ganglios de las raíces dorsales. Na: canales de sodio. SNA: sistema nervioso autónomo. SNC: sistema nervioso central. TRPV1, receptor vanilloide de tipo 1.
En lo que se refiere al sistema nervioso autónomo (SNA) (Figura 1) conviene recordar que el sistema nervioso simpático (SNS) moviliza al organismo para responder a situaciones de “lucha o huida” y se activa, por ejemplo, cuando se produce estrés ortostático, cambios de temperatura, hipoglucemia, hemorragias, ejercicio físico o determinadas emociones. En cambio, el sistema nervioso parasimpático (SNPS) es el que está activado en condiciones de reposo, favoreciendo la digestión, la diuresis y la defecación. Una tercera división del SNA es el sistema nervioso entérico (SNE), que reside en la pared del tracto gastrointestinal y controla la digestión. Las funciones del SNA están bajo la influencia de diversos centros encefálicos (Tabla 2) (8). En líneas generales, se puede decir que la activación simpática induce, facilita o potencia el dolor crónico, mientras que el SNPS parece tener efectos inhibidores del dolor y antinflamatorios (8,9). La relación, bidireccional, del SNE con el sistema nervioso central (SNC) es lo que se conoce como eje intestino-cerebro, y los trastornos funcionales digestivos, en los que el dolor visceral es un síntoma cardinal, se consideran trastornos de este eje (10).
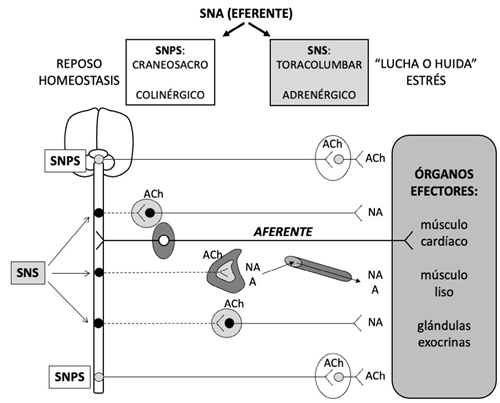
Fig. 1. Representación anatómica del sistema nervioso autónomo (SNA). Las vías eferentes del SNA están formadas por dos neuronas, una que parte del sistema nervioso central (SNC) y hace sinapsis en un ganglio intermedio, y otra que parte de dicho ganglio y llega hasta el órgano efector. Se diferencian en: su origen anatómico en el SNC, localización del ganglio intermedio en el que hace sinapsis la neurona preganglionar (y, por tanto, longitud de ambas neuronas), y el neurotransmisor que liberan en la sinapsis con el órgano efector. El sistema nervioso parasimpático (SNPS) es también conocido como craneosacro (la neurona preganglionar, muy larga, parte de los núcleos III, VII, IX y X del encéfalo y segmentos S2-S4 de la médula espinal), o colinérgico (libera acetilcolina, ACh) y sus ganglios se sitúan muy cerca del órgano efector, incluso en su pared. El sistema nervioso simpático (SNS) se conoce también como toracolumbar (la neurona preganglionar, mucho más corta que la del SNPS, parte de los segmentos T1-L2 de la médula espinal) o adrenérgico (libera noradrenalina, NA, salvo en las glándulas sudoríparas, en que libera ACh); los ganglios del SNS están relativamente cerca de la médula espinal (ganglios prevertebrales y/o paravertebrales o cadena simpática); la médula adrenal (glándula endocrina que funciona como un ganglio modificado del SNS), que, además de NA, también libera adrenalina (A) a la sangre, también forma parte del SNS. Las vías aferentes del SNA recogen la información desde el órgano efector y la envían al SNC, acompañando a las vías eferentes; están formadas por una sola neurona, y su soma está situado en un ganglio relativamente cercano a la estructura del SNC correspondiente (Figura 2). El SNPS está encargado de mantener la homeostasis de las vísceras y su actividad predomina en situaciones de reposo. El SNS, en cambio, se activa en situaciones de “lucha o huida” (estrés, en sentido amplio del término).
Tabla II. Control central de las funciones del SNA (8)
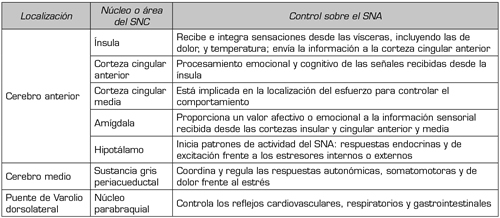
SNA: sistema nervioso autónomo. SNC: sistema nervioso central.
El dolor visceral ocasionado en una víscera concreta puede sensibilizar otras estructuras viscerales y también las somáticas, del mismo segmento metamérico. En grandes líneas, se puede producir una hipersensibilización visceral por sensibilización de las aferentes sensoriales primarias que inervan las vísceras, por hiperexcitabilidad de las neuronas ascendentes espinales (sensibilización central), que reciben la información sensorial de las aferentes viscerales y la transmiten a centros superiores, o por la desregulación de las vías descendentes que modulan la transmisión nociceptiva espinal (4,8).
Todas estas características se pueden observar también en animales de experimentación, en los que se realiza la evaluación preclínica de nuevas estrategias de tratamiento (4,11,12). Los estudios preclínicos han empleado diferentes métodos para evaluar nuevas estrategias para paliar el dolor visceral (Tabla 3). El primero es un método que produce un dolor visceral agudo inespecífico, y se emplea para una identificación rápida de nuevos fármacos con capacidad analgésica. Se trata del test del ácido acético o test de las contorsiones (en inglés, writhing test), en el que la inyección intraperitoneal de ácido acético diluido (aunque también se pueden usar otros agentes) ocasiona una irritación aguda de la cavidad peritoneal que, debido a la consiguiente liberación de prostaglandinas y de citoquinas proinflamatorias, se traduce en un comportamiento alterado (hiperextensión del abdomen y de las patas traseras) del animal (generalmente ratón), fácilmente cuantificable.
Los demás métodos tratan de simular tipos de dolor visceral específicos, generalmente, mediante la estimulación directa de la víscera de interés, como los diferentes órganos gastrointestinales, genitourinarios, el páncreas o el corazón. Los estímulos que se emplean en este caso son muy variados (isquemia, estimulación química irritativa o inflamatoria, distensión mecánica de órganos huecos, infección o parasitosis, estrés…) y se pueden aplicar de manera única o combinada (Tabla 3). Mención aparte merecen los modelos de endometriosis (12), en los que se implanta tejido uterino en la cavidad abdominal/pélvica o en otras localizaciones (músculo gastrocnemio, por ejemplo), y de calculosis, en el que se instila cemento dental en el uréter y se deja que fragüe en él para ocasionar piedras artificiales y mimetizar dolores cólicos que, a veces, se combinan en el mismo animal con endometriosis experimental (26). En todos estos modelos de dolor “específico”, se pueden valorar muchos tipos de respuestas distintas (4,11,12): cambios en el comportamiento del animal (espontáneo o en respuesta a estímulos específicos), reactividad muscular, cambios en la función cardiovascular, en la temperatura o en la frecuencia respiratoria, modificaciones en la actividad electrofisiológica de las neuronas periféricas o centrales implicadas en la transmisión del dolor, activación de regiones cerebrales específicas mediante técnicas inmunohistoquímicas (c-fos) o imagen biomédica (micro-PET), etc. Por supuesto, además de estos estudios funcionales, en los que se pueden aplicar fármacos para determinar los mecanismos implicados en las distintas respuestas de dolor, se pueden obtener muestras de plasma/suero y tisulares para su análisis mediante técnicas de anatomía patológica, inmunohistoquímica, bioquímica y biomolecular, que ayuden a dilucidar dichos mecanismos.
Tabla III. Principales modelos preclínicos de dolor visceral (4,11)
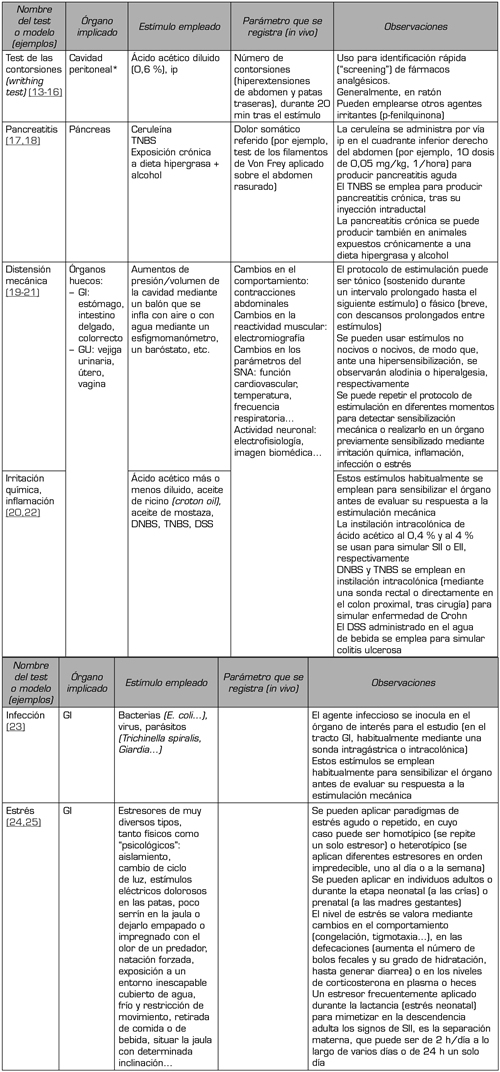
*El dolor generado en el test de las contorsiones es relativamente inespecífico y agudo, y, aunque muchos autores lo consideran dolor visceral, se suele emplear en la búsqueda de nuevos analgésicos, independientemente de su uso final (dolor somático o visceral).
DNBS: ácido dinitrobenceno sulfónico. DSS: sulfato de dextrano sódico. EII: enfermedad inflamatoria intestinal. GI: gastrointestinal. GU: Genitourinario. Ip: intraperitoneal. SII: síndrome de intestino irritable. SNA: sistema nervioso autónomo. TNBS: ácido trinitrobenceno sulfónico.
Idealmente, en estos modelos, las nuevas estrategias de tratamiento deberían ser eficaces para aliviar y/o prevenir las respuestas de dolor, y seguras (sin efectos adversos), del mismo modo que se espera lo sean, si progresan hacia estudios clínicos, en el humano. Además, sea cual sea la víscera en la que se origina el dolor, es importante tener en cuenta que cualquier estrategia de tratamiento del dolor visceral debería ser capaz de preservar la función de la víscera (o, idealmente, normalizarla, en caso de que el proceso patológico causante del dolor la hubiera afectado). Esto no es siempre posible, debido a los efectos colaterales que cualquier estrategia terapéutica puede ocasionar. De hecho, el uso de fármacos analgésicos típicos, como los antinflamatorios no esteroideos (AINE) o los opioides, deriva frecuentemente en la aparición de alteraciones en la función y/o la integridad de algunas vísceras, como los órganos del tracto gastrointestinal, lo cual limita su utilidad clínica y justifica y alienta la búsqueda de alternativas, entre ellas, los cannabinoides y el cannabis medicinal. En todo caso, dado el importante impacto del dolor visceral en la calidad de vida de los pacientes, incluso si sirven “únicamente” para aumentar la eficacia y seguridad de estos fármacos tradicionales, por su uso en combinación, la investigación en estas nuevas alternativas ya merece la pena.
CANNABINOIDES Y DOLOR VISCERAL
Una premisa previa importante para entender los estudios funcionales preclínicos y clínicos es el marco anatómico. La distribución de los componentes (receptores, ligandos, enzimas de síntesis y metabólicas…) del sistema cannabinoide endógeno (SCE) en los órganos viscerales y en las vías implicadas en la transmisión del dolor visceral fue descrita ya tempranamente mediante ensayos de unión a receptor, autorradiografía, inmunocitoquímica e hibridación in situ (4,27). Además de los componentes del SCE “canónico”, el endocannabinoidoma o SCE “expandido” incluye otros receptores y ligandos relacionados, cuya expresión también se ha descrito en distintas vísceras (como el tracto gastrointestinal (28)).
En general, la activación de los receptores CB1 y CB2 (representados en la Figura 2 a lo largo de las vías de dolor visceral (4,29)) produce efectos antinociceptivos en distintos modelos preclínicos de dolor visceral (ver ejemplos en la Tabla 3). Por otra parte, el receptor TRPV1 está implicado en la sensibilización mecánica e inflamatoria de vísceras huecas, como el colon (19,22,23). Sin embargo, la participación de otros componentes del endocannabidioma en el desarrollo y/o transmisión del dolor visceral no está tan claramente establecida.
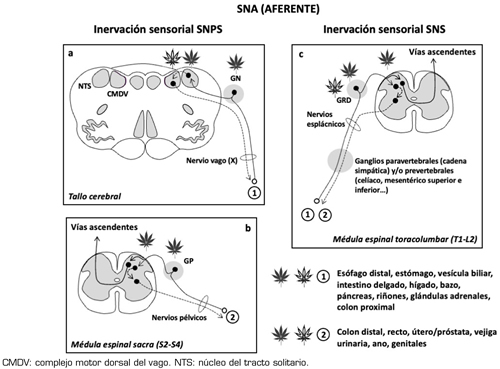
Fig. 2. Representación de las vías de dolor visceral y situación de los receptores cannabinoides CB1 y CB2 en las distintas estructuras nerviosas y viscerales implicadas. Las vías del dolor visceral forman parte de las aferencias sensoriales del sistema nervioso autónomo (SNA). Como corresponde a su paralelo eferente, las aferentes del sistema nervioso parasimpático (SNPS) se subdividen anatómicamente en dos partes, en función de las vísceras que inervan (señaladas en la imagen como 1 y 2), y llevan la información al sistema nervioso central (SNC) a través de: a) los nervios craneales (en la imagen está representado el nervio vago, X; las aferentes sensoriales vagales tienen su soma en el ganglio nodoso [GN] y llevan la información a núcleos del tallo cerebral); b) los nervios pélvicos (las aferentes sensoriales pélvicas tienen su soma en los ganglios pélvicos, GP, y llevan la información al asta dorsal de la médula espinal sacra). En condiciones normales, las aferentes del SNPS llevan información fisiológica, y solo contribuyen a la sensación dolorosa ante estímulos muy intensos o cuando las vísceras están hipersensibilizadas. En c se representan las vías aferentes del SNS, que llevan la información sensorial, a través de los nervios esplácnicos, hasta el asta dorsal de la médula espinal toracolumbar. Las aferentes del SNS tienen su soma en los ganglios de las raíces dorsales (GRD) de la médula espinal y pueden transmitir información dolorosa visceral de cualquier intensidad. La información sensorial que llega a cualquier segmento de la médula espinal (toracolumbar o sacro) se transmite hasta el encéfalo a través de las vías ascendentes del dolor. Las hojas de cannabis representan los receptores CB1 (negra) y CB2 (blanca), en el tracto gastrointestinal; aunque en condiciones basales, los niveles de expresión de los receptores CB2 pueden ser bajos o muy bajos en el tracto gastrointestinal, pueden aumentar mucho en condiciones de inflamación o de estrés y facilitar un efecto antinociceptivo de este receptor, por ejemplo, en los GRD.
Factores como el sexo (30), la edad (31,32), o la carga genética (polimorfismos genéticos (33,34)) pueden tener una influencia importante en la distribución y la actividad de los componentes del endocannabinoidoma en los individuos, pero esta no se ha estudiado en profundidad, ni en animales ni en humanos, especialmente en lo que se refiere al dolor visceral. Además, el endocannabinoidoma es muy dinámico, y la expresión de sus componentes en los distintos órganos se modifica en respuesta a distintas circunstancias. La inflamación es una de las causas que más alteran esta expresión (27,29,35), pero también lo hace el estrés (24,36) o las variaciones en la microbiota intestinal (37). Por ejemplo, la expresión del receptor CB2 y la liberación de endocannabinoides aumentan mucho en el intestino inflamado, y se ha propuesto que este receptor es clave en los mecanismos de “freno” y reparación del proceso inflamatorio, así como el alivio de sus síntomas, incluyendo el dolor visceral, dado que también se expresa en las vías del dolor (29) (Figura 2). En definitiva, los cambios fisiopatológicos en la expresión de los componentes del endocannabinoidoma deben tenerse en cuenta a la hora de desarrollar cualquier nueva estrategia de tratamiento, de acuerdo con los principios de la medicina personalizada.
EVIDENCIA CLÍNICA
Material y métodos
Hemos realizado una búsqueda desde enero de 2017 a agosto de 2022 en Pubmed, Ovid y Google Scholar, utilizando las palabras clave “chronic pain”, “visceral pain”, “chronic pelvic pain”, “irritable bowel syndrome”, “endometriosis”, “inflammatory bowel disease”, junto con las palabras clave “cannabis”, “medical cannabis” y “cannabis-based medicines”.
Resultados
En general ha habido un extenso estudio preclínico de los efectos de los cannabinoides sobre el dolor crónico visceral (se mencionan algunos ejemplos en la Tabla 3), pero el estudio clínico sigue siendo limitado. Hay muchos informes de estudios observacionales, informes anecdóticos e incluso revisiones sistemáticas, pero muy pocos ensayos clínicos aleatorizados.
El dolor visceral crónico se clasifica según su etiopatogenia en dolor crónico visceral primario o funcional y en secundario u orgánico (Tabla 4) (38). El dolor crónico visceral secundario se clasifica según el mecanismo etiopatogénico en: 1) inflamación persistente; 2) mecanismo vascular; y 3) factores mecánicos; y se subdivide según la región anatómica afectada en 4 áreas: cabeza o región del cuello, región torácica, región abdominal y región pélvica (5). Entre las causas más frecuentes de dolor visceral crónico secundario que suelen recibir tratamiento con cannabinoides se encuentran, entre otras, la endometriosis, la cistitis intersticial, la enfermedad inflamatoria intestinal y la patología oncológica abdominal. El dolor visceral crónico secundario de origen oncológico será tratado en esta monografía en el artículo titulado “Cannabis medicinal y dolor oncológico”.
Tabla IV. Clasificación del dolor visceral crónico primario o funcional (38)
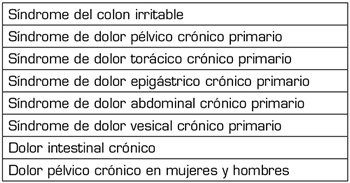
Dolor visceral crónico primario
Síndrome del colon irritable
El síndrome del colon irritable (SCI) es un trastorno gastrointestinal funcional que se caracteriza por dolor, distensión abdominal y anomalías en el hábito intestinal. Su prevalencia mundial es de alrededor del 10 %, siendo uno de los trastornos gastrointestinales más comunes. Su fisiopatología es diversa y variable, e incluye alteraciones en las interacciones intestino-SNC (es un trastorno del eje intestino-cerebro (10), como se ha mencionado más arriba), alteración de la motilidad y de la secreción, hipersensibilidad visceral, aumento de la permeabilidad intestinal, activación inmunitaria y cambios en la microbiota intestinal. Estos síntomas, sus comorbilidades (alrededor del 80 % de los pacientes desarrollan patología psiquiátrica), sumado a que los tratamientos disponibles a menudo son insatisfactorios, producen un gran deterioro en la calidad de vida de estos pacientes (39).
La investigación preclínica, junto con estudios observacionales, sugiere que el sistema endocannabinoide podría ofrecer dianas de tratamiento. En un estudio se utilizó el cannabidiol (CBD) para evaluar el efecto sobre el dolor abdominal y el bienestar en un ensayo clínico aleatorizado en 32 mujeres con SCI (40). No se encontraron diferencias estadísticas entre el CBD y el placebo a nivel de grupo, aunque las respuestas individuales fueron muy variables. En vista de la gran variación en los síntomas del SCI y también de la variación de las respuestas individuales, los autores sugieren cambios en la metodología (diseño más personalizado).
En otro estudio se evaluó el impacto del consumo de cannabis en la duración de la estancia hospitalaria y la utilización de recursos en pacientes con SCI. Para ello, se utilizó una base de datos de pacientes hospitalizados a nivel nacional (Healthcare Cost and Utilization Project Nationwide Inpatient Sample database), de 2010 a 2014 para todos los pacientes, con un diagnóstico de alta de SCI (41). Los consumidores de cannabis (n = 246) frente a los no consumidores (n = 9147) tenían menos probabilidades de someterse a lo siguiente: endoscopia digestiva alta (17,9 % frente a 26,1 %; adjusted odds ratio [aOR]: 0,51 [0,36-0,73]; p < 0,001) y endoscopia digestiva baja (21,1 % vs. 28,7 %; aOR: 0,54 [0,39-0,75]; p < 0,001). La estancia hospitalaria fue más corta para los consumidores de cannabis (2,8 días frente a 3,6 días; p = 0,004) y los costes hospitalarios totales fueron menores (20 388 USD frente a 23 624 USD). Se concluyó que la utilización de cannabis medicinal pudo disminuir la utilización de la atención médica hospitalaria en pacientes con SCI.
Por lo tanto, los datos existentes hasta la fecha son mínimos para poder realizar cualquier recomendación en relación con la utilización de medicamentos a base de cannabis para el tratamiento del dolor asociado con el SCI.
Dolor pélvico crónico primario en mujeres y hombres
El dolor pélvico crónico primario es muy prevalente, afectando hasta al 15 % de las mujeres. El útero presenta gran cantidad de receptores de cannabinoides, sin embargo, no existen ensayos clínicos aleatorizados sobre el uso de cannabinoides para el tratamiento del dolor pélvico crónico en mujeres. En un estudio observacional en 113 mujeres con dolor pélvico, perineal, dispareunia y endometriosis, 26 pacientes (23 %) utilizaron cannabis medicinal al menos una vez a la semana (42). La mayoría de las usuarias informaron una mejoría de los síntomas, incluido dolor, espasmos musculares, ansiedad, depresión, trastornos del sueño, libido e irritabilidad, aunque el 84 % presentó efectos secundarios.
Se ha planteado la hipótesis de que los cannabinoides reducen la excitabilidad de los aferentes del tracto urinario, así como de las neuronas nociceptoras (3). En un ensayo clínico reciente en hombres adultos con prostatitis crónica/síndrome de dolor pélvico crónico, que examinaba el efecto de un inhibidor de la amida hidrolasa de ácidos grasos (FAAH) con actividad periférica, después de la aleatorización de 239 pacientes, el medicamento no mostró eficacia sobre el dolor, pero se hipotetizó que, al mejorar los resultados de la micción, la inhibición de FAAH podría atenuar los síntomas del tracto urinario inferior en este grupo de pacientes (43).
Por lo tanto, actualmente, falta evidencia a nivel clínico sobre el efecto de los cannabinoides en el dolor pélvico crónico primario en hombres y mujeres.
Dolor vesical primario crónico, epigástrico, torácico y abdominal
No se encontraron estudios para estos síndromes de dolor visceral.
Dolor visceral crónico secundario u orgánico
Cistitis intersticial/Síndrome de vejiga dolorosa
Existen estudios a nivel experimental básico que demuestran las propiedades antinflamatorias y protectoras de los cannabinoides en el tejido urológico, así como la capacidad de estos de atenuar la hiperalgesia y revertir la hiperreflexia de la vejiga inflamada (44,45).
Los resultados de estos estudios sugieren que tanto los receptores CB1 como los CB2 son potenciales dianas terapéuticas. Sin embargo, todos estos resultados prometedores se encuentran aún en fase preclínica.
Endometriosis
En una revisión sistemática de 59 estudios sobre el tema se acabaron incluyendo para revisión completa un total de 16. La prevalencia del consumo de cannabis osciló entre el 13 % y el 27 %. La mayoría de las mujeres ingirieron o inhalaron cannabis y consumieron cannabis varias veces por semana, con un consumo semanal total de THC y CBD de hasta 70 mg y 2000 mg, respectivamente. Los seis estudios de cohortes prospectivos y un ensayo clínico aleatorizado de medicamentos combinados con palmitoiletanolamida (PEA) (una amida de ácido graso que potencia los cannabinoides endógenos a través de diversos mecanismos, incluyendo la activación de los receptores intranucleares PPAR-a, los receptores acoplados a proteínas G de tipo cannabinoide GPR55 y los canales TRPV1 (46)) informaron una disminución significativa del dolor, siendo la disminución promedio del dolor después de 3 meses de tratamiento de 3,35 ± 1,39 (47). Por otra parte, en un metanálisis realizado para demostrar la eficacia clínica de la combinación de palmitoiletanolamida-trans-polidatina (PEA) micronizada para reducir el dolor pélvico crónico endometriósico, se concluyó que la administración de PEA (400 mg/40 mg) dos veces al día durante tres meses proporcionaba una mejoría clínicamente relevante del dolor pélvico crónico y la dismenorrea, al tiempo que mejoraba la dispareunia (48).
Finalmente, en una revisión sobre el efecto de los cannabinoides (especialmente el CBD) en la endometriosis, se analizaron 264 artículos, incluyendo al final un total de 41. Los autores argumentaron que la mayor parte de la evidencia disponible proviene de estudios de laboratorio y que, en realidad, existen pocos ensayos clínicos que analicen el efecto del cannabis o sus productos derivados en mujeres con endometriosis, siendo la mayoría estudios observacionales o en forma de encuestas. Concluyeron que, en la actualidad, los productos a base de cannabis en la endometriosis, solo se pueden recetar cuando se han agotado todas las demás opciones de tratamiento (49).
Enfermedad inflamatoria intestinal
El uso de cannabis o derivados del cannabis es común entre los pacientes con enfermedad inflamatoria intestinal (EII) para el alivio sintomático, a menudo específicamente para el alivio del dolor abdominal (50). Se ha demostrado que la utilización prolongada de cannabis en la EII producía una mejoría en los síntomas relacionados con la EII, una disminución del uso de medicamentos alternativos y un aumento de peso (51). Se utilizaron para ello dosis altas (CBD 200 mg/d). En un ensayo clínico controlado aleatorizado realizado en pacientes con colitis ulcerosa leve a moderada se utilizó aceite de CBD (50-250 mg dos veces al día), obteniendo una disminución del dolor abdominal (52).
En resumen, en la actualidad, los datos clínicos relacionados con el uso de cannabinoides en la EII son aún limitados. Sin embargo, los estudios actualmente disponibles demuestran mejoría en la percepción del dolor abdominal, pero no en la inflamación intestinal o en el curso de la enfermedad.
CONCLUSIÓN
El cannabis y sus derivados tienen un gran potencial terapéutico en el contexto del tratamiento del dolor visceral crónico. Un número cada vez mayor de pacientes tiene acceso al cannabis y a los medicamentos basados en cannabinoides, y es muy común que las personas aquejadas de dolor visceral crónico pregunten sobre la utilidad de estos tratamientos para controlar su enfermedad.
Existe una amplia variedad y cantidad de estudios en animales que han demostrado, no solo el impacto positivo que los cannabinoides pueden tener en este contexto, sino también la multitud de vías por las que los cannabinoides pueden actuar para inducir sus efectos analgésicos. Sin embargo, aún existen pocos ensayos clínicos en humanos, por lo que, en la actualidad, no existe evidencia para poder recomendar el tratamiento del dolor visceral crónico con cannabinoides.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FUENTES DE FINANCIACIÓN
La investigación de la Dra. Abalo está financiada por el Ministerio de Ciencia, Innovación y Universidades, España (PID2019-111510RB-I00), Universidad Rey Juan Carlos-Banco de Santander (Proyectos de Investigación COVID-19, convocatoria 2020) y la Asociación Española de Gastroenterología (Beca del Grupo de Trabajo de Neurogastroenterología y Motilidad AEG 2021).
BIBLIOGRAFÍA