NOTA CLÍNICA
DOI: 10.20986/resed.2020.3782/2019
Experiencia clínica con la implantación de un protocolo multidisciplinar de cefalea postpunción dural
Clinical experience with the implementation of a postdural puncture headache multidisciplinary protocol
M. B. Perdomo Perdomo1
E. M. Carrillo González1
S. Hernández González1
A. Rodríguez Chimeno1
E. Espinosa Domínguez1
1Servicio de Anestesiología y Reanimación, Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife, España
ABSTRACT
Introduction: Postdural puncture headache (PDPH) is a lumbar puncture complication, this practice is used by several medical specialists for different purposes as well as the accidental dural puncture (ADP) in an epidural technique.
The objective of a PDPH multidisciplinary management protocol, is to diagnose and early treat any patient with PDPH, no matter which speciality observes this complication.
Material and methods: A descriptive, observational and retrospective study in which the clinical helpfulness of a PDPH management protocol is analyzed between September 2014 and December 2017.
Results: A total of 60 consult visits were analyzed. An incidence of ADP of 0.61 % was observed, 80 % of them developed PDPH, and out of these, 72 % required an epidural blood patching. Re-entry due to clinical worsening was required by 8 patients on telephone follow-up, who were initially discharged with mild PDPH, and one of them was diagnosed with abducens nerve palsy. Medical specialities with patients in this protocol were: anesthesiologists, obstetricians, emergency physicians and neurologists.
Conclusions: The protocol allowed a diagnosis and early treatment of the PDPH as well as supplied the patient’s follow-up after his hospital discharge.
Keywords: Postdural puncture headache, epidural blood patch, protocol, accidental dural puncture, lumbar puncture
RESUMEN
Introducción: La cefalea postpunción dural (CPPD) es una complicación de la punción lumbar, práctica utilizada por múltiples especialistas con diferentes fines, y de la punción dural accidental (PDA) en una técnica epidural.
El objetivo de disponer de un protocolo de manejo de la CPPD, con implicación multidisciplinar, es diagnosticar y tratar precozmente a cualquier paciente con CPPD, independientemente de qué especialidad observe la complicación.
Material y métodos: Estudio descriptivo, observacional y retrospectivo en el que se analiza la utilidad clínica de un protocolo de manejo de CPPD entre septiembre de 2014 y diciembre de 2017.
Resultados: Se analizaron un total de 60 interconsultas. Se observó una incidencia de PDA del 0,61 %, el 80 % de las PDA desarrollaron CPPD, y de ellas, el 72 % precisó un parche hemático. Con el seguimiento telefónico, 8 pacientes que inicialmente fueron dados de alta con CPPD leve precisaron reingreso por empeoramiento clínico, y se diagnosticó un paciente con parálisis del VI par craneal. Los especialistas que incluyeron pacientes en el protocolo fueron: anestesiólogos, obstetras, médicos de urgencias y neurólogos.
Conclusiones: El protocolo permitió un diagnóstico y tratamiento precoz de la CPPD, además de un seguimiento tras el alta hospitalaria del paciente.
Palabras clave: Cefalea pospunción dural, parche hemático epidural, protocolo, punción dural accidental, punción lumbar
Correspondencia: María Beatriz Perdomo Perdomo
mbperper@gmail.com
Recibido: 09-11-2019
Aceptado: 13-01-2020
INTRODUCCIÓN
La cefalea postpunción dural (CPPD) es una complicación que puede producirse tras una punción lumbar (PL) o una punción dural accidental (PDA) en una epidural. La PL es un procedimiento invasivo utilizado por diversos especialistas, con fines diagnósticos, terapéuticos o anestésicos. La CPPD puede ocurrir hasta en el 40 % de las PL si se utilizan agujas traumáticas tipo Quincke (1), y entre el 76-85 % tras una PDA (2). El riesgo de CPPD en la PL puede reducirse drásticamente mediante el uso de agujas atraumáticas con punta de lápiz, como la Sprotte o Whitacre (1). Una reciente revisión sistemática que compara los resultados tras una PL con agujas convencionales y atraumáticas encontró una reducción de la incidencia de la CPPD del 11 % al 4,2 % respectivamente, también una disminución en la necesidad de analgésicos y de la realización de parches hemáticos epidurales (PHE) (3). Sin embargo, muchos médicos no están familiarizados con las agujas atraumáticas, y solo el 2 % de los clínicos las utiliza (1). En contraposición, los anestesiólogos suelen utilizarlas ().
La III edición de la Clasificación internacional de las cefaleas define la CPPD como aquella cefalea que se manifiesta dentro de los 5 días siguientes a una PL, causada por pérdida de líquido cefalorraquídeo a través de la punción dural. Suele acompañarse de rigidez cervical y/o síntomas auditivos subjetivos. Se resuelve de manera espontánea en un plazo de 2 semanas, o después del sellado de la fuga con un parche epidural autólogo (4). Puede ser incapacitante, lo que provoca que los pacientes vuelvan al hospital. Es líder en causas de demandas judiciales en obstetricia, lo que refleja una experiencia decepcionante de las pacientes por no haber recibido un seguimiento apropiado (5). En el 28 % de las CPPD se podrían cronificar hasta 12-24 meses después del parto (6,7).
La prevención de la CPPD debe ser el objetivo principal de los clínicos. De hecho, la atención adecuada a los factores relacionados con el procedimiento puede reducir su incidencia (2).
A pesar de que las medidas conservadoras profilácticas tras una PDA no tienen demostrada una alta eficacia, se debe esperar 24-48 h, ya que más del 85 % de las CPPD se resuelven en este tiempo (2). El reposo absoluto no se recomienda debido al alto riesgo de trombosis (8), aunque es inevitable en pacientes con cefalea moderada-severa por la incapacidad que propicia la CPPD. Tampoco se recomienda la hidratación suplementaria (8), y el uso de cafeína es muy discutible (2,6). Una vez instaurada la CPPD, el único tratamiento que ha mostrado ser efectivo es el PHE (2,7). Puede ser necesario repetirlo hasta en el 10 % de los casos (7). En caso de precisar un tercer PHE, estaría justificada la realización previa de una resonancia magnética para descartar otras causas (9).
Solo el 14 % de los hospitales en Norteamérica tienen protocolos de manejo de la CPPD en comparación con el 85 % en Reino Unido (10). Esta protocolización en unidades inglesas ha mejorado los resultados en la prevención y el tratamiento de las CPPD (10). Se desconoce el porcentaje de hospitales españoles que cuentan con este tipo de protocolo.
El objetivo de disponer de un protocolo de manejo de la CPPD es buscar estrategias de garantía de calidad efectivas en la disminución de la variabilidad de la práctica clínica y obtener los mejores resultados con el menor coste posible. La Unidad de Dolor Agudo (UDA) de nuestro hospital ha desarrollado y aplicado un algoritmo dinámico, y ajustado a la bibliografía actual, dirigido a todo el personal médico, para lograr un diagnóstico y tratamiento precoz de la CPPD. Dicho protocolo proporciona una atención integral, ya que hace un seguimiento hospitalario y ambulatorio vía telefónica.
MATERIAL Y MÉTODOS
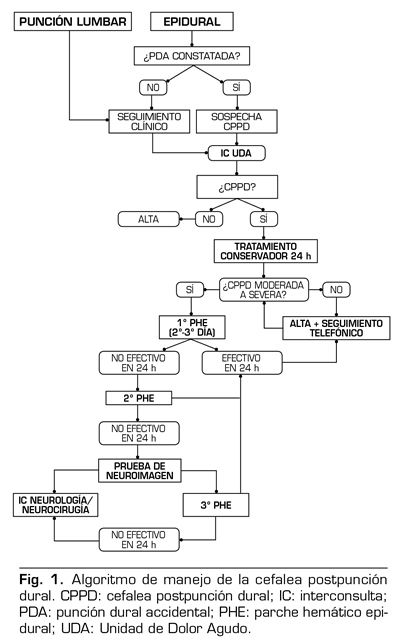
En septiembre de 2014 se implantó el protocolo de actuación de la CPPD en nuestro hospital (Figura 1), en la UDA del Servicio de Anestesiología. Se ha realizado un estudio descriptivo, observacional y retrospectivo de todas las interconsultas (IC) recibidas entre septiembre de 2014 y diciembre de 2017 y se ha analizado la utilidad clínica de la aplicación de dicho protocolo.
La IC informática a la UDA puede realizarla el anestesiólogo implicado en una PDA de una epidural, o el especialista que hace el seguimiento de un paciente, e identifica una cefalea típica: tras una PL o después de analgesia epidural en la que no se constató PDA.

Para valorar la gravedad de la cefalea seguimos la clasificación de Corbey y cols. (11) en función de la intensidad del dolor, según la escala visual analógica (EVA), y de la impotencia funcional. Cefalea leve es la que no interfiere con la actividad normal con una EVA de 1 a 3, moderada la que precisa de reposo en cama periódicamente con una EVA de 4 a 7 y severa aquella que impide a la paciente que se siente o coma con una EVA de 8 a 10. A todos los pacientes con el diagnóstico de CPPD se les pauta tratamiento conservador durante 24-48 h, con abundante ingesta hídrica, cafeína y un primer escalón analgésico, y se les reevalúa cada 24 horas:
Si CPPD leve: alta y seguimiento telefónico durante una semana. El paciente se va con un informe añadido al informe de alta de hospitalización de obstetricia, con un primer escalón analgésico, además de recomendarse abundante hidratación oral y la ingesta de líquidos ricos en cafeína.
Si CPPD moderada-severa: se informa a la paciente la posibilidad de tratamiento invasivo (PHE). Si la paciente decide no realizar el PHE, se da alta de hospitalización con seguimiento telefónico de UDA e informe. Para la realización del PHE se localiza el espacio epidural en condiciones de asepsia con una aguja Tuohy 18 o 17 G y se inyectan de 15-20 ml de sangre autóloga o hasta que la paciente refiriera dolor lumbar o de miembros inferiores. Tras realizar el PHE, se recomienda reposo en decúbito supino durante 4 h. El paciente puede tener una mejoría total, parcial o no mejoría de su CPPD.
?Si mejoría completa: alta y seguimiento tele-fónico.
?Si no mejoría o mejoría parcial: a las 24-48 h, se repite un segundo PHE, manteniendo posteriormente 24 h de reposo. Si no mejora con el segundo PHE, se realiza prueba de neuroimagen para diagnóstico diferencial. En base a su resultado, se hace IC a neurología o neurocirugía o se plantea la realización de un tercer PHE.
RESULTADOS
Los datos obtenidos, durante el periodo de estudio, se explicitan en la Tabla I.
De las 6562 epidurales obstétricas, realizadas en el periodo de estudio, con agujas Tuohy 18 G y 17 G, se observó una incidencia de PDA del 0,61 %. En las pacientes obstétricas, el 80 % de las PDA desarrollaron CPPD, y de ellas, el 72 % requirió un primer PHE y el 12,5 % un segundo PHE. La intensidad de la CPPD tras PDA por epidural fue de moderada a severa en 16 pacientes, 15 de ellas se trataron con PHE, rechazando una el tratamiento invasivo. Se catalogó inicialmente como cefalea leve a 16 pacientes que se dieron de alta hospitalaria con seguimiento telefónico por la UDA, 8 de ellas reingresaron por evolucionar a cefalea moderada-severa, necesitando todas PHE.
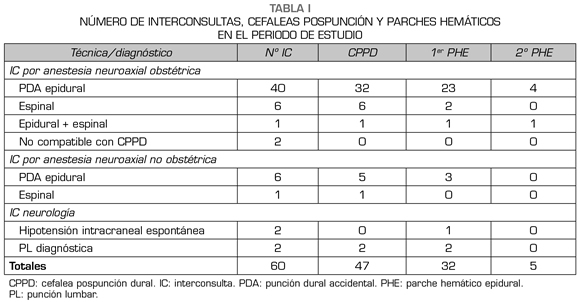
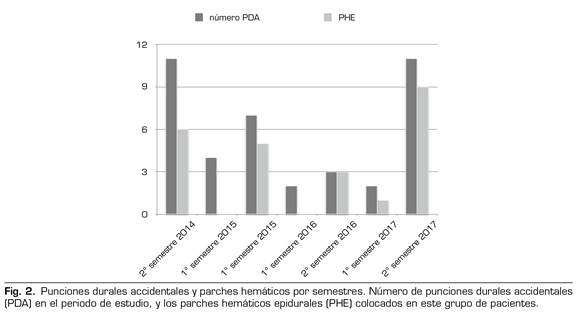
Se observó un pico de incidencia mayor entre septiembre y diciembre de 2017, con 11 CPPD, requiriendo 8 un primer PHE y 2 un segundo (Figura 2).
Hubo 6 CPPD por anestesia espinal en pacientes obstétricas, precisando 2 de ellas PHE. Una de estas pacientes provenía de otro hospital, siendo el servicio de urgencias el consultor. Las anestesias subaracnoideas en nuestro hospital se realizaron con agujas Sprotte 25 G.
En cuanto a las IC por anestesia neuroaxial en pacientes no obstétricas: de las PDA por epidural el 83 % desarrollaron CPPD, y de ellas, el 60 % necesitaron PHE. En este grupo, se identificó telefónicamente a un paciente que desarrolló una parálisis del VI par craneal. Se hizo un manejo multidisciplinar junto al Servicio de Neurología. Solo hubo una IC por CPPD tras espinal y no requirió tratamiento invasivo.
El Servicio de Neurología hizo 4 IC, de ellas las 2 por PL diagnóstica, requiriendo ambas PHE, y 2 por síndrome de hipotensión intracraneal espontáneo. En estos últimos casos, a pesar de no tener el diagnóstico de CPPD, los neurólogos hicieron la IC dentro de nuestro protocolo por cefalea persistente a pesar de tratamiento médico, tras su valoración por nuestro servicio; uno de los pacientes llevaba un año con cefalea incapacitante, se sopesaron riesgo-beneficios y se le realizó un PHE que fue efectivo.
DISCUSIÓN
Durante la realización de una técnica epidural obstétrica, la frecuencia de PDA varía según los estudios entre el 0,7 y 1,5 % (6), y desarrollan CPPD hasta el 76-85 % (2). En nuestra muestra, la incidencia de PDA fue del 0,61 %, y de ellas, el 80 % de las pacientes desarrollaron CPPD.
Desde el punto de vista de la gestión, el 50 % de las pacientes que se fueron de alta hospitalaria con el diagnóstico de CPPD leve por PDA en epidural obstétrica, se resolvieron sin tratamiento invasivo, permitiendo el ahorro del coste que supondría alargar la estancia hospitalaria de estas pacientes. Gracias al seguimiento telefónico, se detectó precozmente la evolución tórpida del otro 50 % hacia CPPD moderada-severa, gestionando su reingreso y tratamiento con PHE rápidamente. La ausencia de seguimiento telefónico de estas pacientes podría haber implicado una cronificación de la patología, con la posibilidad de generar mayores costes, tanto directos como indirectos.
La inclusión de los ginecólogos en el protocolo permitió recuperar a 13 pacientes con CPPD tras analgesia epidural con PDA inadvertida y 4 tras anestesia espinal. El Servicio de Urgencias, a su vez, identificó una CPPD obstétrica procedente de otro hospital, y la incluyó directamente en el protocolo, pudiéndose tratar adecuadamente.
El éxito del PHE en la literatura oscila entre el 61-98 % (2), encontrándose nuestra muestra en el 87,5 %. El segundo PHE fue efectivo en el 100 % de los casos. No observamos complicaciones derivadas de la realización del PHE. No fue necesaria la realización de un tercer PHE en ningún caso.
Se detectó un repunte de la incidencia de CPPD por PDA en el último semestre de 2017, y, además, un alto porcentaje de esos pacientes requirieron PHE y su repetición. Analizando los diferentes factores, el cambio del material para epidural, con una aguja Tuohy 17 G (previa 18 G) con catéter anillado, además de la necesidad de una curva de aprendizaje del nuevo material, pudieron ser las causas más determinantes.
El número de IC por anestesia neuroaxial en pacientes no obstétricas fue inferior. Lo importante en este grupo fue la identificación a través del seguimiento telefónico de una parálisis del VI par craneal (12). El paciente desarrolló una CPPD leve no limitante por una PDA al colocar un catéter epidural para el manejo analgésico en el postoperatorio de una laparotomía y resección ileal. Ya de alta domiciliaria, en el seguimiento telefónico, el paciente refiere clínica de diplopía, le recomendamos que acudiese al Servicio de Urgencias, donde confirmamos la parálisis del VI par craneal junto con los Servicios de Oftalmología y de Neurología. Se solicitó una resonancia magnética, donde apareció un compromiso del espacio de la arteria basilar sobre la emergencia del VI par derecho. Se decidió tratamiento conservador con oclusión ocular y vitaminas B y C, por haber transcurrido más de 24 h desde la aparición de la diplopía, y ya no existir en ese momento clínica de cefalea pospunción dural. Esto podría implicar que ya no hubiese hipotensión licuoral, pero sí daño neural, no aportando beneficios la realización del PHE. Se recupera completamente a los 4 meses. Actualmente, el paciente está en seguimiento por neurología, ya que la compresión neurovascular puede producir una parálisis del VI par craneal recurrente, y precisar de una descompresión vascular. Sin el atendimiento adecuado por parte de la UDA no se hubiese diagnosticado y tratado precozmente a este paciente que se fue de alta domiciliaria con una CPPD leve.
Las IC del Servicio de Neurología fueron casos de cefaleas severas, por lo que un alto porcentaje requirió PHE. Sería precisa la integración de todas las CPPD tratadas por el Servicio de Neurología para unificar criterios, no solo los casos graves.
Entre las limitaciones destacamos que se ha realizado en un solo hospital, además de ser un estudio retrospectivo con pocos pacientes.
CONCLUSIONES
Este protocolo ha resultado útil para el diagnóstico precoz de la CPPD. Gracias a la implicación de diferentes especialidades, se han podido incluir pacientes que, de otro modo, no podrían haber tenido una atención adecuada. El seguimiento telefónico ha contribuido, además, al reingreso precoz de pacientes que se encontraban de alta domiciliaria, proporcionando un atendimiento continuado sin necesidad de alargar la estancia hospitalaria, y gestionando el reingreso y tratamiento de los casos con evolución tórpida. Todo ello, sin necesitad de acudir a atención primaria, lo que evita sobrecarga asistencial y mejora la accesibilidad del paciente al sistema. Además, nos ha permitido analizar nuestros datos, que son equiparables a la bibliografía consultada. También pudimos, identificar un pico en la incidencia de CPPD por PDA y analizar las posibles causas.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FUENTES DE FINANCIACIÓN
El presente artículo no ha recibido ninguna beca específica de agencias de los sectores público, comercial, o sin ánimo de lucro.
BIBLIOGRAFÍA