DOI: 10.20986/resed.2021.3938/2021
EDITORIAL
DOLOR NEUROPÁTICO: UN RETO CONSTANTE
NEUROPATHIC PAIN: A CONSTANT CHALLENGE
J. Vidal Fuentes1
1Unidad del Dolor Reumático. Hospital Universitario de Guadalajara. Profesor clínico Universidad de Alcalá de Henares. Madrid, España
En este número de Revista de la Sociedad Española del Dolor se publican 3 artículos en relación con el dolor neuropático (DN), siendo una oportunidad para la reflexión.
El dolor neuropático es ampliamente reconocido como uno de los síndromes de dolor más difíciles de manejar y los resultados a menudo no son satisfactorios.
Esto se debe, en parte, a que su identificación puede pasar desapercibida requiriendo una estrategia diagnóstica específica, dadas sus características clínicas (síntomas y signos) (1). Además, existe evidencia de un uso subóptimo de fármacos en el tratamiento del dolor neuropático, al menos en determinados ámbitos (2).
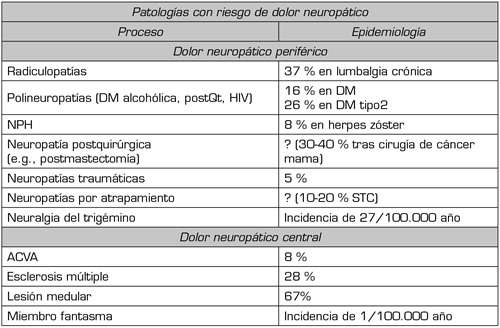
Es probable que la mejor estimación de la prevalencia poblacional de dolor con características neuropáticas se sitúe entre el 6,9 y el 10 % (3). La incidencia de DN asociado con una condición específica representa para la neuralgia postherpética un 3,9-42,0/100.000 personas/año, para la neuropatía periférica diabética dolorosa un 15,3-72,3/100.000 personas/año, y para la neuralgia del trigémino un 12,6-28,9/100.000 personas/año. La Tabla I recoge datos de las patologías con riesgo de desarrollar DN, con elevada prevalencia muchas de ellas (4).
Tabla I. Patologías con riesgo de desarrollar DN, prevalencia o incidencia en cada una de ellas

En las unidades del dolor en España, el estudio Pandhora, realizado en 111 unidades, puso de manifiesto que el 16 % de los procesos son de DN específico, y el otro 14 % son cuadros de dolor mixto (5).
Cuando se analiza la severidad clínica del dolor neuropático en comparación con el dolor nociceptivo, se observa que la intensidad media del dolor es dos puntos superior en la escala numérica, 7 frente a 5 según estudios poblacionales, y en datos de España el 61 % de los pacientes tienen dolor severo y una importante repercusión en la calidad de vida (SF 12: componente físico 37 ± 5,9, componente mental 46 ± 8,1) (6,7).
Dada la importancia del diagnóstico, se indica que los cuestionarios DN4 y de LANSS son herramientas útiles por su sensibilidad y especificidad y valor predictivo positivo (DN4: sensibilidad del 83 %, especificidad del 90 %; LANSS: sensibilidad del 85 %, especificidad del 80 %), ambos validados en español (8,9).
Un aspecto de consideración en los estudios realizados en DN, como los que se publican en RESED, es la utilización más adecuada de los instrumentos de evaluación y de los dominios a evaluar, entre los que se reconocen la intensidad dolor, la función, la calidad de vida, la satisfacción con el tratamiento, el estado emocional y las reacciones adversas.
El grupo IMMPACT da unas recomendaciones claras para estudios clínicos en dolor crónico y neuropático (10). El dolor en escala numérica y el Brief Pain Inventory son dos instrumentos de referencia en la evaluación del dolor, aunque el cuestionario de dolor de McGill (MPQ), diseñado en 1975 por Melzack y Casey, ha sido el cuestionario más ampliamente utilizado para valoración del dolor crónico. Trata de medir las tres dimensiones del dolor (sensorial, afectiva y cognitiva), cuantifica y valora los aspectos sensoriales del dolor y es útil para diferenciar patrones de dolor, pero su complejidad de cumplimentación lo ha relegado a estudios concretos (11). Solo hay un cuestionario que puede evaluar cuantitativamente las características del dolor neuropático: el Neuropathic Pain Symptom Inventory (NPSI) (12).
Una de las cuestiones más complejas en relación con el DN es su abordaje terapéutico, dada la combinación de mecanismos fisiopatológicos implicados tanto a nivel periférico como central, que incluyen la neoexpresión de canales del Na+ con la aparición de descargas ectópicas, la neoformación axonal, el aumento de la actividad simpática, la neuroplasticidad neuronal, la pérdida de mecanismos inhibitorios o la implicación de microglía (4,13).
Aunque disponemos de múltiples fármacos con diferentes mecanismos de acción a nivel del sistema nervioso central y periférico (Figura 1), muy pocos tienen indicación específica y las evidencias de eficacia y seguridad son poco rentables. Solo un 33-50 % de los pacientes se benefician de una primera línea de tratamiento (14). Los datos del metanálisis publicado por el Grupo NeuPSIG refieren que los NNT combinados fueron 6,4 (IC del 95 %: 5,2-8,4) para los inhibidores de la recaptación de serotonina-noradrenalina, principalmente duloxetina; 7,7 (6,5,6,7,8,9,4) para pregabalina; 7,2 (5,9-9,21) para la gabapentina; y 10,6 (7,4-19,0) para parches de capsaicina de alta concentración. Los NNT fueron más bajos para los antidepresivos tricíclicos, opioides fuertes, tramadol y toxina botulínica A, e indeterminado para los parches de lidocaína (15).
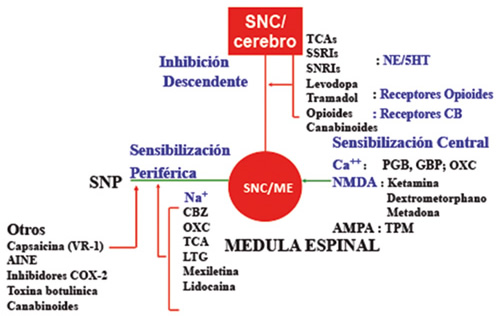
Fig. 1. Mecanismos de DN y acción de los fármacos analgésicos
El estudio del Grupo de Dolor neuropático de la SED pone de manifiesto los hábitos y la dificultad de los médicos del dolor en el tratamiento del DN. El tratamiento combinado parece una de las estrategias más habituales, y la evidencia limitada también apoya la misma (16,17).
Por último, el ganglio de la raíz dorsal (GRD) parece ser una diana terapéutica de potencial elevado, al menos en dolor neuropático periférico. El núcleo de la neurona nociceptiva, situado a este nivel, es el responsable de codificar las múltiples señales neurotransmisoras y proalgóngenas, y de la cascada de activación molecular que se produce en el dolor (13). Los estudios de histoquímica revelan que en el GRD se producen múltiples citocinas y quimiocinas implicadas en los fenómenos de sensibilización periférica y central (18). La neuroestimulación de GRD parece un procedimiento intervencionista de efectividad elevada, y nos debe hacer pensar en el lugar que estas técnicas deben ocupar en la escalera de tratamiento del DN. Se hace necesario establecer unas guías claras de diagnóstico, evaluación y tratamiento del DN y elaborar un Treat to Target , como en otras patologías.
Correspondencia: Javier Vidal Fuentes
javier.vidal@sedolor.es
BIBLIOGRAFÍA