DOI: 10.20986/resed.2021.3891/2021
ARTÍCULO ESPECIAL
NUEVOS OPIOIDES CON DIFERENTE MECANISMO DE ACCIÓN INTRACELULAR; ¿UNA NUEVA VENTANA TERAPÉUTICA SE ABRE ANTE NOSOTROS?
NEW OPIOIDS WITH DIFFERENT INTRACELLULAR MECHANISM OF ACTION; IS A NEW THERAPEUTIC WINDOW OPENING UP?
B. Mugabure Bujedo1,2
S. González Santos1
1Departamento de Anestesiología, Cuidados Críticos y Medicina del Dolor. Hospital Universitario de Donostia. San Sebastián, España
2Unidad del dolor, Manejo del dolor agudo y crónico. Hospital Universitario de Donostia. San Sebastián, España
RESUMEN
Los opioides son los fármacos más utilizados para el tratamiento del dolor agudo. Los opioides convencionales se utilizan ampliamente para el tratamiento del dolor agudo en el entorno postoperatorio. Sin embargo, una de las principales preocupaciones de dichos opioides es su ventana terapéutica, es decir, el intervalo entre las dosis que producen el efecto terapéutico deseado (analgesia) y las dosis que producen efectos adversos relacionados con los opioides (EARO) no deseados. Los opioides convencionales sobre receptores μ tienen una ventana terapéutica estrecha, en parte debido a su mecanismo de acción (MdA): se unen a los receptores μ y activan de forma no selectiva 2 vías de señalización intracelular, lo que provoca analgesia y EARO. Esta revisión explora el potencial clínico de los ligandos de los receptores μ con señalización diferencial. Los agentes con un MdA de "señalización diferencial" representan un enfoque innovador que puede mejorar la ventana terapéutica. Estos agentes modulan la actividad de los receptores μ para activar selectivamente las vías de señalización asociadas a la analgesia, al tiempo que limitan la actividad en las vías de señalización posteriores que conducen a los EARO. Por todo ello, la señalización diferencial puede satisfacer una necesidad no cubierta en el tratamiento del dolor postoperatorio. Oliceridina es un claro exponente de esta nueva generación.
Palabras clave: Opioides, mecanismo de acción, señalización diferencial, oliceridina
ABSTRACT
Opioids are the most drugs used for the management of acute pain. Conventional opioids are widely used for acute pain management in the postoperative setting. However, a primary concern with conventional opioids is their therapeutic window, the range between doses that produce the desired therapeutic effect (analgesia) and doses that produce unwanted opioid-related adverse events (ORAEs). Conventional μ receptor opioids have a narrow therapeutic window in part because of their mechanism of action (MoA): they bind to μ receptors and non-selectively activate two intracellular signaling pathways, leading to analgesia and to ORAEs. This review explores the clinical potential of μ receptor ligands with differential signaling. Agents with a ’differential signaling” MoA represent an innovative approach that may enhance the therapeutic window. These agents modulate μ receptor activity to selectively engage downstream signaling pathways associated with analgesia while limiting activity in downstream signaling pathways that lead to ORAEs. Meanwhile, differential signaling may fulfill an unmet need in the management of postoperative pain. Oliceridine is a clear exponent of this new opioid generation.
Key words: Opioids, mechanism of action, differential signaling, oliceridine
Correspondencia: Borja Mugabure Bujedo
mugabure@yahoo.es
Recibido: 18-01-2021
Aceptado: 24-10-2021
INTRODUCCIÓN
Los opioides convencionales, como la morfina, la hidromorfona y el fentanilo, se utilizan ampliamente para el tratamiento del dolor agudo en el contexto postoperatorio. Estos agonistas opioides de los receptores μ son analgésicos eficaces para el dolor nociceptivo y se emplean ampliamente como parte del enfoque multimodal para el alivio del dolor agudo, en particular después de una intervención quirúrgica (1). Muchos años de investigación sobre los opioides han demostrado que los receptores μ proporcionan la mejor actividad antinociceptiva de todos los receptores opioides, pero que también se asocian con la mayor incidencia de tolerancia, dependencia, hiperalgesia y abuso (2). Aunque es vital para la eficacia analgésica, la actividad agonista en el receptor opioide μ también es una fuente de efectos adversos relacionados con los opioides (EARO) que limitan la dosis y que pueden incluir depresión respiratoria, efectos gastrointestinales (p. ej., náuseas, vómitos y estreñimiento), efectos en el sistema nervioso central (p. ej., sedación, mareos y somnolencia) y prurito (3,4,5,6). Los estudios han demostrado que los EARO suponen un mayor riesgo para la seguridad de los pacientes, una mayor duración de las estancias hospitalarias, un aumento de las tasas de rehospitalización y un mayor coste sociosanitario (7). Además, pueden conducir a la limitación de la dosis adecuada opioide prescrita para el paciente, lo que dificulta la eficacia de los propios analgésicos. El tratamiento inadecuado del dolor postoperatorio de los pacientes demuestra la necesidad de ajustar un tratamiento eficaz para los pacientes y, en parte, demuestra la necesidad de equilibrar la analgesia con opiáceos y fármacos no-opiáceos, denominada analgesia multimodal, para mejorar la analgesia y reducir el riesgo de EARO (8,9,10).
Los opioides más utilizados para el tratamiento del dolor actúan sobre los sistemas de receptores μ opioides. Además de los receptores μ, también se ha demostrado que los receptores opioides kappa y delta activan las vías inhibidoras del dolor en el sistema nervioso central. Sin embargo, hasta la fecha, la actividad mediada por los receptores kappa y delta no ha mostrado la eficacia analgésica rápida, profunda y sistémica de los agonistas μ opioides como la morfina (11). Esta revisión explora los recientes avances en el conocimiento de la farmacología, centrándose en el desarrollo y el potencial clínico de los ligandos del receptor μ con señalización diferencial. Los nuevos opioides con mecanismo de acción basados en la señalización diferencial, como oliceridina, abren una ventana terapéutica para explorar en el futuro inmediato y así mejorar nuestra práctica asistencial.
METODOLOGÍA DE BÚSQUEDA
Este estudio profundizó en las bases de la farmacocinética para optimizar la elección del analgésico opioide. Se realizó una búsqueda en PubMed utilizando el sitio web PubMed de la Biblioteca Nacional de Medicina (http://www.ncbi.nlm.nih.gov/PubMed) de los artículos publicados en inglés durante el periodo de 20 años de 2001 a 2021 sobre el tema. Dicha búsqueda mostró 586 artículos (el 21 de junio de 2021 a las 7:30 pm GMT) utilizando un criterio de inclusión de “opioids” & “differential signaling” & “oliceridine”, por separado y finalmente en combinación y dio como resultado 112 artículos.
Tras una exhaustiva selección, los resultados se redujeron a 78 con “oliceridine” como palabra clave principal. Los investigadores peinaron los 78 y se centraron en los artículos más relevantes, sacando conclusiones de estos trabajos publicados. Como resultado final, 30 fueron finalmente incluidos en la bibliografía, focalizándose en el uso de oliceridina. No está publicada ninguna revisión sistemática ni metanálisis y sí 20 artículos de revisión narrativa o de práctica clínica y únicamente se encontraron 5 ensayos clínicos aleatorizados en seres humanos, (2 en voluntarios sanos publicados en 2014 y 3 ensayos controlados en el ámbito hospitalario del tratamiento del dolor publicados en 2018-2019) (12,13,14) y finalmente otros 5 artículos de estudios preclínicos.
RESULTADOS Y DISCUSIÓN
Valoración de resultados de los ensayos clínicos sobre tratamiento del dolor
Solo se encontraron ensayos clínicos controlados con oliceridina. Cabe señalar que gran parte de los datos de seguridad disponibles se obtuvieron a partir de estudios preclínicos, o de estudios clínicos que evaluaron los efectos adversos (EA) como resultados secundarios, con una escasez de estudios prospectivos que evaluaron el perfil de seguridad de la oliceridina como su resultado primario. Aunque se realizaron varios análisis post hoc sobre los datos agrupados de los ensayos APOLLO (12,13) y ATHENA (14), estos ensayos tenían limitaciones inherentes que pueden influir en la precisión y la generalización de los resultados agrupados. Por ejemplo, los ensayos APOLLO tenían diferentes criterios de inclusión del dolor (APOLLO-1: NRS ≥ 4 dentro de las 9 h posteriores a la interrupción de la anestesia regional; APOLLO-2 NRS ≥ 5 dentro de las 4 h posteriores a la cirugía), utilizaron diferentes técnicas anestésicas (APOLLO-1: anestesia regional; APOLLO-2: anestesia general), tuvieron diferentes periodos de tratamiento (APOLLO-1: 48 h; APOLLO-2: 24 h), y estaban compuestos predominantemente por mujeres (APOLLO-1: 85 %, APOLLO-2: 99 %) y caucásicos (APOLLO-1: 69 %; APOLLO-2: 64 %). Asimismo, el ensayo ATHENA fue un estudio de cohortes abierto sin un grupo de control concurrente. Por lo tanto, los análisis post hoc de estos estudios están limitados por la heterogeneidad en el diseño del estudio y la influencia de posibles factores de confusión. Además, la profilaxis antiemética se suprimió o no se estandarizó en esos estudios, lo que limita las conclusiones que podrían derivarse respecto a la aparición de náuseas y vómitos postoperatorios con oliceridina en comparación con otros opioides convencionales. Por lo tanto, las futuras investigaciones prospectivas deberán centrarse en confirmar si la oliceridina produce una mejora clínicamente significativa en el riesgo de desarrollar depresión respiratoria y complicaciones gastrointestinales en comparación con los opioides convencionales.
Además, la seguridad y la eficacia de la oliceridina deben investigarse en poblaciones obstétricas y pediátricas, ya que se considera que estos pacientes tienen un mayor riesgo de sufrir EARO. También debe delinearse el papel de la oliceridina en el contexto de los protocolos de recuperación mejorada después de la cirugía, especialmente porque un principio clave de recuperación mejorada después de la cirugía es el uso de analgesia multimodal para reducir la utilización de opioides y los EA relacionados. Sin embargo, en la actualidad, el uso de oliceridina con analgesia multimodal solo se evaluó en el ensayo ATHENA (14), y se necesitan más datos para garantizar la seguridad y eficacia de oliceridina cuando se utiliza junto con otros analgésicos como el paracetamol y los antinflamatorios no esteroideos.
Una importante limitación farmacológica de los opioides convencionales es la ventana terapéutica, es decir, el intervalo entre la dosis que produce el efecto terapéutico analgésico y la dosis en la que causan EA no deseados. Por ello, en la práctica clínica, la dosificación de estos fármacos puede que se restrinja debido a sus perfiles de efectos secundarios, lo que conlleva un dolor mal controlado. Notablemente, dicha ventana terapéutica es especialmente estrecha para ciertas poblaciones de riesgo incluyendo pacientes con obstrucción pulmonar crónica, insuficiencia renal, obesidad, apnea del sueño, así como ancianos y los pacientes pediátricos (6,7,8).
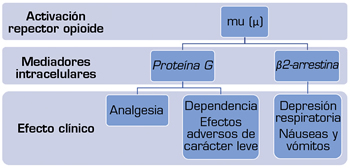
Los opioides convencionales se unen a los receptores μ de manera predominante y activan de forma no selectiva 2 vías de señalización intracelular. Dicha unión resulta en la activación de las vías de las proteínas G inhibidoras y de la β2-arrestina, lo que conduce a efectos farmacológicos tanto esperados como no deseados. La activación de la proteína G media la analgesia y otros efectos mediados a nivel central, mientras que el reclutamiento de β2-arrestina ha demostrado contribuir a la depresión respiratoria y a los efectos sobre el sistema gastrointestinal, así como a la inhibición de la retroalimentación de la analgesia mediada por la proteína G (15,16) (Figura 1). Los agentes con un mecanismo de acción de “señalización diferencial” representan un enfoque novedoso e innovador. Este hecho supone la activación selectiva de vías específicas, es decir, la modulación de la actividad del receptor μ para activar selectivamente las vías intracelulares asociadas con la analgesia, limitando al mismo tiempo la activación en sentido descendente de las vías de transducción de señales que conducen a los EA. Los trabajos recientes han llevado al descubrimiento de nuevas moléculas que aprovechan la señalización diferencial en el receptor μ con la esperanza de mejorar la ventana terapéutica. Entre ellas figuran la oliceridina (TRV 130), el PZM21, la seudoindoxil mitraginina, el TRV0109101 y el SR-17018 (17,18,19).

Fig. 1. Activación del receptor opioide mu (μ) y de las vías intracelulares tanto de la analgesia como de los efectos adversos (15,16).
Señalización convencional del receptor opioide
El receptor opioide μ (un receptor acoplado a proteínas G) es el principal objetivo de los analgésicos opioides. Los agonistas se unen al receptor μ y estabilizan las conformaciones que activan las proteínas G heterotriméricas, lo que conduce a la señalización del segundo mensajero, por ejemplo, el monofosfato de cicladenosina y a la activación de múltiples vías descendentes, incluidas las que dan lugar a la modulación del dolor. Los receptores activados también son sustratos para las quinasas de receptores acoplados a proteínas G. Después de la fosforilación, los receptores se unen a la β2-arrestina, que promueve distintos efectos descendentes (20). Este proceso desacopla eficazmente el receptor y las proteínas G (impidiendo así una mayor señalización), promueve la internalización del receptor e induce distintas cascadas de transducción de señales. Los opioides convencionales se unen a los receptores específicos y no son selectivos en su señalización intracelular descendente tras su unión. La unión de los opioides da lugar a la activación tanto de la proteína G como de la vía de la β2-arrestina, lo que origina efectos farmacológicos tanto deseados como no deseados. La señalización de la proteína G media la analgesia, mientras que se ha demostrado que el reclutamiento de la β2-arrestina contribuye a la depresión respiratoria y a los efectos gastrointestinales inducidos por los opiáceos, así como a la inhibición por retroalimentación de la analgesia mediada por la proteína G. Por ejemplo, los ratones que carecen de β2-arrestina presentaron una marcada atenuación de la supresión respiratoria y el estreñimiento agudo inducidos por la morfina (21). Por el contrario, la analgesia inducida por la morfina se potenciaba y prolongaba en estos ratones, incluyendo un desarrollo más lento de la tolerancia (22). Por lo tanto, una señalización descendente distinta que implique la activación de la señalización de la proteína G mientras se limita el reclutamiento de la β2-arrestina tiene el potencial de ampliar la ventana terapéutica de los opioides con respecto a importantes mejoras respiratorias y gastrointestinales (23).
Señalización diferencial
Dado el perfil de señalización descendente de los opioides convencionales, los agonistas que son específicos del receptor μ pero que muestran una señalización diferencial preferente hacia la señalización de la proteína G con efectos reducidos o incluso inhibitorios sobre la señalización de la β2-arrestina tienen una importante utilidad clínica potencial (15,16). La señalización diferencial en el receptor μ representa un enfoque novedoso e innovador para el tratamiento del dolor postoperatorio, con la oportunidad de modular la actividad del receptor μ para activar selectivamente las vías intracelulares descendentes asociadas a la analgesia (proteína G) frente a las asociadas a los EA (β2-arrestina). Se han adoptado varios enfoques para identificar los ligandos de los receptores μ que muestran una señalización selectiva, entre ellos los basados en la estructura, los derivados de productos naturales y la química medicinal empírica (17,18,19). Se cree que varios de estos compuestos tienen un potencial clínico directo o prepararán el camino para otros fármacos candidatos. Su desarrollo mejorará nuestro conocimiento y comprensión de la farmacología de los receptores μ, incluida la ventana terapéutica asociada con la señalización diferencial en los polimorfismos del receptor μ, ya que se ha comprobado la gran variabilidad interpersonal en la expresión genética de los diversos receptores opioides en voluntarios sanos (24). Oliceridina es el máximo exponente de este grupo.
Oliceridina
Entre los ligandos de señalización diferencial que se están desarrollando, solo la oliceridina ha llegado a los estudios clínicos. Los estudios publicados de fase 1 y 2 de la oliceridina han demostrado que la ventana terapéutica es más amplia en comparación con la morfina. La oliceridina presenta una eficacia de acoplamiento de la proteína G comparable a la de la morfina, pero aproximadamente solo el 14 % del reclutamiento vía β2-arrestina, y en relación con este último hecho, la oliceridina también exhibe una mínima internalización de los receptores (25). En estudios realizados en voluntarios sanos, la oliceridina demostró eficacia analgésica, pero causó menos disfunción gastrointestinal y depresión respiratoria que la morfina en dosis equianalgésicas (26,27). La oliceridina todavía no se ha investigado en una población de pacientes durante más de 48 h, pero los resultados en el dolor postoperatorio en fase 3 son prometedores (12,13,14) y ha sido aprobado por la Food and Drug Administration (FDA) norteamericana en agosto del 2020, para manejo del dolor agudo severo vía intravenosa (28).
Concretamente en un ensayo clínico sobre dolor postoperatorio tras abdominoplastia (13), los pacientes recibieron una dosis de carga de placebo, oliceridina (1,5 mg) o morfina (4 mg), seguida de dosis de demanda mediante analgesia controlada por el paciente (0,1; 0,35 o 0,5 mg de oliceridina; 1 mg de morfina o placebo) con un intervalo de bloqueo de 6 min. El criterio de valoración primario fue la proporción de personas que respondieron al tratamiento durante más de 24 h para los regímenes de oliceridina en comparación con el placebo. Los objetivos secundarios incluyeron una medida compuesta predefinida como el índice de seguridad respiratoria (ISR), que representa la duración acumulada de los eventos de depresión respiratoria y la proporción de personas que respondieron al tratamiento en comparación con la morfina. Un total de 401 pacientes fueron tratados con la medicación del estudio. Se observó una analgesia efectiva en todos los regímenes de oliceridina, con tasas de respuesta del 61,0; 76,3 y 70,0 % para los regímenes de 0,1; 0,35 y 0,5 mg, respectivamente, en comparación con el 45,7 % para el placebo (todos p < 0,05) y el 78,3 % para la morfina. Los regímenes de dosis de demanda de 0,35 y 0,5 mg de oliceridina fueron igual de analgésicos que la morfina mediante un análisis de no inferioridad. El ISR mostró un aumento dependiente de la dosis en los regímenes de oliceridina (media de horas [desviación estándar], 0,1 mg: 0,43 [1,56]; 0,35 mg: 1,48 [3,83]; 0,5 mg: 1,59 [4,13]; todas las comparaciones no fueron significativas a p > 0,05 vs. placebo: 0,60 [2,82]). La medida del ISR para la morfina fue de 1,72 (3,86) (p < 0,05 vs. placebo). Los eventos adversos gastrointestinales aumentaron de manera dependiente de la dosis, en los regímenes de dosis de demanda de oliceridina (0,1 mg: 49,4 %; 0,35 mg: 65,8 %; 0,5 mg: 78,8 %; frente a placebo: 47,0 %; y morfina: 79,3 %). En comparación con la morfina, la proporción de pacientes que experimentaban náuseas o vómitos era menor con los 2 regímenes de dosis equianalgésicas de 0,35 y 0,5 mg de oliceridina. Dado que el régimen de dosis baja de 0,1 mg de oliceridina fue superior al placebo pero no tan eficaz como el régimen de morfina, las comparaciones de seguridad con la morfina solo fueron pertinentes para los 2 grupos de dosis equianalgésicas de 0,35 y 0,5 mg, que mostraron un perfil favorable de seguridad y tolerabilidad en lo que respecta a los EA respiratorios y gastrointestinales. Estos hallazgos respaldan que la oliceridina puede proporcionar una nueva opción de tratamiento para los pacientes con dolor agudo de moderado a intenso en los casos en que se justifique el uso de un opioide por vía intravenosa.
El objetivo de otro estudio de fase 3, abierto y multicéntrico, fue evaluar la seguridad y la tolerabilidad de la oliceridina por vía intravenosa para el dolor agudo de moderado a severo en una amplia población de pacientes del mundo real, incluyendo a pacientes quirúrgicos postoperatorios y pacientes no quirúrgicos con condiciones médicas dolorosas (14). Los pacientes adultos y con una puntuación ≥ 4 en la escala visual numérica analgésica (EVN) de 11 puntos para la intensidad del dolor recibieron oliceridina por vía intravenosa en bolo o analgesia controlada por el paciente y se permitió la analgesia multimodal. La seguridad se evaluó mediante informes de EA, interrupciones del estudio, laboratorio clínico y medidas de signos vitales. Un total de 768 pacientes recibieron oliceridina. La edad media fue de 54,1 años, con un 32 % ≥ 65 años de edad. La mayoría de los pacientes eran mujeres (65 %) y caucásicos (78 %). Los pacientes quirúrgicos constituían la mayor parte de la población del estudio (94 %), siendo los más comunes los procedimientos ortopédicos (30 %), colorrectales (15 %) o ginecológicos (15 %). Se administró analgesia multimodal al 84 % de los pacientes. La oliceridina proporcionó una rápida reducción de la puntuación del dolor EVN en 2,2 ± 2,3 a los 30 min desde una puntuación de 6,3 ± 2,1 (al inicio) que se mantuvo hasta el final del tratamiento. No se notificaron muertes ni acontecimientos cardiorrespiratorios significativos. La incidencia de los EA que condujeron a la interrupción precoz y de los EA graves fue del 2 % y del 3 %, respectivamente. Los EA más frecuentes fueron náuseas (31 %), estreñimiento (11 %) y vómitos (10 %). La mayoría de los EA fueron de gravedad leve (37 %) o moderada (25 %) y se consideraron posible o probablemente relacionados con la oliceridina en el 33 % de los pacientes. La conclusión final fue que la oliceridina administrada por vía intravenosa para el tratamiento del dolor agudo de moderado a grave fue generalmente segura y bien tolerada en los pacientes estudiados.
En relación con la morfina, otro equipo analizó los resultados previos en voluntarios sanos (29). Se volvieron a analizar los datos de un ensayo anterior que comparaba los efectos respiratorios y analgésicos de la oliceridina y la morfina en voluntarios varones sanos (n = 30). Se realizó un análisis farmacocinético-farmacodinámico poblacional que sirvió de base para la construcción de las funciones de utilidad, que son funciones objetivas de la probabilidad de analgesia, P(analgesia), y de la probabilidad de depresión respiratoria, P(depresión respiratoria). La función de utilidad = P(analgesia ≥ 0,5)-P(depresión respiratoria ≥ 0,25), donde analgesia ≥ 0,5 es el aumento de la latencia de retirada de la mano en la prueba de presión en frío en al menos un 50 %, y depresión respiratoria ≥ 0,25 es la disminución de la respuesta ventilatoria hipercápnica en al menos un 25 %. Los valores registrados fueron la mediana ± el error estándar de la estimación. Los 2 fármacos fueron equianalgésicos con valores de potencia similares (oliceridina: 27,9 ± 4,9 ng/ml; morfina 34,3 ± 9,7 ng/ml; ratio de potencia, 0,81; IC 95 %, 0,39-1,56). Una reducción del 50 % de la respuesta ventilatoria hipercápnica por parte de la morfina se produjo a una concentración en el lugar de efecto de 33,7 ± 4,8 ng/ml, mientras que una reducción del 25 % por parte de la oliceridina se produjo a 27,4 ± 3,5 ng/ml (relación de potencia, 2,48; IC del 95 %, 1,65-3,72; p < 0,01). En el rango de concentración clínicamente relevante de 0-35 ng/ml, la función de utilidad de la oliceridina fue positiva, lo que indica que la probabilidad de analgesia supera la probabilidad de depresión respiratoria. Por el contrario, la función de la morfina fue negativa, lo cual revela una mayor probabilidad de depresión respiratoria que de analgesia. Estos datos indican un perfil de seguridad de oliceridina favorable respecto a la morfina cuando se considera la analgesia y la depresión respiratoria en el rango de concentración clínica.
CONCLUSIONES
Las terapias opioides convencionales no son selectivas en su señalización intracelular tras la unión a los receptores μ, activando tanto la proteína G como la señalización de la β2-arrestina. Este perfil de señalización se asocia con la analgesia; sin embargo, también da lugar a efectos adversos gastrointestinales y respiratorios que limitan la dosis. Por lo tanto, una necesidad clave no cubierta en el tratamiento del dolor agudo ha sido el desarrollo de nuevas terapias con una ventana terapéutica más amplia que los opioides convencionales. La modulación diferencial de las vías de señalización del receptor μ representa un enfoque novedoso para abordar esta necesidad no cubierta en el tratamiento del dolor postoperatorio agudo de moderado a severo.
La oliceridina es un modulador del complejo receptor mu-proteína G con señalización diferencial del receptor en comparación con los opioides convencionales y el único ejemplo de este enfoque en desarrollo clínico activo para el dolor. Los estudios clínicos han demostrado que la oliceridina ofrece un alivio del dolor rápido y clínicamente significativo en el contexto postoperatorio agudo. A dosis equianalgésicas con la morfina, la oliceridina mostró un mejor perfil de efectos secundarios, con una menor prevalencia de depresión respiratoria, náuseas y vómitos que la morfina; por tanto, gracias a su capacidad para limitar el reclutamiento de β-arrestina, la oliceridina puede demostrar una ventana terapéutica más amplia. En el contexto de un enfoque multimodal, la capacidad de ampliar la ventana terapéutica puede llevarnos a un avance significativo en el tratamiento del dolor agudo, mejorando la eficacia analgésica de los opioides y, al mismo tiempo, mejorando sustancialmente la eficacia de la morfina, reduciendo al mismo tiempo los EA (30).
Aunque la eficacia analgésica de la oliceridina se estableció en varios estudios clínicos, y está aprobada por la FDA para el tratamiento del dolor agudo de moderado a severo, se requieren más estudios prospectivos para comparar su perfil de EA con los opioides convencionales y evaluar la rentabilidad de su uso. Además, debe comprobarse su empleo en poblaciones obstétricas y pediátricas, y en el contexto de los protocolos de recuperación mejorada después de la cirugía.
CONFLICTOS DE INTERESES
Los autores declaran no presentar conflicto de intereses.
BIBLIOGRAFÍA