DOI: 10.20986/resed.2019.3715/2018
REVISIÓN
Revisión de los procedimientos intervencionistas neurolíticos en el dolor asociado al cáncer de páncreas. Propuesta de algoritmo
Neurolytic procedures for pancreatic cáncer pain: a systematic review and a proposal for an algorithm treatment
M. Herrero Trujillano, A. Mendiola de la Osa, J. Insausti Valdivia y J. Pérez-Cajaraville
Centro Integral de Dolor Oncológico CIDO. HM Hospitales
Recibido: 08-11-2018
Aceptado: 29-06-2019
Correspondencia: Manuel Herrero Trujillano
manuelherrerotrujillano@gmail.com
ABSTRACT
Pancreatic cancer provokes pain in more than 80 % of patients, resulting in a management of pain that is often unsatisfactory due to the limited treatment options and the significant variation in clinical practice, emphasizing the need for a multidisciplinary approach. This article has been redacted to review the literature and summarize the actual evidence of neurolytic procedures to treat pain caused by pancreatic cancer. The sources of these of articles have been obtained by using PubMed and Medline, restricting the search to randomized control comparative studies, systematic reviews, prospective and retrospective studies, and case series presentations. This article shows the actual evidence of the different approaches for the celiac plexus and splanchnic nerve neurolysis, regarding its efficacy, risks, adverse effects, and limitations. The final objective has been to propose an interventional algorithm that might help to improve pain management in patients suffering from pancreatic cancer.
Key words: Neurolysis, pancreatic cancer, celiac plexus, splanchnic nerves, endoscopic ultrasound, cancer pain.
RESUMEN
El cáncer de páncreas produce dolor en más del 80 % de los pacientes, con un manejo analgésico en ocasiones insatisfactorio debido a las opciones terapéuticas limitadas y a la variación de la práctica clínica, siendo necesario un manejo multidisciplinar. El desarrollo de este artículo ha consistido en revisar la literatura y resumir la evidencia actual de los procedimientos intervencionistas neurolíticos para manejar el dolor visceral asociado al cáncer de páncreas. La fuente de artículos de esta revisión se ha obtenido a través de PubMed y Medline, limitando la búsqueda a ensayos controlados y aleatorizados, revisiones sistematizadas, estudios prospectivos y retrospectivos y presentaciones de series de casos. Se muestra la evidencia actual de los diferentes abordajes para la neurólisis del plexo celiaco y de los nervios esplácnicos, describiendo su eficacia, riesgos, complicaciones y limitaciones. El objetivo final ha sido establecer una propuesta de algoritmo intervencionista que pueda mejorar el manejo del dolor en los pacientes que sufren dolor visceral debido al cáncer de páncreas.
Palabras clave: Neurólisis, cáncer de páncreas, plexo celiaco, nervios esplácnicos, ecoendoscopia, dolor oncológico.
INTRODUCCIÓN
El cáncer de páncreas es uno de los tumores sólidos con peor pronóstico que existen, siendo el adenocarcinoma ductal el que ocupa más del 90 % de los casos. La supervivencia a 5 años es únicamente del 5-10 % y más de la mitad de los pacientes no sobreviven pasado el primer año (1). Esto es debido a que la sintomatología suele aparecer de forma tardía, provocando que en el momento del diagnóstico solo un 10-20 % de los adenocarcinomas de páncreas sean resecables. Más del 80 % de los pacientes padecerán dolor abdominal y dorsolumbar a lo largo de su enfermedad, con un 50-70 % referido como dolor severo (2), en gran parte debido a que este tipo de cáncer tiene un rango de infiltración perineural de un 80-100 % (3). Es por ello fundamental el control del dolor de estos pacientes, ya que muchas veces se presenta como un reto para los médicos debido a su alta complejidad y a su mala evolución.
La existencia de cualquiera de las siguientes situaciones supone una contraindicación para la cirugía con intención curativa en el adenocarcinoma de páncreas (4): metástasis a distancia, ausencia del plano graso normal entre el tumor y el tronco celiaco, encajonamiento de la arteria mesentérica superior mayor de 180° de su circunferencia, invasión de la vena cava y/o aorta, afectación irresecable del eje mesentérico-portal, y afectación de los ganglios linfáticos fuera del campo de resección estándar. Cuando ocurre alguna de estas situaciones y el dolor se vuelve severo y refractario al tratamiento médico según las guías de la Organización Mundial de la Salud (OMS) (5), podemos recurrir a procedimientos intervencionistas que han demostrado tener una alta eficacia y perfil de seguridad, con una baja incidencia de complicaciones graves. Los procedimientos van desde la neurólisis del plexo celiaco y de los nervios esplácnicos, con sus diversos abordajes y técnicas de imagen, hasta la infusión espinal y la neuroestimulación. Esta revisión trata de aclarar las indicaciones, eficacia, ventajas y desventajas de las técnicas neurolíticas dirigidas a aliviar el dolor visceral asociado al cáncer de páncreas.
DIANAS ANATÓMICAS
El dolor visceral del abdomen superior es recogido por un conjunto especial de fibras nerviosas aferentes agrupadas en el plexo celiaco y los nervios esplácnicos (6):
– El plexo celiaco está situado a nivel retroperitoneal en la cara anterior de la aorta, a la altura de las vértebras T12 y L1 por delante de la crura diafragmática. Este plexo está formado por dos o más ganglios que se disponen alrededor del tronco celiaco y de la arteria mesentérica superior, recibiendo fibras simpáticas de los nervios esplácnicos y fibras parasimpáticas del nervio vago. Los ganglios reciben las aferencias de las fibras simpátcas del tubo digestivo que van desde el tercio distal del esófago hasta el ángulo esplénico del colon, incluyendo fibras simpáticas del hígado, páncreas, vesícula biliar, bazo, riñones, uréter proximal y glándulas suprarrenales, así como de los vasos sanguíneos que forman el plexo celiaco.
– Los nervios esplácnicos son tres nervios que nacen de la cadena simpática torácica y se disponen lateralmente en la columna vertebral: 1) el esplácnico mayor se forma por las fibras preganglionares simpáticas de T5 a T9; 2) el esplácnico menor se forma por las fibras procedentes de T10 y T11; y 3) el esplácnico inferior, por las fibras que vienen de T11 y T12. Todos ellos confluyen en la cara lateral de las vértebras T11 y T12 −lugar idóneo para la realización de una neurólisis− y discurren paralelos hasta atravesar el diafragma y unirse al plexo celiaco.
PROCEDIMIENTOS INTERVENCIONISTAS NEUROLÍTICOS
Para indicar una neurólisis en un proceso tumoral maligno es crucial la selección del paciente. Las variables más importantes a tener en cuenta son: 1) la severidad del dolor, 2) el dolor persistente a pesar del tratamiento médico, con quimioterapia o radioterapia, 3) el dolor fundamentalmente visceral, 4) el dolor que no puede ser tratado mediante otros procedimientos menos invasivos, y 5) una expectativa de vida reducida de los pacientes.
Hay factores que pueden influir en el resultado del procedimiento, como son: 1) La imagen utilizada (fluoroscopia, tomografía computerizada, ecografía o ecoendoscopia); 2) el volumen y concentración del agente neurolítico, ya que el incremento de ambos puede mejorar la eficacia del bloqueo, pero conlleva también un mayor riesgo de complicaciones (7); 3) la localización del tumor en la víscera, siendo más exitosa la neurólisis si el tumor se encuentra en la cabeza del páncreas (92 %) que si se localiza en el cuerpo o en la cola (29 %) (8); 4) la extensión de la masa tumoral, ya que si infiltra el plexo celiaco (9), áreas somáticas (peritoneo, diafragma) o produce dolor neuropático, puede reducirse notablemente la tasa de éxito; y 5) el bloqueo diagnóstico previo como factor predictivo positivo, pero cuestionable si es negativo en pacientes con cáncer terminal (10).
Dentro de las contraindicaciones generales para la neurólisis del plexo celiaco y de los nervios esplácnicos se encuentran: las alteraciones de la coagulación (INR > 1,5, trombocitopenia < 50000); el tratamiento concomitante con antiagregantes y/o anticoagulantes (11); la presencia de obstrucción intestinal, debido al efecto simpaticolítico del bloqueo; la imposibilidad del paciente para permanecer en decúbito supino o prono según qué abordaje; y la invasión tumoral del tronco celiaco cuando nuestra diana es el plexo celiaco.
Teniendo en cuenta que nuestras dianas son el plexo celiaco y/o los nervios esplácnicos, podemos distinguir los procedimientos intervencionistas según el abordaje en el espacio, la técnica de imagen utilizada y el tipo de abordaje percutáneo.
Según el abordaje en el espacio
– Posterior: abordaje clásico más utilizado, realizado mediante fluoroscopia o tomografía computerizada (TAC), con el paciente en decúbito prono.
– Anterior: se puede realizar a través de ecoendoscopia, de aguja percutánea guiada por ecografía o TAC, o intraoperatoriamente mediante laparotomía. El abordaje anterior percutáneo se realiza en decúbito supino y precisa de profilaxis antibiótica por el riesgo de perforación de vísceras intestinales.
Según la técnica de imagen utilizada
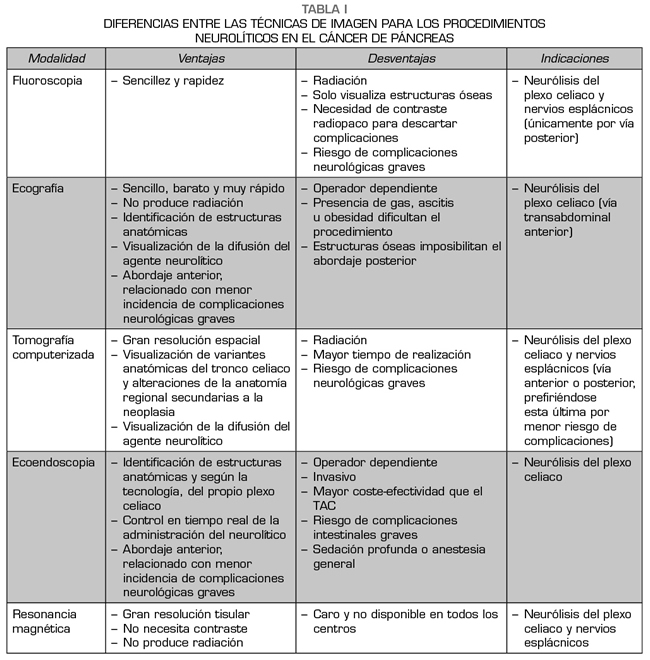
Cada técnica de imagen conlleva unas ventajas, desventajas e indicaciones, que pueden verse resumidas en la Tabla I.

Según el abordaje percutáneo
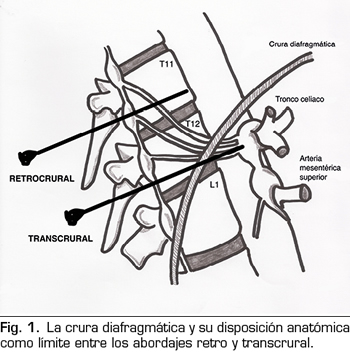
La crura diafragmática va a determinar anatómicamente si el bloqueo realizado representa un verdadero bloqueo del plexo celiaco o se trata de un bloqueo de los nervios esplácnicos (Figura 1). Si la punta de la aguja queda posterior a la crura, los nervios bloqueados serán los esplácnicos. Las agujas dispuestas a nivel del cuerpo vertebral de T11 siempre quedarán por detrás de la crura. Por debajo de este nivel, la crura se hace posterior y se inserta en los cuerpos vertebrales de T12 y L1. A esta altura, las agujas pueden ser colocadas tanto anteriores como posteriores a la crura. El abordaje clásico de Kappis (12) de posicionamiento de la aguja en el borde anterior del cuerpo vertebral suele resultar en un bloqueo retrocrural, demostrado en trabajos posteriores en cadáveres con TAC (13). Para conseguir un verdadero bloqueo anterior a la crura, se debe avanzar más la aguja para que quede anterior a la aorta abdominal.
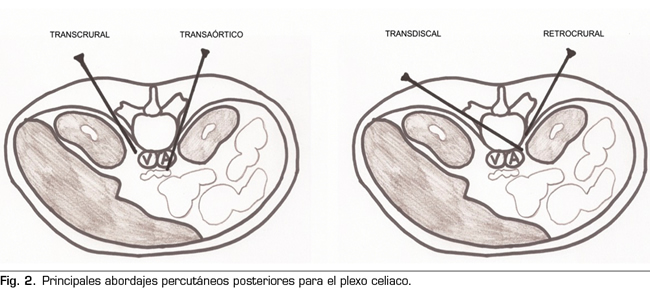
Aclarada esta cuestión, podemos clasificar los abordajes percutáneos de la siguiente manera (Figura 2):
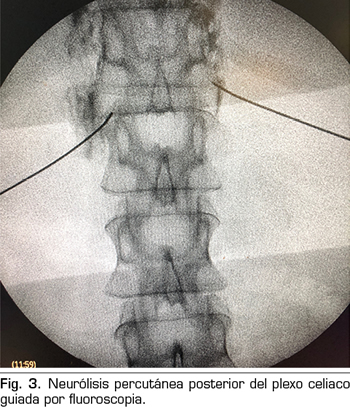
– Abordaje transcrural: el más utilizado para el bloqueo del plexo celiaco (Figura 3). El paciente se coloca en decúbito prono, identificando el cuerpo vertebral L1 y avanzando una aguja por cada lado, a unos 7,5 cm de la línea media, hasta atravesar la crura diafragmática y bloquear el plexo.
– Abordaje retrocrural: abordaje que clásicamente se ha descrito tanto para el bloqueo del plexo celiaco (a nivel L1) como para los nervios esplácnicos. En el abordaje retrocrural puro, el paciente se coloca en decúbito prono y se localizan los cuerpos vertebrales de T11 y T12, avanzando las agujas hasta el tercio anterior de estos y bloqueando así los nervios esplácnicos.
– Abordaje transaórtico: descrito por Ischia y cols. (14), se trata de un abordaje unilateral con el paciente en decúbito prono, accediendo desde el lado izquierdo del cuerpo vertebral de L1 hasta atravesar la aorta y quedando la punta de la aguja anterior a esta. Se apreciará salida de sangre en el momento en el que atravesemos la arteria, con un cese posterior en cuanto nos dispongamos anteriores a ella. Se ha visto que el riesgo de hemorragia oculta es bajo, ya que en esta zona la aorta se encuentra reforzada por las cruras diafragmáticas y la fascia prevertebral. Sin embargo, las publicaciones son escasas y son necesarios estudios de mayor evidencia científica. Las contraindicaciones específicas para este abordaje son la presencia de aneurisma de aorta abdominal, trombo mural y calcificaciones.
– Abordaje transdiscal: se realiza bajo control TAC atravesando el disco intervertebral T12-L1 hasta alcanzar los nervios esplácnicos. Aunque la bibliografía es escasa, con este abordaje se consigue teóricamente disminuir el riesgo de complicaciones como paraplejia, neumotórax y perforación hepática o renal, ya que la aguja se introduce más cerca de la línea media, siendo de gran utilidad en pacientes con alteraciones anatómicas alrededor del plexo celiaco o en pacientes con organomegalias (15,16).
– Abordaje abdominal: utilizado normalmente bajo visión ecográfica por vía anterior.
NEURÓLISIS PERCUTÁNEA CLÁSICA DEL PLEXO CELIACO
Consiste en la destrucción de las fibras que componen el plexo celiaco mediante la inyección de un agente neurolítico, prefiriéndose el uso de alcohol debido a su menor afinidad por los vasos sanguíneos, comparado con el fenol. El abordaje clásico más utilizado es el transcrural bilateral por vía posterior, guiado por fluoroscopia o TAC.
En los últimos años han surgido varios ensayos controlados y aleatorizados que han sido analizados en una revisión sistemática posterior por Mercadante y cols. (17), demostrando una mayor eficacia analgésica de manera significativa, aunque mínima, en los grupos en los que se realizó la neurólisis del plexo celiaco comparado con los grupos tratados con opioides sistémicos. Además, demostraron una reducción en el consumo de opioides en la mayoría de trabajos (18-29) y una mejoría en la calidad de vida en algunos de ellos (20,27,29). Las complicaciones eran raras en todos los abordajes, aunque no era una variable primaria en ningún estudio. A pesar de estos resultados, la calidad de todos los trabajos, exceptuando dos (24,28), era pobre debido a limitaciones importantes como el tamaño muestral, la ocultación de la asignación o el tiempo de evaluación de la eficacia del bloqueo.
Se han publicado complicaciones derivadas de la neurólisis del plexo celiaco, siendo infrecuentes en la mayoría de casos (30). Hay que saber diferenciar los efectos adversos esperados de la simpatectomía química de las complicaciones derivadas de la técnica. Un 20-42 % de pacientes presentan hipotensión debido a la vasodilatación secundaria a la neurólisis. La diarrea tiene una incidencia del 10-25 %, resolviéndose en las primeras 48-72 horas. La presencia de dolor lumbar tiene una incidencia que va del 5 % al 60 % según las series. También está descrita la omalgia en un 1 % de casos, debido a la irritación diafragmática. Con respecto al abordaje percutáneo, las complicaciones de la técnica son raras (2 %), estando descritos el déficit neurológico (debilidad y parestesias), la gastritis hemorrágica, la duodenitis, el neumotórax, la hematuria y la muerte (3,1 %). La paraplejia está publicada con los abordajes posteriores (0,15 %), pudiendo ser debida a la lesión directa de la aguja en la médula espinal o al infarto espinal secundario a un espasmo arterial.
NEURÓLISIS PERCUTÁNEA ECOGRÁFICA DEL PLEXO CELIACO
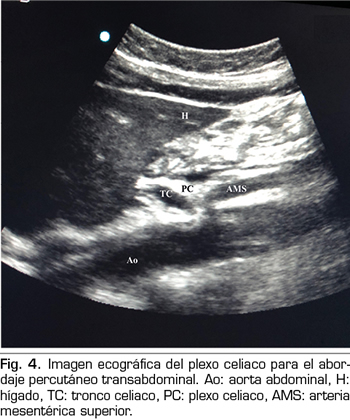
En los últimos años la ecografía ha ido ganando terreno a la fluoroscopia y al TAC en el manejo intervencionista del dolor. El primero en describir la técnica sobre el plexo celiaco fue Bhatnagar (31), pudiendo ser realizada percutáneamente en la cabecera del paciente y en decúbito supino, lo que da mayor comodidad tanto para el paciente como para el médico. Sin embargo, todavía no existen ensayos controlados y aleatorizados que comparen la neurólisis ecográfica abdominal del plexo celiaco frente al tratamiento sistémico opioide. La técnica se realiza utilizando una sonda convex (2-5 MHz), colocada inicialmente justo por debajo de la apófisis xifoides en el plano transversal, para identificar estructuras como hígado, estómago, intestino, venas portales, cava y aorta. Con la ayuda del Doppler, escaneamos caudalmente para identificar la bifurcación del tronco celiaco en las arterias hepática y esplénica, y más distalmente en la arteria mesentérica superior. Es entonces cuando giramos el transductor en el plano longitudinal, visualizando en la misma imagen la bifurcación de la aorta en el tronco celiaco y en la arteria mesentérica superior con el plexo celiaco rodeando estas estructuras. El abordaje se realiza en plano, transabdominal, atravesando el hígado o el estómago, siempre y cuando no haya grandes vasos interfiriendo el recorrido de la aguja (Figura 4).
No se han reportado complicaciones con el abordaje percutáneo ecográfico; de todas formas, la literatura al respecto es insuficiente como para extraer conclusiones (32).
DIFERENCIAS ENTRE LOS ABORDAJES PERCUTÁNEOS PARA LA NEURÓLISIS DEL PLEXO CELIACO
No existen diferencias en términos de control del dolor a corto y largo plazo. Ischia y cols. (33) realizaron un estudio comparativo y aleatorizado sin encontrar diferencias en el grado de analgesia comparando tres abordajes posteriores (retrocrural, transaórtico y esplacnicectomía química), obteniendo un alivio significativo del dolor del 70-80 % de manera inmediata y del 60-75 % hasta el momento del fallecimiento. No obstante, los grupos eran pequeños y el consumo de opioides no fue evaluado. El resto de trabajos son de una calidad pobre: Tewari y cols. (34) mostraron superioridad con el bloqueo retrocrural del plexo celiaco frente al bloqueo transaórtico, si bien el bloqueo retrocrural probablemente estaba actuando sobre los nervios esplácnicos. Marcy y cols. (35) mostraron un control del dolor en 27 de 34 pacientes con un éxito similar con el abordaje ecográfico abdominal comparado con el guiado por TAC (93 % versus 100 %), prefiriendo la trayectoria a través del hígado, con presencia únicamente de complicaciones menores. En otro estudio controlado y randomizado comparando los mismos abordajes (36), el éxito de la técnica y la calidad de vida de los pacientes fue similar, pero el abordaje guiado por TAC requirió de menos intentos y repeticiones del bloqueo. Por tanto, no existe suficiente evidencia científica en el momento actual para decantarnos por una técnica percutánea sobre otra.
NEURÓLISIS ECOENDOSCÓPICA DEL PLEXO CELIACO
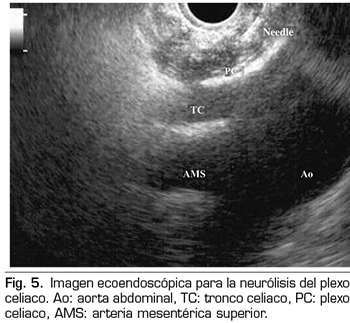
La ecoendoscopia ofrece la ventaja de una mayor visualización del plexo celiaco a corta proximidad, permitiendo una mayor precisión y seguridad en la administración del agente neurolítico y evitando la inyección en estructuras vasculares mediante el uso del Doppler (37) (Figura 5). No obstante, los trabajos que apoyan la neurólisis ecoendoscópica, considerada al igual que la técnica percutánea como una terapia de rescate, están limitados a estudios retrospectivos no controlados (38). Pauli y cols. publicaron un metanálisis que concluye que esta técnica consigue una reducción del dolor del 80 % en pacientes con cáncer de páncreas (39). Algunos estudios muestran un ligero descenso en el consumo de opioides, pero sin una fuerte evidencia científica.
No existen a día de hoy trabajos que demuestren un aumento de la supervivencia tras la neurólisis del plexo celiaco utilizando la técnica ecoendoscópica. Hay un estudio retrospectivo de casos y controles, que concluye que la neurólisis es un factor independiente en la supervivencia de los pacientes con cáncer de páncreas (40), pero se necesitan trabajos que aporten mayor evidencia.
En cuanto a los efectos adversos, se limitan a una serie de publicaciones retrospectivas y series de casos, estando descritos la hipotensión (11 %), la diarrea (18 %) y el dolor abdominal transitorio (1,5 a 8 %) (37). Teóricamente, esta técnica es más segura, con su abordaje anterior a través de la pared gástrica y paso directo de la aguja al plexo visualizando los vasos, sin tener que atravesar el espacio retrocrural (41). Aun así, también se han publicado complicaciones fatales con esta técnica. Gimeno-García y cols. (42) describieron la primera complicación de trombosis y vasoespasmo de la arteria celiaca que produjo una isquemia multiorgánica y la muerte del paciente. Desde entonces esta complicación se ha publicado en otros 2 trabajos, que también acabaron en muerte (43,44). Otros efectos adversos descritos son el sangrado retroperitoneal y 2 casos de paraplejia.
Dentro de las contraindicaciones relativas a esta técnica se encuentran: la presencia de varices gástricas o esofágicas −ya que aumentan el riesgo de sangrado−, una anatomía desestructurada, la invasión tumoral directa del plexo, y las malformaciones congénitas del tronco celiaco o de la arteria mesentérica superior.
¿ABORDAJE PERCUTÁNEO O ECOENDOSCÓPICO DEL PLEXO CELIACO?
No existen estudios que comparen directamente los dos abordajes en pacientes con cáncer de páncreas. Solo hay dos ensayos controlados y aleatorizados que comparan el abordaje percutáneo —uno con TAC y el otro con fluoroscopia− frente al abordaje ecoendoscópico, pero en pacientes con pancreatitis crónica (45,46), demostrando una mayor eficacia en el control del dolor para el procedimiento ecoendoscópico, pero solo en las primeras 4 semanas, sin diferencias a las 8 y 12 semanas, y sin diferencias en cuanto a efectos adversos, como también refleja la revisión sistemática de Nobre Moura y cols. (47). Además, en estos estudios no se utilizaron agentes neurolíticos sino anestésicos locales y corticoides, ya que se trataba de pacientes con patología benigna.
NEURÓLISIS DE LOS NERVIOS ESPLÁCNICOS
Los nervios esplácnicos se encuentran ubicados en la cara anterolateral de los cuerpos vertebrales de T9 a T11, por encima de la inserción de las cruras diafragmáticas, constituyendo una importante barrera para situaciones que pueden aumentar el fracaso de una neurólisis sobre el plexo celiaco (variables o cambios anatómicos, fibrosis, adherencias o infiltración tumoral) (16). En estos casos, la neurólisis de los nervios esplácnicos puede ser de gran utilidad, pudiendo ser realizada por vía quirúrgica o percutánea.
Técnica quirúrgica
Se realiza a través de toracoscopia con el paciente en decúbito prono. Las ventajas de esta técnica incluyen la posibilidad de realizar la neurólisis bilateralmente mediante insuflación de CO2 e inserción de los dos trócares al mismo tiempo, y la alta precisión en la identificación de los nervios esplácnicos, pudiendo abordar de T5 a T12. Puede realizarse sin ventilación selectiva pulmonar, aunque un alto porcentaje de cirujanos lo prefieren, ya que facilita la técnica y reduce el tiempo quirúrgico. Las desventajas a destacar son la presencia de adhesiones pleurales que dificulten el procedimiento y los riesgos que conlleva una anestesia general.
Las publicaciones se limitan a trabajos prospectivos y series de casos (48). Bhutiani (49) demostró en un estudio comparativo entre pacientes con cáncer de páncreas y pacientes con pancreatitis crónica, una mayor eficacia analgésica con menor consumo de opioides y hospitalización en el grupo oncológico.
Técnica percutánea
Se realiza mediante un abordaje posterior retrocrural, normalmente guiado por fluoroscopia (Figura 6). Las lesiones pueden llevarse a cabo mediante radiofrecuencia convencional o utilizando agentes neurolíticos como en el plexo celiaco.
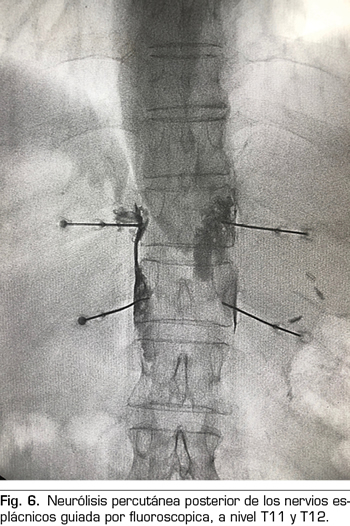
Radiofrecuencia convencional o térmica de los nervios esplácnicos
Consiste en la producción de una corriente eléctrica de alta frecuencia en la punta de la aguja, generándose calor alrededor de esta y llegando a producir una destrucción tisular si se sobrepasan los 45-50 °C y los 20 segundos de estabilización de la temperatura, influido también por otros factores como el calibre de la aguja y la longitud de la punta activa (50). Para los nervios esplácnicos se suelen utilizar agujas de 18 a 20 G, con una punta activa mínima de 10 milímetros, estableciendo lesiones de 80 °C y 90 segundos por aguja (51).
La radiofrecuencia convencional de los nervios esplácnicos está ampliamente documentada en la literatura con estudios que han demostrado su eficacia en el dolor asociado a la pancreatitis crónica, pero no en el cáncer de páncreas. Esto es debido a la radioanatomía más predecible de los nervios esplácnicos y a la menor tasa de complicaciones severas, ya que la técnica permite una estimulación sensitiva y motora previa para evitar la lesión de otros nervios, y no precisa necesariamente de agentes neurolíticos que puedan difundir y afectar otras estructuras (51,52). Respecto al cáncer de páncreas, hay un estudio retrospectivo de 56 pacientes que muestra un descenso significativo de la escala visual analógica (EVA) y del consumo de opioides, con una mejoría en la calidad de vida de los pacientes de hasta seis meses de duración, pudiendo ser más prolongado el efecto que con el uso de agentes neurolíticos (53). No obstante, son necesarios estudios controlados y aleatorizados para llegar a obtener conclusiones relevantes.
Neurólisis química de los nervios esplácnicos
Recientemente, la administración de agentes neurolíticos en los nervios esplácnicos ha vuelto a ganar interés debido a su menor variabilidad anatómica en relación a estructuras circundantes y a su mayor accesibilidad percutánea (54-56). No obstante, hasta ahora no hay una evidencia superior de la neurólisis química frente a la radiofrecuencia convencional en los pacientes con cáncer de páncreas.
Amr y cols. (57) realizaron un estudio comparativo en pacientes con dolor asociado al cáncer de páncreas y a otras neoplasias del abdomen superior, comparando la neurólisis química de los nervios esplácnicos con la radiofrecuencia convencional. El descenso de la EVA fue más importante en el grupo tratado con radiofrecuencia, con un descenso en el consumo de opioides y con una mejoría en la calidad de vida similar en ambos grupos, sin presencia de complicaciones graves. De todas formas, se trata de un estudio pequeño y son necesarios más trabajos que ofrezcan una mayor evidencia científica.
Las complicaciones en el abordaje de los nervios esplácnicos son infrecuentes. Al igual que los bloqueos neurolíticos, la radiofrecuencia también puede producir neuritis que suele desaparecer a las pocas semanas. La hipotensión y la diarrea son autolimitadas y se derivan de la simpaticólisis, aunque con menor frecuencia que con el bloqueo del plexo celiaco. Como en todos los procedimientos torácicos, hay que estar alerta del posible neumotórax, recomendándose un control radiográfico posterior. La sensación de disnea que a veces presentan los pacientes puede ser debida al bloqueo anestésico del nervio frénico, produciéndose una elevación del hemidiafragma. Otras complicaciones raras reportadas en la literatura son la lesión del ductus torácico, sospechosa cuando se aspira fluido amarillento y turbio a través de la aguja, o la inyección intradiscal e intravascular, que siempre debe ser verificada previamente con contraste radiopaco. Las parestesias pueden aparecer si hay contacto de la aguja con las raíces dorsales torácicas (58). El uso de radiofrecuencia en los nervios esplácnicos debería evitar el riesgo de paraplejia (51), pero los resultados han sido poco estudiados.
Dentro de las contraindicaciones específicas para la destrucción de los nervios esplácnicos se encuentran: la existencia de un aneurisma de aorta abdominal, la insuficiencia respiratoria, el neumotórax unilateral y la presencia de adhesiones pleurales.
¿NEURÓLISIS DEL PLEXO CELIACO O NEURÓLISIS DE LOS NERVIOS ESPLÁCNICOS?
La inmensa mayoría de trabajos publicados hasta la fecha sobre el manejo intervencionista del dolor asociado al cáncer de páncreas se han centrado en la neurólisis química del plexo celiaco, incluyendo los dos con mayor calidad científica (24,28), demostrando su superioridad frente al tratamiento farmacológico. El primer estudio comparativo entre la neurólisis del plexo celiaco —mediante abordaje transaórtico— y la neurólisis de los nervios esplácnicos en pacientes con cáncer de páncreas lo realizaron Ozyalcin y cols. (59), mostrando diferencias estadísticamente significativas en favor de la neurólisis de los esplácnicos, y sorprendentemente una menor tasa de supervivencia para el grupo tratado sobre el plexo celiaco. Posteriormente, Shwita (56) publicó otro estudio comparativo similar, con mayor número de pacientes y a 2 años de seguimiento, aunque incluía diferentes patologías oncológicas del abdomen superior, mostrando una eficacia analgésica similar para ambos grupos en las primeras semanas, con un mejor control del dolor con opioides y mejor calidad de vida en el grupo de la neurólisis esplácnica a partir del cuarto mes. El descenso en el consumo de opioides fue similar en ambos grupos.
Plancarte y cols. (54) describieron la neurólisis química de los nervios esplácnicos como una alternativa a la neurólisis del plexo celiaco cuando existen alteraciones anatómicas en la zona. Se trataba del primer trabajo publicado en pubmed donde se explicaba el abordaje de estos nervios por vía transdiscal. El estudio observacional incluía a 109 pacientes con dolor abdominal superior maligno y mostraba un descenso de la EVA y del consumo de opioides con una mejoría que se mantenía hasta un año de seguimiento o hasta la muerte, y sin presencia de complicaciones graves relacionadas con la técnica. Posteriormente, Ahmed y cols. (56) realizaron otro estudio pequeño retrospectivo que incluía pacientes con diferentes neoplasias abdominales (biliar, gástrica y pancreática), mostrando resultados similares a los de Plancarte y cols. (54).
Marra y cols. (60) presentaron una serie de 150 casos sometidos a neurólisis química del plexo celiaco, nervios esplácnicos, o de ambos, mediante un abordaje anterior guiado por TAC, obteniendo mejores resultados en los pacientes sometidos al bloqueo de nervios esplácnicos y bloqueo combinado, frente a los que se les realizaba únicamente el bloqueo del plexo celiaco.
Con respecto al procedimiento toracoscópico de los nervios esplácnicos, algunos estudios comparan la eficacia de la videotoracoscopia frente a la neurólisis del plexo celiaco. Stefaniak y cols. (27) investigaron la severidad del dolor, la calidad de vida y el consumo de opioides en 35 pacientes tratados con neurólisis del plexo celiaco y 24 tratados con esplacnicectomía toracoscópica unilateral, concluyendo que ambos procedimientos aportaban una eficacia similar, prefiriendo el bloqueo del plexo celiaco al ser menos invasivo y a que mejoraba más la calidad de vida de los pacientes comparado con la videotoracoscopia. Por otro lado, Johnson y cols. (61) compararon la eficacia de la neurólisis bilateral del plexo celiaco, la esplacnicectomía toracoscópica y el tratamiento médico con opioides en 65 pacientes con dolor oncológico abdominal superior, con un seguimiento de dos meses. Las conclusiones de este estudio, a diferencia de los demás, es que los dos abordajes intervencionistas no obtenían suficiente reducción del dolor ni consumo de opioides comparado con el grupo tratado únicamente con opioides.
¿NEURÓLISIS CON ALCOHOL O CON FENOL?
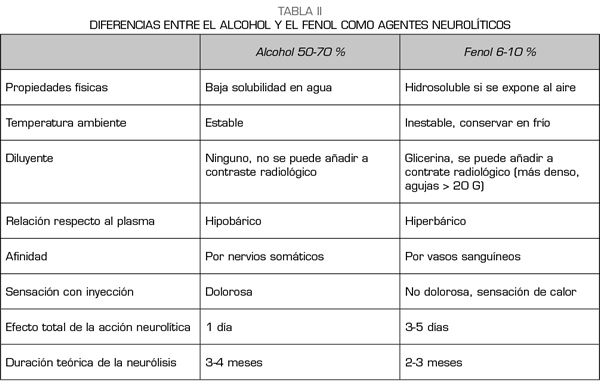
El alcohol y el fenol son los dos agentes que se utilizan para la neurólisis química de la cadena simpática (63). El alcohol etílico es una solución incolora e hipobárica respecto al plasma, diluyéndose al 50-70 % para obtener un efecto simpaticolítico. El fenol no se comercializa en España y debe ser preparado previamente en la farmacia del hospital. Es inestable a temperatura ambiente y su vida media es de 1 año cuando se conserva en frío y lejos de la luz. Se suele utilizar a concentraciones de 6-10 % para los bloqueos simpáticos, ya que por debajo de 2 % solo produce un efecto anestésico y por encima del 20 % puede destruir nervios somáticos. Las propiedades químicas y diferencias entre ambos agentes pueden verse resumidas en la Tabla II.
Los trabajos que comparan el alcohol con el fenol en los bloqueos simpáticos son escasos. Koyyalagunta y cols. (63) publicaron un estudio retrospectivo de 93 pacientes con cáncer abdominal sometidos a neurólisis química de los nervios esplácnicos, valorando la eficacia, duración del bloqueo y efectos adversos de los dos agentes. No encontraron diferencias en el alivio del dolor ni en la incidencia de complicaciones. La infiltración tumoral del tronco celiaco y la radioterapia previa no interfirió en la eficacia del procedimiento, razón por la que los investigadores eligieron los nervios esplácnicos como diana.
Hay mucha variedad bibliográfica sobre qué tipo de agente usar y qué cantidad de volumen administrar, dependiendo básicamente de la diana elegida, el abordaje percutáneo, y la técnica de imagen que utilicemos. Para los bloqueos realizados por vía transcrural, se recomiendan unos 15-20 ml de agente neurolítico por cada lado, prefiriéndose el alcohol por su menor afinidad por los vasos sanguíneos. Para el abordaje ecográfico abdominal, son suficientes 8-10 ml de alcohol. Para la neurólisis de los nervios esplácnicos, se recomiendan 6-8 ml de fenol, por su menor afinidad por los nervios somáticos. Si utilizamos la técnica ecoendoscópica, el volumen también es bajo. LeBlanc y cols. (64) no encontraron diferencias entre la administración ecoendoscópica de 20 ml frente a 10 ml de alcohol.
¿NECESIDAD DE UN BLOQUEO DIAGNÓSTICO PREVIO?
El procedimiento habitual para cualquier técnica intervencionista percutánea que produzca una destrucción tisular es realizar previamente un bloqueo diagnóstico. Sin embargo, cuando se trata de enfermedades oncológicas incurables, este algoritmo puede ser discutido. Yuen y cols. (10) publicaron un estudio retrospectivo que comparaba pacientes con cáncer abdominal sometidos a neurólisis del plexo celiaco tras un bloqueo diagnóstico positivo, frente a pacientes en los que se realizaba la neurólisis directamente. Concluyeron que una respuesta positiva al bloqueo diagnóstico se correlacionaba positivamente con el bloqueo neurolítico, pero que el bloqueo diagnóstico era un predictor pobre cuando la respuesta era negativa. Por tanto, su papel clínico puede ser cuestionable en pacientes con cáncer terminal, aunque se requiere de más estudios comparativos que apoyen esta conclusión.
Por otro lado, en la neurólisis ecoendoscópica no se realiza un bloqueo diagnóstico previo, probablemente debido a que se trata de un procedimiento más invasivo, pero se ve favorecido porque obtiene una mejor visualización de las estructuras y del agente neurolítico.
¿NEURÓLISIS UNILATERAL O BILATERAL?
La neurólisis unilateral consiste en una única inyección en la base del tronco celiaco, pero conlleva el riesgo de una exposición inadecuada del plexo, teniendo en cuenta que está situado ligeramente hacia la izquierda con respecto a la aorta; y si utilizamos la ecoendoscopia, en la mayoría de casos se encuentra entre el tronco celiaco y la glándula suprarrenal izquierda. La neurólisis bilateral consiste en la administración del agente neurolítico a ambos lados del plexo celiaco, bien sea por un abordaje percutáneo posterior o bien girando el ecoendoscopio a cada lado del tronco celiaco (37). Pese a que el abordaje bilateral podría asociarse a mayor riesgo de complicaciones, ha demostrado tener mejores resultados en el descenso del dolor en los pacientes incluso en la duración del bloqueo neurolítico, con una incidencia de complicaciones similar al abordaje unilateral, tanto para la técnica percutánea clásica como para la ecoendoscopia (64,65). En un metanálisis reciente (66) no se muestran diferencias entre la técnica ecoendoscópica unilateral o bilateral, pero se demuestra un descenso en la necesidad de analgésicos postoperatorios en el grupo de la neurólisis bilateral. De todas formas, hay que tener en cuenta que la mayoría de los metanálisis están realizados con el abordaje bilateral, tanto para el procedimiento percutáneo clásico como para el ecoendoscópico.
La neurólisis percutánea ecoguiada también se ha publicado en un estudio randomizado (68), comparando el abordaje unilateral paramedial frente al bilateral en pacientes con patología oncológica abdominal, sin encontrar diferencias en el alivio del dolor y la duración del mismo de hasta 3 meses, pero con mayor incomodidad del paciente utilizando el abordaje bilateral. Las limitaciones de este estudio eran que no estaba realizado a doble ciego —el paciente estaba despierto durante la técnica— y que hasta ahora no existen trabajos que demuestren la superioridad de la ecografía abdominal frente a otros abordajes y técnicas de imagen.
NEURÓLISIS CENTRAL
La neurólisis central consiste en la inyección directa del agente neurolítico en los ganglios del plexo celiaco, siendo posible únicamente mediante ecoendoscopia, gracias al desarrollo tecnológico de los últimos años. Hay estudios prospectivos que muestran la capacidad de detección de los ganglios entre el 81 y el 89 % de los casos (69,70). Existe un ensayo controlado y aleatorizado que compara la neurólisis ecoendoscópica unilateral con la central, demostrando un mayor alivio del dolor en el grupo de la neurólisis central (75 % versus 45,5 %), pero no hay ensayos que comparen el abordaje bilateral con el central (71). La neurólisis central del plexo celiaco es dependiente de la tecnología del equipo instrumental y además es presumible que cuando se inyecta el agente neurolítico dentro del ganglio, la droga pueda difundir más allá de su diana y destruir otros ganglios no visibles. Por tanto, la neurólisis bilateral sigue siendo el principal abordaje en los pacientes con cáncer de páncreas.
RADIOFRECUENCIA ECOENDOSCÓPICA DEL PLEXO CELIACO
Recientemente ha surgido la ablación por radiofrecuencia de los ganglios celiacos por vía ecoendoscópica como otra alternativa para paliar el dolor oncológico pancreático. Existe un estudio controlado y aleatorizado que compara la radiofrecuencia de los ganglios celiacos con la neurólisis química del plexo por vía endoscópica (72), con un mayor control del dolor y calidad de vida de los pacientes tratados con radiofrecuencia, aunque el tamaño muestral es pequeño y el seguimiento es únicamente de 4 semanas, por lo que se necesitan más estudios comparativos sobre este tema.
¿NEURÓLISIS TEMPRANA O TARDÍA?
La neurólisis del plexo celiaco no se recomienda antes de la cirugía debido al riesgo de fibrosis y de otras complicaciones. Para tumores irresecables, la posible ventaja de una neurólisis temprana es prevenir y minimizar la progresión del dolor y la tolerancia a los opioides. Sin embargo, parece ser que el efecto analgésico suele desaparecer después de 8 semanas y en la mayoría de pacientes el dolor recurre a los 3 meses (73). Después de este tiempo, podría repetirse la neurólisis del plexo celiaco sin que aumente el riesgo de complicaciones, pero con una tasa de efectividad que puede descender hasta el 30 %, como demuestra el trabajo de McGreevy y cols. (74).
Algunos trabajos cuestionan el algoritmo que propone la OMS sobre uso de métodos invasivos únicamente cuando falla el tercer escalón. Amyr y cols. (74) demostraron en un estudio comparativo un mayor control del dolor a los 2 meses, asociado a una mejor calidad de vida y menor consumo de opioides, en un grupo de pacientes con cáncer de páncreas sometidos a neurólisis después del tratamiento con opioides sistémicos, frente a otro grupo de pacientes sometidos a la neurólisis antes de comenzar con opioides. Curiosamente, los mismos investigadores concluyen en un estudio posterior de 109 pacientes con cáncer abdominal y pélvico (76), un aumento estadísticamente significativo de respondedores a la neurólisis simpática cuando se realizaba antes del segundo escalón de la OMS, frente a otro grupo que seguía el algoritmo normal, con un descenso mayor de efectos adversos y de consumo de opioides de hasta 12 meses en el primer grupo.
Respecto a las dosis de opioides, De Oliveira y cols. (29) no encontraron diferencias significativas en el bloqueo neurolítico de pacientes con altas dosis de morfina (> 90 mg/día de morfina oral) frente a los que estaban con dosis bajas (< 90 mg/día de morfina oral). Hay un estudio prospectivo sobre el abordaje percutáneo ecoguiado y temprano para el dolor gastrointestinal y pélvico maligno (31) que incluye un total de 44 pacientes, sometidos a neurólisis del plexo celiaco, hipogástrico superior y ganglio impar: Para ser considerada una “neurólisis temprana”, los criterios de inclusión de los pacientes debían ser el tener un EVA > 7 o estar en tratamiento con morfina oral > 30 mg/día en el mes previo al bloqueo. La EVA se redujo de manera significativa, con solo un 11,4 % de pacientes que necesitaban morfina oral tras el procedimiento, aunque el seguimiento fue únicamente dos meses.
Si hablamos de la técnica ecoendoscópica, hay publicado un ensayo controlado y aleatorizado que compara la neurólisis ecoendoscópica temprana con la analgesia sistémica, siendo el descenso del dolor más significativo en el grupo de la neurólisis, con un seguimiento de hasta 3 meses, pero con una diferencia menos marcada en el consumo de opioides entre los dos grupos, influida también si los pacientes recibían quimioterapia o radioterapia (28).
DISCUSIÓN
A diferencia de otros dolores oncológicos abdomino-pélvicos, el dolor visceral asociado al cáncer de páncreas posee la ventaja de tener bien definidas las dianas anatómicas en las que actuar sobre el eje simpático, con trabajos que demuestran un alivio del dolor de más del 70-90 % de los pacientes, mostrando una ligera superioridad frente al tratamiento farmacológico sistémico y una menor incidencia de efectos adversos. No obstante, sigue habiendo controversias sobre qué abordaje y qué técnica de imagen son los más adecuados para estos pacientes. El procedimiento intervencionista ideal sería aquel que cumpliese con las siguientes características: 1) ser mínimamente invasivo, 2) asociarse a un riesgo mínimo de complicaciones graves, 3) conseguir un alivio significativo del dolor, 4) mejorar la calidad de vida de los pacientes, 5) prolongar la supervivencia de estos y 6) producir un descenso en el consumo de opioides.
Hasta ahora, los trabajos de mayor evidencia científica han sido realizados sobre el plexo celiaco (nivel de evidencia 2 A+ con grado de recomendación II B) (77,78), la mayoría utilizando el abordaje percutáneo posterior a pesar de que casi todos ellos tenían limitaciones importantes. Según los resultados del trabajo de Mercadante y cols. (17) se puede concluir que la neurólisis del plexo celiaco tiene una eficacia superior al tratamiento con opioides sistémicos, siendo mínima, pero con unos efectos adversos mucho menos frecuentes, algo que es importante para los pacientes. Otro dato importante extraído de la misma revisión es que no se encontraron diferencias significativas en la EVA tras 2 meses de seguimiento, si bien solo había 2 trabajos que evaluaban el dolor hasta 3 meses después de la neurólisis (24,26). El descenso en el consumo de opioides fue significativo en todos los trabajos pero solo hasta los 2 meses de seguimiento, habiendo un único estudio que seguía encontrando este descenso 3 meses después de la neurólisis (26). Por tanto, estos resultados reflejan que el efecto del bloqueo neurolítico puede durar entre 2 y 3 meses (73), algo importante a tener en cuenta a la hora de decidir el momento apropiado para realizar la técnica.
El bloqueo neurolítico del plexo celiaco podría teóricamente prolongar la supervivencia de los pacientes con cáncer de páncreas. El adenocarcinoma ductal tiene características neurotróficas, y como el crecimiento tumoral sigue el recorrido de los nervios, la destrucción de estos podría ser ventajosa. Sin embargo, solo hay un ensayo controlado y aleatorizado que demostró una mayor supervivencia en pacientes que recibían neurólisis del plexo celiaco frente a un grupo que recibía suero salino (19), aunque este estudio fue realizado en pacientes sometidos a laparotomía exploradora, con diagnóstico in situ de tumor irresecable e inyección directa del agente químico por parte del cirujano. Staats y cols. (22) publicaron un trabajo mostrando un aumento de supervivencia tras la neurólisis del plexo celiaco, sin que se haya podido reproducir en estudios retrospectivos posteriores (79), por lo que no hay una evidencia suficiente a favor de que el bloqueo neurolítico afecte a la progresión de la enfermedad.
Por otro lado, la evolución de los equipos de trabajo junto con la especialización de los operadores médicos ha motivado el desarrollo de nuevas técnicas intervencionistas, como la neurólisis ecoendoscópica (nivel de evidencia B con grado de recomendación II A) (80) y la neurólisis percutánea ecoguiada del plexo celiaco. Estos procedimientos mejoran la visibilidad de la anatomía alrededor del plexo y la precisión a la hora de inyectar el agente neurolítico, pudiendo disminuir las complicaciones relacionadas. La neurólisis percutánea ecoguiada puede además llevarse a cabo en la cabecera del paciente, reduciendo el tiempo quirúrgico y el estrés al enfermo. No obstante, no existen todavía trabajos con suficiente calidad científica que se inclinen por estos procedimientos sobre los anteriores. Tampoco hay una evidencia suficiente a favor de la neurólisis de los nervios esplácnicos (nivel de evidencia 2 B+ con grado de recomendación II B+) (78) frente al plexo celiaco, si bien los escasos trabajos publicados sugieren una eficacia analgésica similar, con una mayor calidad de vida de los pacientes y un posible alivio del dolor más prolongado si utilizamos la radiofrecuencia convencional, a la espera de que se publiquen más trabajos comparativos para obtener conclusiones más acertadas.
Sigue habiendo controversias sobre el momento apropiado para realizar la neurólisis. Algunos estudios sugieren una intervención temprana (20-22,29,33), mientras otros como De Oliveria y cols. (29) no mostraban diferencias significativas entre pacientes tratados con altas dosis de opioides frente a otros tratados con dosis bajas. Hay que aclarar que el nivel de consumo de opioides no debe reflejar en ningún caso el estadio de la enfermedad. Amr y Makharita (75) obtuvieron mejores resultados con la neurólisis del plexo celiaco si se controlaba antes el dolor con medicación sistémica. Para decidir en qué momento podemos realizar la neurólisis, los principales factores a tener en cuenta son la duración de la eficacia del bloqueo, la evolución tumoral y la esperanza de vida del paciente. No obstante, postponer mucho esta intervención conlleva el riesgo de que el tumor acabe infiltrando otras estructuras no viscerales y que el consumo excesivo de opioides produzca tolerancia y efectos adversos incontrolables, reduciendo drásticamente el éxito de la técnicas. Por tanto, la supervivencia de los pacientes no debería ser un factor limitante para la simpaticolisis, ya que muchas veces no está bien clara y depende de más factores. El bloqueo neurolítico puede conseguir una reducción de los opioides y de sus efectos secundarios y, en muchas ocasiones, mejorar la calidad de vida de los pacientes durante el periodo que dura su efecto, sin por ello aumentar de manera significativa la tasa de complicaciones graves.
PROPUESTA DE ALGORITMO INTERVENCIONISTA
El manejo del dolor asociado al cáncer de páncreas debería ser, como en cualquier otro tipo de dolor oncológico, un manejo multidiscilplinar. Esto exige de una estrecha colaboración entre los servicios de oncología médica, oncología radioterápica, cirugía, digestivo, cuidados paliativos y dolor, ya que la evolución de la enfermedad provoca que estos pacientes se sometan a diferentes pruebas y tratamientos que pueden influir en la toma de decisiones. La ecoendoscopia puede ser necesaria no solo en el momento del diagnóstico, sino también en otras situaciones a lo largo de la enfermedad como, por ejemplo, para diagnosticar complicaciones. Por tanto, tendrá que haber un trabajo en equipo para aprovechar esta técnica y realizar la neurólisis en ese momento si está indicada, para evitar así un mayor sufrimiento a los pacientes con más técnicas intervencionistas innecesarias. Otras consideraciones a tener en cuenta son que algunos tratamientos quimioterápicos pueden producir alteraciones de la hemostasia, a tener en cuenta para la selección del abordaje percutáneo, y que el uso de radioterapia puede mejorar el dolor tumoral, otro motivo más para llevar a cabo un manejo multidisciplinar y ordenado. Por último, es aconsejable una valoración psicológica de los pacientes para controlar factores que pueden disminuir el umbral del dolor, como son la angustia, la ansiedad o la depresión asociadas, ya que pueden influir en la valoración de la EVA y en la decisión final del bloqueo neurolítico.
Siguiendo las conclusiones de las publicaciones previamente descritas, se puede establecer un algoritmo de tratamiento intervencionista de los pacientes con dolor visceral asociado al cáncer de páncreas (Figura 7).
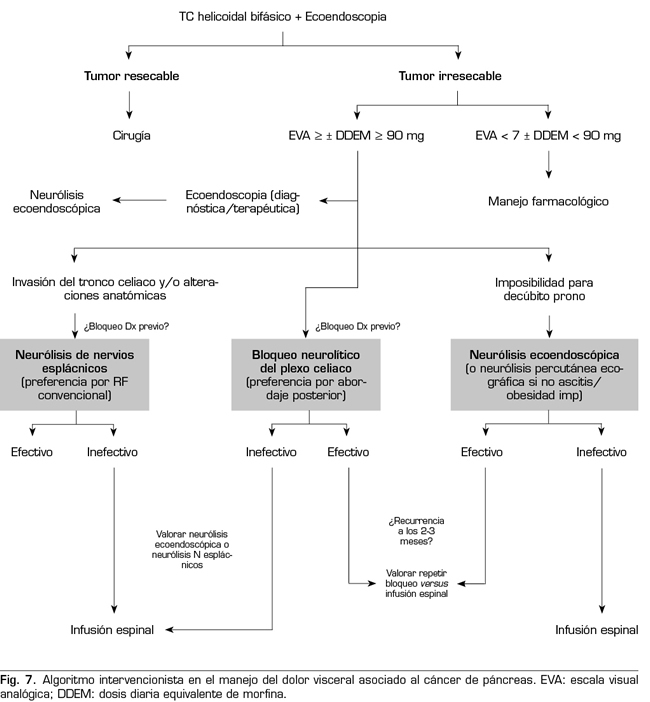
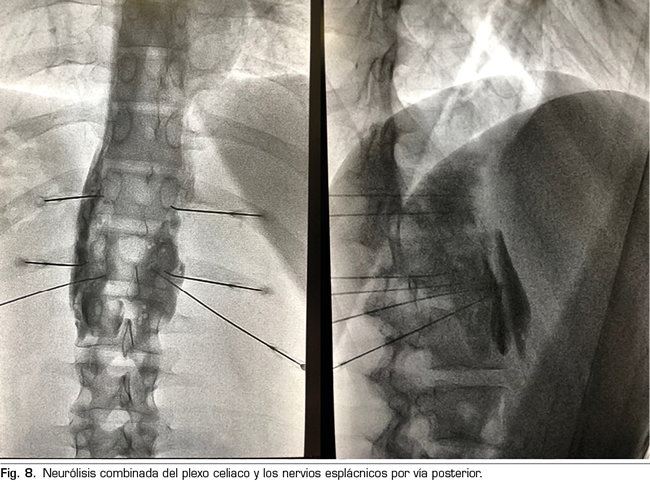
El procedimiento estándar sería el abordaje posterior del plexo celiaco (abordaje clásico), ya que a día de hoy continúa siendo el de mayor evidencia científica, preferiblemente transcrural y guiado por fluoroscopia, debido a su sencillez y rapidez. La ecoendoscopia estaría indicada para la neurólisis aprovechando su indicación diagnóstica o terapéutica, para situaciones de imposibilidad para el decúbito prono, y como alternativa en caso de que falle el abordaje posterior. La neurólisis percutánea ecográfica quedaría reservada para casos seleccionados, dependiendo de la experiencia del operador, ya que es la técnica que menos publicaciones tiene hasta la fecha. Confiamos en que en un futuro se publiquen trabajos que permitan a las técnicas ecoguiadas, ya sean percutáneas o ecoendoscópicas, ocupar el puesto de “método de referencia”, ya que permiten la visualización de las estructuras circundantes con control de la inyección en tiempo real. Una alternativa al bloqueo del plexo celiaco es la radiofrecuencia convencional de los nervios esplácnicos, indicada cuando existe infiltración tumoral del tronco celiaco, alteraciones anatómicas importantes o si fracasa la neurólisis del plexo celiaco. También es posible considerar una neurólisis combinada —bloqueo neurolítico del plexo celiaco asociado a bloqueo neurolítico o radiofrecuencia de los nervios esplácnicos—, como refleja el trabajo de Marra y cols. (60), y como venimos realizando en nuestra práctica clínica habitual en HM hospitales, con el objetivo de aumentar la tasa de éxito y la duración de la analgesia sin aumentar la incidencia de complicaciones, pero hasta ahora no hay trabajos comparativos suficientes para apoyar esta hipótesis (Figura 8).
Respecto al momento idóneo para realizar el bloqueo, nuestro equipo aboga por una neurólisis que no sea tardía a pesar de que la duración del efecto es limitado, ya que vemos una serie de ventajas en los pacientes, como son un mayor control del dolor, una mejora en la calidad de vida, y una menor tolerancia a opioides. Lo que sí es mandatorio, como indica una de las principales variables para realizar la neurólisis, es que el dolor sea severo, que según la OMS se estima en un EVA > 7. Los pacientes con cáncer de páncreas y dolor severo que se sometan a procedimientos neurolíticos, deben estar previamente tratados con opioides potentes, pudiendo establecer una dosis diaria equivalente de morfina (DDEM) por encima de 90 mg para confirmar la decisión del bloqueo, o menor si el paciente padece efectos secundarios importantes derivados de los opioides.
BIBLIOGRAFÍA