DOI: 10.20986/resed.2021.3872/2020
ARTÍCULO
MODELOS EXPERIMENTALES DE EVALUACIÓN DEL DOLOR EN ARTROSIS
EXPERIMENTAL MODELS FOR PAIN EVALUATION IN OSTEOARTHRITIS
J. A. García-Partida1,2,3
E. Berrocoso2,3,4,5
J. A. Micó1,3,4,5
1Departamento de Neurociencias. Universidad de Cádiz, España
2Grupo de Investigación en Neuropsicofarmacología & Psicobiología. PAIDI CTS-510
3Instituto de Investigación e Innovación en Ciencias Biomédicas de Cádiz. INiBICA
4Departamento de Psicología. Área de Psicobiología. Universidad de Cádiz, España
5Centro de Investigación en Red de Salud Mental. Instituto de Salud Carlos III. Madrid, España
ABSTRACT
Osteoarthritis (OA) is one of the main pathologies associated with chronic pain, and despite decades of study many key aspects of its pathophysiology are still unknown, which contributes to continuing to investigate therapeutic options capable of effectively and safely controlling pain. The use of experimental models of OA continues to be one of the most useful alternatives for understanding both the etiopathogenesis of OA and for the development of possible biomarkers and treatments. Despite the usefulness of experimental models in the advancement of knowledge of OA, there is no single model or technical procedure that allows us to study in it the great variety of structural and symptomatic changes that occur in the patient throughout his illness. However, today we have models and techniques for pain assessment that allow us to understand the mechanisms underlying OA as well as to understand and explore new therapeutic opportunities for its more effective and safe control.
Key words: Pain, osteoarthritis, experimental models
RESUMEN
La osteoartritis (OA) es una de las principales patologías asociadas al dolor crónico y, a pesar de décadas de estudio, todavía se desconocen muchos aspectos clave de su fisiopatología, lo que impulsa a seguir investigando opciones terapéuticas capaces de controlar el dolor de manera eficaz y segura. El uso de modelos experimentales de OA sigue siendo una de las alternativas más útiles para la comprensión tanto de la etiopatogenia de la OA como para el desarrollo de posibles biomarcadores y tratamientos. A pesar de la utilidad de los modelos experimentales en el avance del conocimiento de la OA, no existe un modelo o procedimiento técnico único que nos permita estudiar en él la gran variedad de cambios estructurales y sintomáticos que suceden en el paciente a lo largo de su enfermedad. No obstante, hoy en día disponemos de modelos y técnicas para la evaluación del dolor que nos permiten comprender los mecanismos que subyacen en la OA, así como comprender y explorar nuevas oportunidades terapéuticas para su control más eficaz y seguro.
Palabras clave: Dolor, osteoartritis, artrosis, modelos experimentales
Correspondencia: Juan Antonio Micó
juanantonio.mico@uca.es
INTRODUCCIÓN
La osteoartritis (OA) es una patología crónica caracterizada por deterioro articular, modificación del hueso subcondral, aparición de osteofitos y aumento del líquido sinovial, lo que contribuye a un daño progresivo de la articulación, limitación funcional y dolor (1). La enfermedad afecta con mayor frecuencia a las articulaciones de las rodillas, manos, pies y columna, y es relativamente común en las articulaciones de los hombros y la cadera (2,3). Se estima que, a nivel mundial, el 9,6 % de los hombres y el 18,0 % de las mujeres con edad por encima de los 60 años tienen síntomas de OA, lo cual significa que cerca de 242 millones de personas padecen los síntomas de la OA, principalmente en la cadera o rodilla (2,4). Aunque está asociada al envejecimiento, existen otros factores que también están implicados en su desarrollo, como son la obesidad, falta de ejercicio, predisposición genética, traumatismos, lesiones y sexo (2). Además, es una de las causas más comunes de incapacidad en adultos en el mundo occidental, solamente por detrás de las enfermedades cardiovasculares (2,3,5), lo que conlleva un enorme consumo de recursos económicos y sanitarios. Por todo ello, podemos decir que la OA es una de las enfermedades crónicas más importantes que afectan al hombre.
A pesar de décadas de estudio, todavía se desconocen muchos aspectos de la fisiopatología de la enfermedad, y no disponemos de tratamientos que sea capaces de frenar la degeneración articular. Los tratamientos se dirigen principalmente al manejo del dolor, si bien, estos tratamientos no siempre alcanzan un alivio efectivo y presentan importantes efectos secundarios (6,7). Por lo tanto, es evidente la necesidad de desarrollar nuevas alternativas terapéuticas capaces de frenar la degeneración y que permitan un manejo adecuado del dolor. Sin embargo, el curso natural de la enfermedad, normalmente lento y heterogéneo (8) y la presentación tardía de los síntomas clínicos dificulta el estudio de los cambios moleculares y estructurales en la articulación (9), lo cual, sumado a la falta de conocimiento de los mecanismos que subyacen en el desarrollo del dolor crónico asociados a la degeneración articular (3) complican el manejo de esta patología.
Entre los procedimientos que existen para mejorar el conocimiento de esta enfermedad, disponemos de los modelos experimentales para el estudio de la OA. Aunque no existe un modelo desarrollado en animales que pueda responder a todas las preguntas que plantea la OA (10,11), sí que existen distintos modelos animales que nos pueden ayudar a entender muchos de los mecanismos implicados que se asocian a los cambios patológicos que ocurren durante el inicio y la progresión de la enfermedad (12). De hecho, el empleo de modelos animales para mejorar la comprensión de la fisiopatología de la OA y el desarrollo de nuevas herramientas de diagnóstico y terapéutica ha jugado un papel fundamental en el pasado y siguen siendo imprescindibles en la actualidad.
MODELOS EXPERIMENTALES DE OSTEOARTRITIS
De manera general, un modelo experimental desarrollado en animales intenta reproducir una enfermedad o parte de ella de manera similar a su presentación en humanos. El objetivo es mejorar el conocimiento de los fundamentos fisiopatológicos que subyacen en la enfermedad y la búsqueda de nuevas aproximaciones terapéuticas, además de explorar mecanismos de acción de fármacos en uso. Para que todo esto sea posible, los modelos experimentales deben tener validez científica. Nestler y Hyman, 2010, proponen unos criterios para juzgar la calidad de un modelo experimental animal y proponen tres tipos de requisitos: validez de constructo, aparente y predictiva. La validez de constructo se logra cuando al reproducir los factores de riesgo de la enfermedad en humanos se obtienen cambios neuroanatómicos y bioquímicos presentes en la misma (13,14); la validez aparente se alcanza si un modelo simula las anormalidades bioquímicas, neuroanatómicas y de comportamiento presentes en la enfermedad (13,14), y finalmente la validez predictiva, propone que el modelo debería reproducir los efectos que un fármaco produce en los pacientes afectos de tal o cual patología. Asimismo, otra condición será que un fármaco o procedimiento terapéutico con eficacia probada en pacientes también ofrezca respuestas similares en el modelo, o al menos equivalentes; por otro lado, fármacos que no ofrezcan soluciones en humanos no deben dar respuesta tampoco en el modelo (13,14).
Lo que hemos visto hasta ahora son generalidades de los modelos experimentales en animales, ahora nos adentraremos en los específicos para OA.
Respecto a las especies empleadas para el desarrollo de los modelos de OA, destacan principalmente la rata y el ratón, aunque también se han empleado cobayas y conejos. El mayor uso de estas especies frente al empleo de otras especies mayores se debe a su pequeño tamaño, fácil mantenimiento en estabulación, menor coste tanto para su adquisición como para su mantenimiento, sin olvidar la importancia capital de las cuestiones éticas. Sin embargo, también se emplean perros, ovejas, cabras y caballos. De hecho, el perro es la especie animal que mejor reproduce la patogénesis y el dolor como síntoma predominante en relación con el dolor en humanos, además su respuesta a los tratamientos los convierte en un modelo con alto valor predictivo (15), haciendo que sea con diferencia la especie dentro de los animales mayores más empleada en el estudio de la OA (16).
Los modelos animales utilizados para el estudio de la OA se dividen en relación con su origen en: espontáneos, donde se incluyen los modelos naturales y las líneas modificadas genéticamente, y los inducidos, bien por manipulación quirúrgica o por administración intrarticular de una sustancia química.
Modelos espontáneos
En estos modelos, la patología se presenta de manera lenta y progresiva imitando el curso natural de la OA en humanos. Los ratones, conejos, cobayas cerdos, perro, oveja y caballo pueden desarrollan de manera natural OA, si bien la especie más comúnmente empleada es el cobaya Dunkin Hartley (17). Esta cepa de cobaya desarrolla OA de manera espontánea, asociada al envejecimiento, principalmente en rodilla, aunque también se presenta en otras articulaciones. En esta cepa, los cambios histológicos asociados a OA debutan a los 3 meses de edad alcanzando una severidad de moderada a grave a los 18 meses (18).
Los modelos espontáneos tienen la ventaja de desarrollar OA asociada a la edad, de manera similar a la presentación en humanos, sin embargo, esta circunstancia exige un periodo experimental largo, exponiendo a los animales a un mayor número de factores intervinientes en la propia enfermedad y aumentando la variabilidad, por lo que requieren un mayor número de animales para que los resultados experimentales tengan la validez necesaria. El empleo de un mayor número de animales durante más tiempo supone una mayor inversión no siempre deseable según el medio e institución de investigación (10,19). Otra desventaja de estos modelos es que la patología se presenta cuando los animales tienen ya una edad avanzada, la cual se asocia a un comportamiento natural más letárgico, y en muchos casos asociados a estados de obesidad, de manera que esto los convierte en sujetos experimentales deficientes para estudios de comportamiento en general y de dolor en particular (17).
Modelos transgénicos
En las últimas décadas la ingeniería genética ha revolucionado todos los aspectos de la investigación biomédica. El desarrollo de líneas transgénicas de animales nos permite evaluar la implicación de uno o varios genes en la patogénesis de muchas enfermedades incluyendo la OA (19,20,21). De esta forma, podemos identificar proteínas que pudieran estar implicadas en su inicio y desarrollo, lo cual a su vez resulta clave para el desarrollo de nuevas estrategias terapéuticas. Sin embargo, no debemos olvidar que en muchas patologías como la OA normalmente existe una implicación poligénica, lo que complica el hecho de obtener resultados directamente extrapolables a otras especies animales y lógicamente al ser humano.
Modelos asociados a la obesidad
Otro tipo de aproximación dentro de los modelos espontáneos es el modelo de OA asociado a la obesidad (22). La obesidad se asocia a un estado de inflamación crónica y a la liberación de numerosos mediadores proinflamatorios, lo cual, sumado al sobrepeso soportado por las articulaciones, determina el desarrollo de OA.
La obesidad se asocia principalmente a la OA de rodilla, cadera y manos (23,24). En este sentido, estudios preclínicos han señalado que ratones alimentados con dietas altamente calóricas durante 45 semanas sufrieron cambios asociados con la OA como puede ser la pérdida de proteoglicanos, menor capacidad músculo esquelética e hiperalgesia térmica (25,26). Si bien este modelo tiene la ventaja de incluir factores de riesgo en el desarrollo de la OA similares a los que pueden presentarse en algunos humanos, sin embargo, igual que los modelos espontáneos tradicionales, suponen una inversión importante de tiempo en su desarrollo, repercutiendo en un mayor coste del estudio. Además, debido a la menor sensibilidad de los individuos obesos a los estímulos dolorosos (27) no constituyen un modelo fiable en extremo para evaluar dolor.
Modelos inducidos
En todos los modelos de dolor inducidos en los que tengamos que producir una lesión que generará dolor, esta lesión se realizará únicamente de manera unilateral, ya que según se establece en la legislación vigente y las guías éticas para los modelos de dolor, agudos o crónicos en animales conscientes, estos se expondrán siempre al mínimo dolor necesario para alcanzar los objetivos del experimento (Zimmermann, 1985) (28).
Existen numerosas técnicas para producir un daño en la articulación que conlleve al desarrollo de OA aplicables a diferentes especies; todas ellas tienen una serie de ventajas y limitaciones y han sido ampliamente revisadas (29.30.31). De manera general se agrupan en modelos de inducción química por inyección intrarticular, inducción quirúrgica e inducción postraumática no invasiva.
Inducción química por inyección intrarticular
Se han empleado muchos agentes químicos, tales como colagenasa, carragenina, coadyuvante de Freud (19,20), los cuales han sido interesantes para el estudio del dolor inflamatorio; sin embargo, no aportaban una información relevante sobre la contribución del dolor en la OA (3). Por ello, en las últimas décadas para el desarrollo de OA en modelos animales, las sustancias más empleadas son el yodoacetato monosódico (MIA) y el ácido lisofosfatídico (LPA) (17). Estos modelos tienen la ventaja de evitar la cirugía y los riesgos de infección asociados; además son fácilmente reproducibles. Sin embargo, debido al rápido desarrollo de los procesos degenerativos, no es un buen modelo clínico para el estudio de la OA espontánea ni postraumática (12), pero sí resultan interesantes para el estudio de los mecanismos subyacentes en el dolor y el ensayo de nuevas terapias en OA (19).
Yodoacetato monosódico (MIA)
La inyección de MIA intrarticular produce la activación de procesos inflamatorios, así como la inhibición enzimática de la glucólisis en los condrocitos, que acabará conduciendo a la muerte de estos y la consecuente degeneración del cartílago. Este proceso, junto con la modificación del hueso subcondral y la aparición de osteofitos, conlleva al desarrollo de un daño articular que imita al que se presenta en el estadio final de la OA en humanos (3). Este modelo se desarrolla principalmente en ratas, aunque también se han empleado otras especies de roedores; la rodilla es la articulación de elección para este modelo, y en menor grado la cadera o tobillo. Podemos diferenciar dos fases según la naturaleza del dolor generado: la primera de tipo inflamatorio y la segunda que incluye un componente neuropático. Este es el modelo de OA más empleado en el estudio del dolor asociado a esta patología (32,33). El método más empleado para su valoración es analizando la respuesta aversiva a un estímulo mediante el test de von Frey, si bien, también se han empleado otros métodos más sofisticados, como es el registro electrofisiológico.
Ácido lisofosfatídico (LPA)
Está descrito un aumento del nivel de LPA en líquido sinovial de articulaciones de pacientes con OA y además este incremento se correlaciona con la severidad de la OA (34). El LPA es un lípido bioactivo que puede unirse a receptores acoplados a proteínas G y media numerosas funciones. Algunas de estas funciones están directamente implicadas en el desarrollo de la OA, como son la secreción de citoquinas proinflamatorias, TNF-α, IL-1β e IL-6 (35) o bien favorecen la formación de vasos sanguíneos en la sinovial y cartílagos articulares, mecanismos que contribuyen a aumentar la inflamación y la pérdida de la funcionalidad (36,37).
La administración intrarticular de LPA en rata conduce al desarrollo de lesiones similares a las presentadas en la OA en humanos, además produce un importante daño en las vías nerviosas aferentes de la articulación, que conllevará al desarrollo de dolor neuropático de manera similar al que presentan algunos pacientes de OA, haciendo de este modelo el indicado para el desarrollo de terapias para el control del dolor neuropático en pacientes de OA (17).
Inducción quirúrgica
Existen numerosas técnicas quirúrgicas para inducir OA, la articulación de elección es la rodilla y los principales procedimientos que se emplean para su desarrollo son la meniscectomía total o parcial, el desgarro meniscal y la sección del ligamento cruzado anterior o del cruzado posterior (16). El objetivo de todas estas técnicas es desestabilizar la articulación, de manera que, al alterar el mecanismo articular junto a la activación de los procesos inflamatorios, produzcan la degeneración del cartílago, la remodelación del hueso y dolor, reproduciendo así las principales lesiones y síntomas de la OA (16).
Estos modelos están orientados principalmente a la reproducción de OA postraumática, donde los mecanismos moleculares implicados pueden diferir de los involucrados en la OA asociada a la edad (38). Son modelos fácilmente reproducibles y tienen un rápido inicio y desarrollo (8), si bien el rápido curso de su evolución ofrece poco margen para observar respuestas a las intervenciones terapéuticas (29). Por otro lado, se ha descrito que estas respuestas pueden diferir dependiendo de la técnica quirúrgica seleccionada, lo que le resta potencia traslacional como modelo experimental de OA (39).
Inducción no invasiva postraumática
Estos modelos reproducen una lesión articular sin necesidad de inyección intrarticular o intervención quirúrgica, eliminando así la posibilidad de infección e inflamación secundaria. El daño mecánico en la articulación se logra mediante distintos dispositivos y técnicas sin producir lesión en la piel de los animales, de un modo similar al daño articular postraumático producido en personas jóvenes. Las especies más empleadas para desarrollar este modelo son el ratón y el perro. Las técnicas empleadas incluyen la fractura de la meseta tibial intrarticular y la compresión cíclica del cartílago articular tibial en ratón y la realización de un impacto en la articulación femororrotuliana en el perro. Estas técnicas aportan la ventaja de su reproducibilidad y precisión, eliminando los posibles artefactos que se pueden presentar con las técnicas invasivas, por lo que se emplean principalmente para el estudio de la patogénesis de la OA y la inflamación sistémica que se puede presentar en el curso de la enfermedad (40). El aspecto negativo de este modelo es que los resultados experimentales pueden verse influidos por numerosos factores, tales como la edad, el sexo o la cepa utilizada, restándole parte de la reproducibilidad señalada. Además, requiere equipamiento especializado y personal bien entrenado para su valoración (41).
EVALUACIÓN DEL DOLOR EN LOS MODELOS ANIMALES DE OSTEOARTRITIS
Dada la naturaleza de la enfermedad, una importante parte de las investigaciones que se realizan en OA ponen el foco de atención en los cambios histológicos que se producen en la articulación en el curso de la enfermedad, así como los mecanismos que lo median. Sin embargo, es necesario recordar que el dolor crónico articular es el síntoma principal de la enfermedad y la causa que más afecta al normal desarrollo de la vida de los pacientes (17). El dolor se asocia normalmente al movimiento o al soporte del propio peso corporal (5). Por ello, debido a su importancia clínica y la complejidad de los mecanismos moleculares que intervienen en su desarrollo, convierten al dolor crónico en un objetivo de especial interés (38).
En el caso de la OA, parece que los mecanismos patofisiológicos involucrados en el dolor pueden diferir dependiendo del grado de desarrollo de la enfermedad, por lo que es esencial estudiar la implicación de este en las diferentes fases de la misma. Por ello, aunque todos los modelos de OA presentan dolor en algún momento de la enfermedad, parece que cobra importancia el desarrollo de modelos animales que presenten un curso de la enfermedad lento y progresivo, tal como se presenta en los pacientes, y que nos permita entender la participación de este síntoma a lo largo de la misma (3).
En el abordaje del estudio de la respuesta dolorosa en modelos animales, hay que tener en cuenta que la mayor parte de ellos han sido diseñados con el objetivo de evaluar aspectos muy específicos y, sobre todo, se han elaborado de manera que se puedan cuantificar o registrar determinados comportamientos que son el resultado de una respuesta del animal ante un input nociceptivo. Estos modelos incluyen la evaluación de la dimensión sensorial y olvidan en cierto modo la dimensión afectivo-emocional inherente a la experiencia de dolor en humanos y, muy probablemente, en animales. Si bien, en los últimos años se han diseñado test de comportamiento que nos permiten obtener una aproximación del componente afectivo-emocional en los animales de experimentación.
Los test o pruebas empleadas para la evaluación del dolor tienen que cumplir los siguientes requisitos:
- Especificidad. El estímulo debe tener naturaleza dolorosa (especificidad del input nociceptivo) y la respuesta obtenida debe ser desencadenada por esta entrada (especificidad del output nociceptivo).
- Sensibilidad. La respuesta debe ser cuantificada y se correlaciona con la intensidad y el tipo de estímulo, así como las manipulaciones farmacológicas.
- Fiabilidad. Los resultados deben ser consistentes y estables cuando se repite incluso cuando exista una pequeña variabilidad entre los sujetos.
- Reproducibilidad. Los resultados deben ser reproducibles dentro y entre laboratorios.
Los métodos para estudiar la conducta asociada al dolor en modelos animales de OA se basan principalmente en la evaluación de la respuesta dolorosa frente a un estímulo, lo que sería una respuesta evocada, pero también a través de la conducta dolorosa no evocada por estímulos. Además, disponemos de otras herramientas objetivas, como son los estudios electrofisiológicos, que constituyen una poderosa herramienta para comprender la implicación de las vías nociceptivas a lo largo del proceso.
Evaluación de la respuesta dolorosa a un estímulo. Dolor evocado
En estos modelos animales vamos a evaluar la presentación y grado de alodinia e hiperalgesia tras la estimulación nociceptiva. En este sentido, definimos alodinia como la percepción dolorosa frente a un estímulo no nocivo o que normalmente no desencadena dolor, e hiperalgesia como el aumento de la percepción dolorosa por estímulos nocivos que habitualmente desencadenan dolor. De esta forma, un mismo estímulo puede servir para evaluar alodinia o hiperalgesia dependiendo de la intensidad del mismo. Pero hay que tener en cuenta que, en animales sensibilizados, un mínimo estímulo nocivo puede causar un dolor intenso.
En los modelos animales de OA de tipo inducido, aunque presentan la lesión de manera unilateral, la respuesta al estímulo se evalúa sobre ambos miembros posteriores, lo cual nos permite comparar los resultados de la pata ipsilateral con la contralateral del propio animal, teniendo de esta forma un control interno del experimento (42).
Desde el punto de vista ético, en este tipo de estudios es imprescindible establecer claramente un límite en intensidad y tiempo de exposición al estímulo; es lo que denominamos punto final o cut off. De esta forma, en caso de que el animal no presente respuesta al estímulo, o esta sea retardada, no lesionaremos los tejidos ni infligiremos un sufrimiento innecesario al animal. La mayoría de los equipos empleados nos permite fijar este límite para no sobrepasarlo. Dependiendo del tipo de estímulo empleado podemos dividirlo en mecánico y térmico.
- Estímulo mecánico. En estos test se evalúa la hipersensibilidad a los estímulos mecánicos. Las respuestas observadas sugieren que se produce una sensibilización periférica en el curso de la OA. Los test más empleados para su evaluación incluyen el test de Von Frey y el test de retirada de la pata:
- Test de Von Frey. El test de von Frey se utiliza para testar la presencia de hiperalgesia y alodinia mecánica en rata y ratón (33,43,44). El test consiste en aplicar una misma presión sobre la pata del animal, con una serie de filamentos con una fuerza de flexión o rigidez creciente, conocidos como filamentos de Von Frey. El rango de fuerza de flexión de los filamentos va desde los 0,008 hasta los 300 gramos. Para realizar la evaluación se coloca al animal en un recinto de metacrilato, colocado sobre una rejilla de metal de forma que se tenga libre acceso a la superficie plantar. Una vez que el animal se ha habituado al espacio y se encuentra relajado, se le van aplicando los filamentos de manera perpendicular a la superficie plantar hasta que se doblan, se aplican en orden creciente hasta que el animal retira la pata (45).
Existe una versión electrónica del test de Von Frey que consiste en el empleo de un estesiómetro plantar. Este dispositivo consta de un estimulador táctil, que no es más que un filamento de acero rígido dispuesto verticalmente y conectado a una unidad electrónica de control (Figura 1). Para realizar la evaluación se sitúa al animal de forma similar a la versión manual y, una vez que el animal se ha relajado, se coloca el estimulador táctil debajo de la pata. En este momento se acciona el equipo y de forma automática el filamento se eleva, ejerciendo una fuerza de presión que se incrementa de forma gradual de 0 a 50 gramos durante un periodo de 0 a 20 segundos, hasta que el animal retira la pata o se alcanza el tope de fuerza establecido. La fuerza a la que se presenta la respuesta se registra automáticamente.
- Test de retirada de la pata trasera.
Este test también conocido como test de presión de la pata ha sido muy usado en el campo del dolor y fue descrito por primera vez por Randall y Selitto en 1957 (46). Este test evalúa la hiperalgesia mecánica y consiste en aplicar una fuerza creciente sobre la superficie dorsal de la pata trasera. Se emplea principalmente en ratas y son necesarias varias sesiones de entrenamiento para que el animal acepte la inmovilización requerida. Una vez que tenemos al animal inmovilizado, se le extiende la pata y se coloca en el dispositivo. La pata se coloca entre una superficie plana, sobre la que se apoya la zona a presionar y la punta del dispositivo que ejerce la fuerza. El test se inicia aplicando una fuerza en 30 g de presión, considerada una presión nociva, y se aumenta gradualmente de forma automática hasta que el animal retira la pata o vocaliza, considerando esta respuesta como una señal de dolor intenso. Esto ocurre en pocos segundos, y en este punto, se registra la fuerza en la que los animales retiran la pata. Es un test muy empleado cuando queremos evaluar el efecto analgésico de los fármacos, de manera que un fármaco que presente propiedades analgésicas aumentará dicho umbral en los modelos de OA (47).

Fig. 1.
- Estímulo térmico. Permite evaluar el umbral nociceptivo frente a un estímulo térmico en las patas del animal y se ha demostrado eficaz para evaluar la hiperalgesia térmica al calor e hiperalgesia y alodinia al frío en modelos preclínicos de OA. Entre los test más empleados se incluyen el Hot plate test, Hargreaves test (44), Cold plate test (48) y test de la acetona (49).
- Hot plate test. Hot plate test o test de la placa caliente se puede usar en rata y ratón (50). Los animales se colocan sobre una placa metálica y se mantienen retenidos sobre ella gracias a un cilindro de metacrilato (Figura 2). La placa metálica se puede mantener a temperatura constante, normalmente entre 50 y 55 °C, y se registrará el tiempo de latencia o usar una rampa creciente de temperatura empezando por una temperatura no perjudicial, por debajo de 42 °C, registrando en este caso la temperatura a la que se presenta una respuesta aversiva al estímulo (51). Esta respuesta se inicia con retirada de las patas delanteras y lamido de las palmas de las manos para posteriormente realizar la retirada de las patas traseras y lamido de las palmas de los pies, considerando la presentación de respuesta sobre las patas traseras como el indicador nociceptivo a considerar (50). También es frecuente la presentación de posturas anómalas o saltos (52)
- Test de Hargreaves. Este test se ha empleado para evaluar la capacidad analgésica de diversos fármacos en modelos preclínicos de OA (44) y se puede desarrollar en ratón o rata. Para su realización utilizamos un dispositivo con el que podemos dirigir un estímulo de calor doloroso infrarrojo o radiante (53). Para ello colocamos al animal sobre una superficie de cristal dentro de un recinto de metacrilato (Figura 3). Una vez que el animal se ha habituado, se coloca la fuente de calor debajo del animal y se apunta a la superficie plantar de la pata trasera y medimos el tiempo de latencia de retirada de la pata. La intensidad de la fuente de calor debe ser tal que induzca una latencia de 10-12 segundos en un animal naive, ya que se considera que esta intensidad permite evaluar alodinia e hipoalgesia térmica en los modelos de dolor (51).
- Thermal Probe test. El test de sonda térmica es similar al anterior, solo que en vez de usar un haz de luz utiliza una sonda térmica que se aplica sobre la pata trasera del animal. Para realizarlo se coloca al animal en un recinto de metacrilato sobre una rejilla metálica, para tener libre acceso a las patas traseras. Una vez que el animal se ha habituado, aproximamos la sonda a la pata trasera del ratón donde la sonda desarrollará un gradiente creciente de temperatura que va desde la temperatura a la que se encuentre en la habitación hasta los 60 °C, con un incremento de temperatura de 2,5 °C por segundo, estableciéndose como punto final de la prueba la temperatura máxima indicada. El equipo registrará la temperatura en el momento que la pata del animal se retira de la sonda o se alcanza el límite establecido. La ventaja que presenta frente a otros sistemas es que requiere un menor tiempo de habituación al sistema retenedor, pero de momento solo está validado en ratón (54).
- Cold plate test. En este test se puede evaluar fácilmente la respuesta dolorosa frente a un estímulo térmico inocuo y nociceptivo dependiendo de la intensidad empleada (51). Para su evaluación colocamos al animal dentro de un recinto de metacrilato sobre una placa fría (Figura 4), y medimos el número de sacudidas de la pata afectada en un tiempo determinado, así como el tiempo de latencia en manifestar una respuesta aversiva al estímulo. Los comportamientos observados pueden incluir sacudidas, saltos o lamidos de la pata, en algunos casos también se puede observar que el animal deja caer el peso sobre la pata sana evitando apoyarse sobre la pata dañada (51).
- Test de evaporación de la acetona. Este test se puede desarrollar en rata y ratón gracias a la conducta asociada al dolor que desarrollan los animales con OA al evaporarse la acetona sobre la superficie de la piel (55). Para realizar este test, el animal es colocado individualmente en un recinto de metacrilato sobre una rejilla elevada para tener acceso a las patas traseras. Una vez que el animal se ha habituado al recinto se aplicará con una pipeta o con un spray una gota (100 µl) de acetona sobre la pata. La medida se realiza 4 veces, aplicando la acetona en cada pata trasera, ipsilateral y contralateral, en intervalos de 5 minutos y se registra la respuesta en función de una escala establecida: 0, no respuesta; 1, retirada de la pata; 2, sacudida de la pata; 3, sacudida repetida o lameteo de la pata. En función de la respuesta media observada podemos valorar de forma objetiva el nivel de dolor. La hipersensibilidad al frío vendrá indicada por un aumento de respuesta en los animales con OA que tienen la neuropatía establecida (49).
Dado la escasa aplicación traslacional que han presentado los resultados obtenidos con los métodos anteriores, se ha hecho necesario incorporar nuevos test en la evaluación de la respuesta asociada al dolor. En este sentido, la evaluación de la respuesta dolorosa en ausencia de estímulos nociceptivos ha dado resultados más satisfactorios en la aplicación clínica.
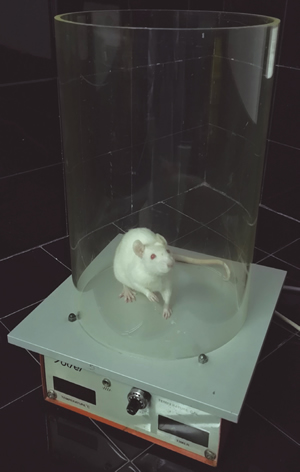
Fig. 2.

Fig. 3.

Fig. 4.
Evaluación del dolor en roedores basados en alteración en la marcha y el apoyo
Aunque de forma general estos test evalúan el dolor evocado debido al estímulo mecánico provocado por el soporte de su propio peso o la marcha, también pueden evaluar otras conductas más complejas asociados al comportamiento de protección del miembro lesionado (56). Entre estos test encontramos los siguientes:
- Prueba de carga dinámica (Dynamic weight bearing test). Este test se realiza con un dispositivo electrónico capaz de medir el peso de apoyo de cada una de las cuatro extremidades en libre movimiento (57). Para ello se coloca al animal en una caja de metacrilato cuyo suelo está cubierto por una alfombra tapizada de microsensores que registran el peso y la superficie de apoyo de cada una de las patas del animal (Figura 5a). La captura de los datos está sincronizada con una captura de vídeo que permite reevaluar los resultados y corregir los posibles errores del software de posicionamiento del animal (Figura 5b). En esta situación se observará una reducción del peso de apoyo de la extremidad afectada, permitiendo comparar el peso de apoyo de la pata afectada, ipsilateral frente a la contralateral.
- Análisis de la marcha (Gait analysis). El análisis de la marcha nos permite analizar cambios en la posición y el movimiento del miembro afectado. El método clásico se realiza mediante la aplicación de tinta en la planta de las manos y los pies de los roedores y los dejamos en libre movimiento, aunque también se puede forzar el desplazamiento colocando al animal sobre una cinta en movimiento o tredmill (4,51). En los modelos de OA nos permite observar en la pata ipsilateral una reducción en la presión de la pisada reflejado en una menor área de la huella y diversos parámetros asociados; también nos permite estudiar la longitud de la zancada y la velocidad, la fase de apoyo y de oscilación, que reflejan en animales con OA un menor peso de apoyo y un comportamiento de protección (56). Hoy en día existen en el mercado diferentes dispositivos electrónicos que facilitan la realización de este análisis. Para ello, el animal en libre movimiento camina sobre una placa de vidrio capaz de emitir una luz led verde que se refleja internamente excepto en aquellas áreas donde el animal hace contacto con la placa de vidrio y refractan la luz hacia el lado opuesto. De esta forma, las huellas del animal se iluminan donde la pata toca el cristal. Al mismo tiempo, una cámara en color de alta velocidad colocada debajo de la placa de vidrio captura estas áreas iluminadas y envía los datos al ordenador cuyo software permite el análisis de los parámetros de la marcha (58.59.60).
- La prueba de carga estática (Static weight bearing test). Este test mide el peso de apoyo de las patas traseras. Para ello colocamos al animal en un pequeño recinto situado sobre un plano inclinado, de manera que el animal se ve obligado a apoyarse sobre las patas traseras. Cada pata apoya sobre un sensor de presión que registra la fuerza aplicada por cada pata, permitiendo comparar la pata ipsilateral con la contralateral (51,61).
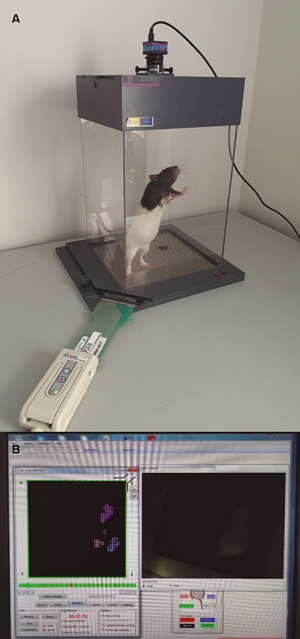
Fig. 5.
Evaluación del dolor espontáneo o dolor no evocado por un estímulo nociceptivo En humanos se puede cuantificar la percepción del dolor espontáneo preguntando directamente al paciente y utilizando diversas escalas de dolor que lo valoran desde la ausencia de dolor a un valor máximo (62,63). Lógicamente, este proceder es inviable en animales, sin embargo, existen métodos indirectos que nos permiten obtener información sobre la percepción de este tipo de dolor (64). Para ello podemos utilizar el test de excavación, el test de construcción del nido y la evaluación de la actividad motora.
Estos test se han mostrado eficaces para la evaluación del dolor espontáneo y reflejan de manera más fiable, la situación clínica de los pacientes, aumentando por ello la validez de los modelos preclínicos de dolor (65).
- El test de excavar, Burrowing test, o el test de construcción del nido, Nest contruction test. Excavar y construir nidos son comportamientos naturales en los roedores que se han empleado como herramienta para evaluar el dolor espontáneo en roedores y han sido útiles en modelos de OA e inflamación inducida por adyuvante completo de Freund (CFA) en ratas (66). Este tipo de comportamiento, con un fuerte componente motivacional, se reduce cuando los animales tienen dolor (67,68).
Para evaluar el comportamiento de burrowing, se introduce un tubo lleno de material, que puede ser comida, viruta de madera, arena, etc., que estará sellado por un extremo y abierto por el otro, con cierta elevación de la parte abierta para evitar que se vacíe espontáneamente. Tras varios entrenamientos, durante el test, se medirá la cantidad de material que es extraída del tubo en un periodo de tiempo determinado, debiendo observarse una reducción en los animales con dolor (51).
En el test de construcción del nido, tras la introducción del material, se evaluará la labor realizada durante 24 horas en varios puntos temporales y se le aplicará la siguiente escala, si el animal no toca el material, se asigna el valor 0, si solo deshace el material 1; si realizar una construcción imperfecta 2 y si realiza una construcción perfecta 3. Los animales con dolor construirán nidos de peor calidad asociados a una altura menor.
- Test de preferencia de plaza. Aunque este test se usa tradicionalmente para estudios del sistema de recompensa, también se pueden emplear para la evaluación del dolor espontáneo y la eficacia analgésica de fármacos en modelos animales de OA (69). Básicamente consiste en asociar un contexto a un refuerzo positivo o negativo, de manera que el animal estará motivado para buscar este contexto, si el refuerzo es positivo o evitarlo si el refuerzo es negativo. Cuando empleamos este test para evaluar un tratamiento, el animal generará una preferencia de lugar asociada a la administración del fármaco, gracias a las propiedades reforzadoras del alivio nociceptivo. Esta asociación se observará únicamente en aquellos animales que sufren dolor y no en animales control (70). El dispositivo para realizar el test o caja de condicionamiento de plaza (CPP) consiste en dos compartimentos de diferente color (blanco/negro) e igual tamaño y uno central que conecta los otros dos, de color gris (Figura 6). El procedimiento consiste en realizar varias sesiones de precondicionamiento, una sesión de condicionamiento donde se asocia el fármaco a uno de los compartimentos y finalmente el test, donde se registra durante 15 minutos el tiempo que el animal permanece en cada uno de los dos compartimentos (71).
- Evaluación de la actividad motora general, exploración y emotividad. En animales con OA se ha observado una alteración en los patrones de comportamiento asociados a estados de dolor. Así, se ha observado aumento del lamido o rascado de la extremidad trasera, sacudidas del cuerpo o de la cabeza, espasmos de la cabeza, masticación sin propósito, reducción del aseo, reducción de la locomoción y reducción de la alimentación (11).
- Grimace Scales. Las escalas de dolor basadas en la expresión facial se emplean para evaluar el dolor en los niños cuando todavía no pueden expresarse verbalmente. En las últimas décadas se han desarrollado escalas similares para muchas de las especies domésticas, aunque fue en ratón donde se empezó a emplear (51). Se puede realizar la evaluación visualmente, aunque también existen sistemas automatizados que registran, analizan y cuantifican la posición de las orejas, la apertura del ojo, la protuberancia del hocico y la posición de los bigotes. En base a esta evaluación se cuantifica de 0 normal, 1 dolor moderado y 2 dolor severo (73). Aunque se ha comprobado su eficacia en rata para detectar dolor espontáneo inducido por inyección intrarticular de carragenina o inyección intraplantar de (CFA), existen determinadas experiencias nociceptivas que no producen un cambio en la expresión facial, como sucede frente a estímulos nociceptivo de corta duración o los modelos animales de dolor neuropático a largo plazo. Por ello su aplicación más extendida es como herramienta para evaluar el bienestar animal.

Fig. 6.

Fig. 7.
Evaluación del dolor mediante técnicas electrofisiológicas
El registro electrofisiológico permite estudiar la sensibilización de las vías aferentes nociceptivas de la articulación afectada mediante la cuantificación objetiva de la frecuencia de disparo de las neuronas que participan en esta vía, con o sin estímulo nociceptivo. Además, también nos permite el estudio de la sensibilización central mediante el registro de la actividad de las neuronas de la médula espinal a nivel de la asta dorsal, que suministran datos sobre la actividad neuronal y su plasticidad en modelos animales de OA (17,74).
CUESTIONES ÉTICAS
Lamentablemente, y ante la ausencia por ahora de otros métodos alternativos, para poder estudiar la OA tanto en su fisiopatología como posibilidades de tratamiento, se hace imprescindible investigar en animales vivos minimizando el daño en todo lo posible. De esta manera, el principio básico de la ética que debe dirigir la investigación con animales es que “los animales no serán sometidos a dolor, angustia o sufrimiento de manera innecesaria”. De esta forma solo podemos utilizar animales en investigación, si la finalidad de los procedimientos justifica su uso, siempre que no sea posible utilizar otros métodos o estrategias de ensayo científicamente satisfactorios y cuando el diseño experimental tenga en consideración minimizar al máximo los daños y sufrimientos que se infligen a los animales.
Estas premisas ya fueron recogidas en el principio ético de las “3 R” (Reemplazo, Reducción y Refinamiento)establecido por Russell y Burch en 1959 en su libro The principles of Humane Experimental Technique, y se han constituido en el pilar ético fundamental en experimentación animal. Asimismo, el principio de las “3 R” ha sido el principio inspirador en el desarrollo de los tratados internacionales y las normas legales nacionales que deben ser de obligado cumplimiento por todos los productores, suministradores y usuarios de animales de experimentación. Además, un trato humanitario en experimentación supone un prerrequisito para obtener éxito científico, ya que mientras mejores sean las condiciones en las que se encuentren los animales más fiables van a ser los resultados experimentales.
En la aplicación del reemplazo en los modelos animales de OA, los modelos celulares in vitro que disponemos están limitados prácticamente a la observación de mecanismos celulares concretos y aislados, por lo que no permiten reproducir un sistema complejo como es el sistema nervioso central ni su impacto multisistémico, ni su efecto sobre el comportamiento. Sin embargo, podemos utilizar estos modelos in vitro para avanzar en el conocimiento de las causas de la OA y la realización de estudios previos que permitan reducir el número de animales empleados (75). También podemos aplicar la reducción, si aumentamos la homogeneidad de los sujetos experimentales, de manera que podamos reducir el número de individuos, pero mantengamos la potencia estadística (76,77); igualmente importante es realizar una buena revisión bibliográfica para evitar duplicar experimentos y aumentar innecesariamente el uso de animales. Para disminuir la severidad de los procedimientos experimentales de dolor, es decir, aplicar el refinamiento, es fundamental elegir el modelo animal y las dosis de compuestos que nos permita obtener resultados con la menor severidad posible, así como planificar e implementar las hojas de supervisión de bienestar animal y criterios de punto final o endpoint humanitarios, que eviten sobrepasar los límites de sufrimiento admisibles en cada estudio.
Por otra parte, la sensibilidad y concienciación social en materia de bienestar animal en general, y con los animales de experimentación en particular, ha exigido que se promulguen normas legales que regulen este campo. En este sentido, la Unión Europea publicó la Directiva del Parlamento Europeo (2010/63/CE) y del Consejo, donde se recogen las normas de protección de los animales utilizados con fines científicos. Esta norma ha sido transpuesta a la normativa española mediante Real Decreto (RD 53/2013) que regula aspectos tales como la obligación del cumplimiento de los principios éticos de las “3 R”, las condiciones estructurales que deben cumplir los centros de cría y uso de animales de experimentación, la cualificación y capacitación que debe tener el personal que trabaje con estos animales, así como el procedimiento de evaluación ética y autorización de los proyectos de investigación que utilicen animales experimentación.
AGRADECIMIENTOS
Este manuscrito ha contado con información obtenida gracias a los Proyectos: “Fondo Europeo de Desarrollo Regional” (FEDER)-UE “Una manera de construir Europa” del Ministerio de Economía y Competitividad (MINECO: : RTI2018-099778-B-I00) y del Ministerio de Salud-Instituto de Salud Carlos III (PI18/01691); la “Consejería de Salud de la Junta de Andalucía (PI-0134-2018); del “Programa Operativo de Andalucía FEDER, Iniciativa Territorial Integrada ITI 2014-2020 Consejería Salud, Junta de Andalucía” (PI-0080-2017); Instituto de Investigación e Innovación en Ciencias Biomédicas de Cádiz (INiBICA LI19/06IN- CO22); la Consejería de Economía, Innovación, Ciencia y Empleo de la Junta de Andalucía (CTS-510), y el Centro de Investigación Biomédica en Red de Salud Mental-CIBERSAM (CB/07/09/0033).
BIBLIOGRAFÍA
- World Health Organization. Osteoarthritis. Chapter 6.12 [Internet]. In: Priority diseases and reasons for inclusion. Disponible en: https://www.who.int/medicines/areas/priority_medicines/prior_med_ch6_12/en/
- Haq I, Murphy E, Dacre J. Osteoarthritis. Postgrad Med J. 2003;79(933):377-83. DOI: 10.1136/pmj.79.933.377.
- Miller RE, Malfait AM. Osteoarthritis pain: What are we learning from animal models? Best Pract Res Clin Rheumatol. 2017;31(5):676-87. DOI: 10.1016/j.berh.2018.03.003.
- Global Burden of Disease Study 2013 Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015;386(9995):743-800. DOI: 10.1016/S0140-6736(15)60692-4.
- Laupattarakasem W, Laopaiboon M, Laupattarakasem P, Sumananont C. Arthroscopic debridement for knee osteoarthritis. Cochrane Database Syst Rev. 2008;(1):CD005118. DOI: 10.1002/14651858.CD005118.pub2.
- Malfait AM, Schnitzer TJ. Towards a mechanism-based approach to pain management in osteoarthritis. Nat Rev Rheumatol. 2013;9(11):654-64. DOI: 10.1038/nrrheum.2013.138.
- Crichton B, Green M. GP and patient perspectives on treatment with non-steroidal anti-inflammatory drugs for the treatment of pain in osteoarthritis. Curr Med Res Opin. 2002;18(2):92-6. DOI: 10.1185/030079902125000345.
- Matthews GL. Disease modification: promising targets and impediments to success. Rheum Dis Clin North Am. 2013;39(1):177-87. DOI: 10.1016/j.rdc.2012.10.006.
- Haviv B, Bronak S, Thein R. The complexity of pain around the knee in patients with osteoarthritis. Sat. 2013;5(4):178-81.
- Teeple E, Jay GD, Elsaid KA, Fleming BC. Animal models of osteoarthritis: challenges of model selection and analysis. AAPS J. 2013;15(2):438-46. DOI: 10.1208/s12248-013-9454-x.
- Piel MJ, Kroin JS, van Wijnen AJ, Kc R, Im HJ. Pain assessment in animal models of osteoarthritis. Gene. 2014;537(2):184-8. DOI: 10.1016/j.gene.2013.11.091.
- N D’Souza W, Y Ng G, D Youngblood B, Tsuji W, G Lehto S. A review of current animal models of osteoarthritis pain. Curr Pharm Biotechnol. 2011;12(10):1596-612. DOI: 10.2174/138920111798357320.
- McGonigle P, Ruggeri B. Animal models of human disease: challenges in enabling translation. Biochem Pharmacol. 2014;87(1):162-71. DOI: 10.1016/j.bcp.2013.08.006.
- Nestler EJ, Hyman SE. Animal models of neuropsychiatric disorders. Nat Neurosci 2010;13(10):1161-9. DOI: 10.1038/nn.2647.
- Brown DC. What can we learn from osteoarthritis pain in companion animals? Clin Exp Rheumatol 2017;107(5):53-8.
- McCoy AM. Animal models of osteoarthritis: comparisons and key considerations. Vet Pathol. 2015;52(5):803-18. DOI: 10.1177/0300985815588611.
- O’Brien M, Philpott HT, McDougall JJ. Understanding osteoarthritis pain through animal models. Clin Exp Rheumatol. 2017;35 Suppl 107(5):47-52.
- Jimenez PA, Glasson SS, Trubetskoy OV, Haimes HB. Spontaneous osteoarthritis in Dunkin Hartley guinea pigs: histologic, radiologic, and biochemical changes. Comparative Med. 1997;47(6):598-601.
- Lampropoulou-Adamidou K, Lelovas P, Karadimas EV, Liakou C, Triantafillopoulos IK, Dontas I, et al. Useful animal models for the research of osteoarthritis. Eur J Orthop Surg Traumatol. 2014;24(3):263-71. DOI: 10.1007/s00590-013-1205-2.
- Vincent T. L., Williams R. O., Maciewicz R., Silman A., Garside P. for the Arthritis Research UK animal Models Working Group. Mapping pathogenesis of arthritis through small animal models. Rheumatology. 2012; 51(11), 1931-1941. DOI:10.1093/rheumatology/kes035.
- Staines KA, Poulet B, Wentworth DN, Pitsillides AA. The STR/ort mouse model of spontaneous osteoarthritis–an update. Osteoarthritis and cartilage. 2017;25(6):802-8. DOI: 10.1016/j.joca.2016.12.014.
- Berenbaum F, Griffin TM, Liu-Bryan R. Metabolic regulation of inflammation in osteoarthritis. Arthritis Rheum. 2017;69(1):9.
- Oliveria SA, Felson DT, Cirillo PA, Reed JI, Walker AM. Body weight, body mass index, and incident symptomatic osteoarthritis of the hand, hip, and knee. Epidemiology. 1999;10(2):161-6.
- Grotle M, Hagen KB, Natvig B, Dahl FA, Kvien TK. Obesity and osteoarthritis in knee, hip and/or hand: an epidemiological study in the general population with 10 years follow-up. BMC Musculoskelet Disord. 2008;9:132. DOI: 10.1186/1471-2474-9-132.
- Griffin TM, Fermor B, Huebner JL, Kraus VB, Rodriguiz RM, Wetsel WC, et al. Diet-induced obesity differentially regulates behavioral, biomechanical, and molecular risk factors for osteoarthritis in mice. Arthritis Res Ther. 2010;12(4):R130. DOI: 10.1186/ar3068.
- Ramzan I, Wong BK, Corcoran GB. Pain sensitivity in dietary-induced obese rats. Physiol Behav. 1993;54(3):433-5. DOI: 10.1016/0031-9384(93)90231-4.
- Okifuji A, Hare BD. The association between chronic pain and obesity. J Pain Res. 2015; 8:399-408. DOI: 10.2147/JPR.S55598.
- Zimmermann M. Ethical guidelines for investigations of experimental pain in conscious animals. Pain. 1983;16(2):109-10. DOI: 10.1016/0304-3959(83)90201-4.
- Bendele AM. Animal models of osteoarthritis. J Musculoskelet Neuronal Interact. 2001;1(4):363-76.
- Cope P. J., Ourradi K., Li Y., Sharif, M. Models of osteoarthritis: the good, the bad and the promising. Osteoarthr. Cartil. 2019; 27(2), 230-239. DOI: 10.1016/l.joca.2018.09.016
- Blaker CL, Clarke EC, Little CB. Using mouse models to investigate the pathophysiology, treatment, and prevention of post-traumatic osteoarthritis. J Orthop Res. 2017;35(3):424-39. DOI: 10.1002/jor.23343.
- Bove SE, Calcaterra SL, Brooker RM, Huber CM, Guzman RE, Juneau PL, et al. Weight bearing as a measure of disease progression and efficacy of anti-inflammatory compounds in a model of monosodium iodoacetate-induced osteoarthritis. Osteoarthritis Cartilage. 2003;11(11):821-30. DOI: 10.1016/s1063-4584(03)00163-8.
- Combe R, Bramwell S, Field MJ. The monosodium iodoacetate model of osteoarthritis: a model of chronic nociceptive pain in rats? Neurosci Lett. 2004;370(2-3):236-40. DOI: 10.1016/j.neulet.2004.08.023.
- McDougall JJ, Albacete S, Schuelert N, Mitchell PG, Lin C, Oskins JL, et al. Lysophosphatidic acid provides a missing link between osteoarthritis and joint neuropathic pain. Osteoarthritis Cartilage. 2017;25(6):926-34. DOI: 10.1016/j.joca.2016.08.016.
- Mototani H, Iida A, Nakajima M, Furuichi T, Miyamoto Y, Tsunoda T, et al. A functional SNP in EDG2 increases susceptibility to knee osteoarthritis in Japanese. Hum Mol Genet. 2008;17(12):1790-7. DOI: 10.1093/hmg/ddn069.
- Rüger B, Giurea A, Wanivenhaus AH, Zehetgruber H, Hollemann D, Yanagida G, et al. Endothelial precursor cells in the synovial tissue of patients with rheumatoid arthritis and osteoarthritis. Arthritis Rheum. 2004;50(7):2157-66. DOI: 10.1002/art.20506.
- Weng LH, Ko JY, Wang CJ, Sun YC, Wang FS. Dkk-1 promotes angiogenic responses and cartilage matrix proteinase secretion in synovial fibroblasts from osteoarthritic joints. Arthritis Rheum. 2012;64(10):3267-77. DOI: 10.1002/art.34602.
- Little CB, Hunter DJ. Post-traumatic osteoarthritis: from mouse models to clinical trials. Nat Rev Rheumatol. 2013;9(8):485-97. DOI: 10.1038/nrrheum.2013.72.
- Poole R, Blake S, Buschmann M, Goldring S, Laverty S, Lockwood S, et al. Recommendations for the use of preclinical models in the study and treatment of osteoarthritis. Osteoarthritis Cartilage. 2010;18:S10-S16. DOI: 10.1016/j.joca.2010.05.027.
- Kuyinu EL, Narayanan G, Nair LS, Laurencin CT. Animal models of osteoarthritis: classification, update, and measurement of outcomes. J Orthop Surg Res. 2016;11:19. DOI: 10.1186/s13018-016-0346-5.
- Christiansen BA, Guilak F, Lockwood KA, Olson SA, Pitsillides AA, Sandell LJ, et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 2015;23(10):1627-38. DOI: 10.1016/j.joca.2015.05.009.
- Gabriel AF, Honig WMM, Marcus MAE, Joosten EAJ. Measuring pain-induced gait adaptation: The CatWalk method. J Neurosci Methods. 2007;163(1):9-16. DOI: 10.1016/j.jneumeth.2007.02.003.
- Fernihough J, Gentry C, Malcangio M, Fox A, Rediske J, Pellas T, et al. Pain related behaviour in two models of osteoarthritis in the rat knee. Pain. 2004;112(1-2):83-93. DOI: 10.1016/j.pain.2004.08.004.
- Kang M, Jung I, Hur J, Kim SH, Lee JH, Kang JY, et al. The analgesic and anti-inflammatory effect of WIN-34B, a new herbal formula for osteoarthritis composed of Lonicera japonica Thunb and Anemarrhena asphodeloides BUNGE in vivo. J. Ethnopharmacol. 2010;131(2):485-96. DOI: 10.1016/j.jep.2010.07.025.
- Chaplan SR, Bach FW, Pogrel JW, Chung JM, Yaksh TL. Quantitative assessment of tactile allodynia in the rat paw. J. Neurosci. Methods. 1994;53(1):55-63. DOI: 10.1016/0165-0270(94)90144-9.
- Randall LO, Selitto J. A method for measurement of analgesic activity on inflamed tissues. Arch Int Pharmacodyn. 1957;111(4):409-19.
- Dubois MY, Gallagher RM, Lippe PM. Pain medicine position paper. Pain Med. 2009;10(6):972-1000. DOI: 10.1111/j.1526-4637.2009.00696.x.
- Driscoll C, Chanalaris A, Knights C, Ismail H, Sacitharan PK, Gentry C, et al. Nociceptive sensitizers are regulated in damaged joint tissues, including articular cartilage, when osteoarthritic mice display pain behavior. Arthritis Rheumatol. 2016;68(4):857-67. DOI: 10.1002/art.39523.
- Vonsy JL, Ghandehari J, Dickenson AH. Differential analgesic effects of morphine and gabapentin on behavioural measures of pain and disability in a model of osteoarthritis pain in rats. Eur J Pain. 2009;13(8):786-93. DOI: 10.1016/j.ejpain.2008.09.008.
- Woolfe G, MacDonald AD. The evaluation of the analgesic action of pethidine hydrochloride (Demerol). J Pharmacol Exp Ther. 1944;80(3):300-7.
- Deuis JR, Dvorakova LS, Vetter I. Methods used to evaluate pain behaviors in rodents. Front Mol Neurosci. 2017;10:284. DOI: 10.3389/fnmol.2017.00284.
- Espejo EF, Mir D. Structure of the rat’s behaviour in the hot plate test. Behav Brain Res. 1993;56(2):171-6. DOI: 10.1016/0166-4328(93)90035-o.
- Hargreaves K, Dubner R, Brown F, Flores C, Joris J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain. 1988;32(1):77-88. DOI: 10.1016/0304-3959(88)90026-7.
- Deuis JR, Vetter I. The thermal probe test: A novel behavioral assay to quantify thermal paw withdrawal thresholds in mice. Temperature. 2016;3(2):199-207. DOI: 10.1080/23328940.2016.1157668.
- Carlton SM, Lekan HA, Kim SH, Chung JM. Behavioral manifestations of an experimental model for peripheral neuropathy produced by spinal nerve ligation in the primate. Pain. 1994;56(2):155-66. DOI: 10.1016/0304-3959(94)90090-6.
- Jacobs BY, Kloefkorn HE, Allen KD. Gait analysis methods for rodent models of osteoarthritis. Curr Pain Headache Rep. 2014;18(10):456. DOI: 10.1007/s11916-014-0456-x.
- Griffioen MA, Dernetz VH, Yang GS, Griffith KA, Dorsey SG, Renn CL. Evaluation of dynamic weight bearing for measuring non evoked inflammatory hyperalgesia in mice. Nurs Res. 2015;64(2):81-7. DOI: 10.1097/NNR.0000000000000082.
- Berryman ER, Harris RL, Moalli M, Bagi CM. Digigait quantitation of gait dynamics in rat rheumatoid arthritis model. J Musculoskelet Neuronal Interact. 2009;9(2):89-98.
- Parvathy SS, Masocha W. Gait analysis of C57BL/6 mice with complete Freund’s adjuvant-induced arthritis using the CatWalk system. BMC Musculoskelet Disord. 2013;14(1):14. DOI: 10.1186/1471-2474-14-14.
- Adams BL, Guo W, Gors RT, Knopp KL. Pharmacological interrogation of a rodent forced ambulation model: leveraging gait impairment as a measure of pain behaviour pre-clinically. Osteoarthritis Cartilage. 2016;24(11):1928-39. DOI: 10.1016/j.joca.2016.05.022.
- Schött E, Berge OG, Ängeby-Möller K, Hammarström G, Dalsgaard CJ, Brodin E. Weight bearing as an objective measure of arthritic pain in the rat. J Pharmacol Toxicol Methods. 1994;31(2):79-83. DOI: 10.1016/1056-8719(94)90046-9.
- Gaston-Johansson F, Albert M, Fagan E, Zimmerman L. Similarities in pain descriptions of four different ethnic-culture groups. J. Pain Symptom Manage. 1990;5(2):94-100. DOI: 10.1016/s0885-3924(05)80022-3.
- Wibbenmeyer L, Sevier A, Liao J, Williams I, Latenser B, Lewis 2nd R, et al. Evaluation of the usefulness of two established pain assessment tools in a burn population. J Burn Care Res. 2011;32(1):52-60. DOI: 10.1097/BCR.0b013e3182033359.
- Tappe-Theodor A, Kuner R. Studying ongoing and spontaneous pain in rodents–challenges and opportunities. Eur J Neurosci. 2014;39(11):1881-90. DOI: 10.1111/ejn.12643.
- Mogil JS. Animal models of pain: progress and challenges. Nat. Rev. Neurosci. 2009;10(4):283-94. DOI: 10.1038/nrn2606.
- Jirkof P, Cesarovic N, Rettich A, Nicholls F, Seifert B, Arras M. Burrowing behavior as an indicator of post-laparotomy pain in mice. Front Behav Neurosci. 2010;4:165. DOI: 10.3389/fnbeh.2010.00165.
- Bryden LA, Nicholson JR, Doods H, Pekcec A. Deficits in spontaneous burrowing behavior in the rat bilateral monosodium iodoacetate model of osteoarthritis: an objective measure of pain-related behavior and analgesic efficacy. Osteoarthritis Cartilage. 2015;23(9):1605-12. DOI: 10.1016/j.joca.2015.05.001.
- Deacon RM. Burrowing in rodents: a sensitive method for detecting behavioral dysfunction. Nat Protoc. 2006;1(1):118-21. DOI: 10.1038/nprot.2006.19.
- Liu P, Okun A, Ren J, Guo R, Ossipov MH, Xie J, King T, Porreca F, et al. Ongoing pain in the MIA model of osteoarthritis. Neurosci Lett. 2011;493(3):72-5. DOI: 10.1016/j.neulet.2011.01.027.
- Navratilova E, Porreca F. Reward and motivation in pain and pain relief. Nat Neurosci. 2014;17(10):1304-12. DOI: 10.1038/nn.3811.
- King T, Vera-Portocarrero L, Gutierrez T, Vanderah TW, Dussor G, Lai J, et al. Unmasking the tonic-aversive state in neuropathic pain. Nat Neurosci. 2009;12(11):1364-6. DOI: 10.1038/nn.2407.
- Brodkin J, Frank D, Grippo R, Hausfater M, Gulinello M, Achterholt N, et al. Validation and implementation of a novel high-throughput behavioral phenotyping instrument for mice. J Neurosci Methods. 2014;224:48-57. DOI: 10.1016/j.jneumeth.2013.12.010.
- Langford DJ, Bailey AL, Chanda ML, Clarke SE, Drummond TE, Echols S, et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 2010;7(6):447-9. DOI: 10.1038/nmeth.1455.
- Schuelert N, McDougall JJ. Grading of monosodium iodoacetate-induced osteoarthritis reveals a concentration-dependent sensitization of nociceptors in the knee joint of the rat. Neurosci. Lett. 2009;465(2):184-8. DOI: 10.1016/j.neulet.2009.08.063.
- Johnson CI, Argyle DJ, Clements DN. In vitro models for the study of osteoarthritis. Vet J. 2016;209:40-9. DOI: 10.1016/j.tvjl.2015.07.011.
- Dell RB, Holleran S, Ramakrishnan R. Sample size determination. ILAR J. 2002;43(4):207-13. DOI: 10.1093/ilar.43.4.207.
- Festing MF, Altman DG. Guidelines for the design and statistical analysis of experiments using laboratory animals. ILAR J. 2002;43(4):244-58. DOI: 10.1093/ilar.43.4.244.







