DOI: 10.20986/resed.2021.3932/2021
ORIGINAL
RECOMENDACIONES CLÍNICAS PARA LA REHABILITACIÓN DE PERSONAS CON FIBROMIALGIA. UNA REVISIÓN NARRATIVA
CLINICAL RECOMMENDATIONS FOR REHABILITATION OF PEOPLE WITH FIBROMYALGIA. A NARRATIVE REVIEW
I. Cuyul-Vásquez1
M. Contreras Fuentes2
R. Ordoñez Vega3
P. Neira Stegmaier1
N. Maragaño Campistó4
A. Rodríguez Alvarado5
1Departamento de Procesos terapéuticos. Facultad de Ciencias de la Salud. Universidad Católica de Temuco, Chile
2Programa de Integración Escolar. Colegio el Refugio. Penco, Chile
3Sala de Rehabilitación. CESFAM San Vicente. Talcahuano, Chile
4Servicio de Kinesiología. Clínica Los Conquistadores. Santiago, Chile
5Centro del Dolor. Las Condes. Santiago, Chile
RESUMEN
Introducción: La evidencia actual sugiere como primera línea de tratamiento para personas con fibromialgia al manejo no farmacológico. Sin embargo, revisiones con énfasis en la aplicabilidad clínica son escasas.
Objetivo: Describir recomendaciones clínicas basadas en evidencia para la rehabilitación de personas con fibromialgia.
Métodos: Se realizaron búsquedas electrónicas en las bases de datos Medline, Web of Science y Scielo para cada uno de los apartados de esta revisión. Diferentes estrategias de búsqueda fueron realizadas con la combinación de términos MESH y claves. Se incluyeron estudios primarios y secundarios publicados en inglés o español en revistas revisadas por pares.
Resultados: Los profesionales de la salud deben conocer aspectos teóricos contemporáneos del dolor crónico y de la fibromialgia con el fin de evitar el sobrediagnóstico, la estigmatización y la persistencia de los síntomas por instrucción profesional. Una evaluación clínica multidimensional en un contexto positivo, con énfasis en la construcción de alianza terapéutica, facilita la toma de decisiones compartidas y la selección de estrategias de intervención. La educación es el punto de inicio de la rehabilitación y su combinación con terapia psicológica, facilita el afrontamiento activo y la adherencia terapéutica. La actividad física y el ejercicio regular son las intervenciones no farmacológicas con mayor evidencia para mejorar el dolor, discapacidad, calidad de vida, función física, fatiga, fuerza muscular, rigidez, sueño y el estado de ánimo en personas con fibromialgia.
Conclusión: Los abordajes no farmacológicos son prometedores en el manejo de la fibromialgia. Esta revisión aporta recomendaciones prácticas para la implementación clínica por equipos de salud interdisciplinarios.
Palabras clave: Dolor crónico, fibromialgia, educación en salud, rehabilitación, terapia por ejercicio.
ABSTRACT
Introduction: Current evidence suggests non-pharmacological management as the first line of treatment for people with fibromyalgia. However, reviews with an emphasis on clinical applicability are rare.
Objective: To describe evidence-based clinical recommendations for the rehabilitation of people with Fibromyalgia.
Methods: Medline, Web of Science and, Scielo databases were electronically searched for each of the sections of this review. Different search strategies were carried out with the combination of MESH terms and keywords. Primary and secondary studies published in English or Spanish in peer-reviewed journals were included.
Results: Health professionals must know contemporary theoretical aspects of chronic pain and fibromyalgia to avoid overdiagnosis, stigmatization, and persistence of symptoms by professional instruction. A multidimensional clinical assessment with objective and subjective evaluations in a positive context with an emphasis on the construction of a therapeutic alliance facilitates shared decision-making and the selection of successful intervention strategies. Education is the starting point of rehabilitation and its combination with psychological therapy, facilitates active coping and therapeutic adherence. Physical activity and regular exercise are the most evidenced non-pharmacological interventions for improving pain, disability, quality of life, physical function, fatigue, muscle strength, stiffness, sleep, and mood in people with fibromyalgia.
Conclusion: Non-pharmacological approaches are promising in the management of fibromyalgia. This review provides practical recommendations for clinical implementation by interdisciplinary health teams.
Keywords: Chronic pain, fibromyalgia, health education, rehabilitation, exercise therapy.
Recibido: 16-06-2021
Aceptado: 23-09-2021
Correspondencia: Iván Cuyul-Vásquez
icuyul@uct.cl
INTRODUCCIÓN
La fibromialgia (FM) es una condición de dolor crónico primario que habitualmente se acompaña de alteraciones cognitivas y psicológicas, trastornos del sueño-vigilia, fatiga y limitación funcional (1,2). La prevalencia de la FM en la población mundial es heterogénea y varía entre el 0,2 y el 6,6 % (3). En este sentido, se ha estimado que por cada cuatro mujeres diagnosticadas con FM, un hombre padece la condición (4). Sin embargo, la presencia de sesgos de selección en la investigación del área ha suscitado la subestimación de las tasas de prevalencia en hombres y el sobrediagnóstico en mujeres (5).
La FM es una etiqueta diagnóstica que está acompañada de creencias de la sociedad y de los profesionales de salud que favorecen la estigmatización, el sobrediagnóstico y limitan la respuesta al tratamiento (6). Es más, la investigación cualitativa ha demostrado que la FM es una etiqueta diagnóstica que no confiere significado y legitimidad a las experiencias de los pacientes e, incluso, puede generar mayor incertidumbre (7). Por este motivo, es primordial considerar el lenguaje que los profesionales de salud utilizan respecto a las etiquetas y conceptos que podrían generar angustia, incertidumbre y miedo. El diagnóstico de la FM es clínico y los criterios de la American College of Rheumatology (ACR) de 2016 han demostrado propiedades psicométricas aceptables (8).
La rehabilitación de personas con FM es un desafío para los clínicos, especialmente, porque no hay consenso respecto a su etiología y patogénesis. La sensibilización central (SC) y la neuroinflamación son los mecanismos explicativos más conocidos y aceptados por la comunidad científica para explicar el dolor nociplástico y la FM (9,10). La SC es un fenómeno de plasticidad sináptica que induce hiperactividad neuronal e hiperexcitabilidad del sistema nervioso central (SNC) (10). La SC se caracteriza por una alteración en la modulación endógena inhibitoria y facilitadora de la nocicepción (11). Por otro lado, la neuroinflamación cursa con cambios vasculares con aumento de la permeabilidad, infiltración de leucocitos, activación de células gliales y producción de mediadores inflamatorios en el SNC (10). Síntomas como la alodinia, la hiperalgesia, los dolores de cabeza, la fatiga, el intestino irritable y los problemas del sueño pueden explicarse a través de los fenómenos de SC y neuroinflamación (10,12). Sin embargo, el uso de estos términos en el encuentro terapéutico es controversial (13). También se ha demostrado que los eventos adversos en la vida, las creencias y el riesgo psicosocial, influyen en el desarrollo, persistencia y sufrimiento del cuadro (14). Todo lo anterior justifica la necesidad de un abordaje multimodal e integral centrado en la persona con FM y su contexto.
Las recomendaciones de la Liga Europea Contra el Reumatismo sugieren como intervención de primera línea para el tratamiento de la FM el manejo no farmacológico (15). Por otro lado, guías clínicas internacionales del manejo del dolor crónico destacan la importancia de considerar aspectos como la personalidad, factores contextuales, toma de decisiones compartidas, la alianza y adherencia terapéutica, además de estrategias de intervención como la educación, terapia de exposición, terapia psicológica, actividad física (AF) y ejercicio (15-19). Sin embargo, las guías de práctica clínica y las revisiones disponibles en español han presentado una limitada aplicabilidad, debido a la generalización de las recomendaciones clínicas. Por esta razón, el objetivo de esta revisión es describir recomendaciones clínicas basadas en evidencia para la rehabilitación de personas con FM.
MÉTODOS
Se realizaron búsquedas electrónicas en la base datos Medline, Web of Science y Scielo para cada uno de los apartados de esta revisión. Diferentes estrategias de búsqueda fueron realizadas con la combinación de términos MESH y claves. Los términos clave ‘fibromyalgia’ y ‘chronic pain’ fueron combinados con términos como: ‘Rehabilitation’, ‘Therapeutic Alliance’, ‘Adherence’, ‘Exercise’, ‘Physical Activity’ ‘Outcome Measure’, ‘Personality’, ‘Physical Performance’, ‘Physical Function’ ‘Decision Making, Shared’, ‘education’, ‘Mind-Body Therapies’, ‘Psychotherapy’, ‘Cognitive Behavioral Therapy’, ‘Exposure Therapy’, ‘Gradual Exposure’, ‘Acceptance and Commitment Therapy’. Se incluyeron estudios primarios y secundarios publicados en inglés o español en revistas revisadas por pares. Se excluyeron estudios de casos, casos clínicos y cartas al editor.
Perfil de personalidad
La investigación de la personalidad en personas con FM es compleja, heterogénea y no concluyente. Los estudios de la personalidad y su relación con las manifestaciones clínicas son escasos. Sin embargo, el modelo teórico de los “cinco factores” ha permitido el estudio de la personalidad en personas con dolor crónico. Dicho modelo describe las diferencias individuales en la personalidad a través de cinco factores: neuroticismo, extraversión, apertura de la experiencia, agradabilidad y conciencia (20). Desde esta perspectiva, se ha observado que el neuroticismo solo juega un papel menor en las manifestaciones clínicas de FM y la extraversión parece ejercer una influencia protectora general, más que específica (21). Incluso, se ha reportado que no existen diferencias en los perfiles de personalidad de las personas con FM en comparación con otros pacientes con dolor crónico o una enfermedad crónica no dolorosa (22). Sin embargo, un subgrupo con menor extraversión, mayores problemas psicosociales y mayor neuroticismo, ha reportado un peor estado clínico previo al tratamiento (22). Otros estudios concluyeron que sí existe especificidad en las características de personalidad y psicopatología (23)en personas que refieren mayores niveles de ansiedad, pesimismo, malestar emocional con baja autoestima y exceso de control emocional (23,24).
Por otro lado, las personas con FM se describen como poco sociables (24), a pesar de caracterizarse por una marcada tendencia a la complacencia social o agradabilidad. Es decir, buscan agradar al otro, en desmedro de sí mismos, sobrexigéndose (25-27). Las personas con FM se consideran activas, aunque esta característica a nivel clínico no es lo esperable de una enfermedad que cursa con fatiga persistente y dolor crónico generalizado (24). Además, factores personales protectores, como la capacidad de aceptación y la persistencia, se han descrito como un fenotipo resistente en FM (28).
Factores contextuales y alianza terapéutica
La investigación contemporánea ha demostrado que la manipulación consciente de los factores contextuales de la atención de salud son una oportunidad para maximizar resultados clínicos en personas con dolor (29). En este sentido, toda atención en salud se desarrolla en un espacio relacional influenciado por factores contextuales, los cuales incluyen a la alianza terapéutica (AT), las características del profesional, las características de la persona, el entorno clínico y el tratamiento utilizado (29). Los factores contextuales han sido sugeridos como los responsables de gatillar efecto placebo (el cual puede maximizar los efectos hipoalgésicos de una intervención), y efecto nocebo (que puede disminuir la respuesta hipoalgésica o generar hiperalgesia), mediante componentes no específicos de las intervenciones (30).
En particular, la AT es un factor contextual del encuentro clínico que describe la calidad de la relación entre el paciente y el profesional de la salud (31). Estudios en personas con dolor musculoesquelético han demostrado que una AT positiva puede mejorar los resultados de la rehabilitación (16,32). Además, la AT parece influir sobre el nivel de precisión diagnóstica, la seguridad clínica (33), la satisfacción usuaria (34) y la adherencia terapéutica (35). Por lo tanto, el fomento de una AT positiva podría cumplir un rol fundamental en la rehabilitación de personas con FM, dado el perfil clínico que estas personas presentan. Por lo tanto, el profesional de la salud debe escuchar activamente y responder de manera empática, asertiva y sin juzgar el relato de la persona (36,37). Los clínicos deben mostrar una actitud segura y honesta en el trato, ser conscientes que la comunicación verbal, paraverbal (tono de voz y velocidad de habla) y no verbal (disposición corporal, contacto visual y expresión facial) pueden influenciar respuestas clínicas, actitudes o creencias en la persona e influir directamente en la AT (38). De esta manera, una AT positiva ayuda a generar un espacio intersubjetivo de mutuo respeto y entendimiento, que facilita la expresión y validación de la persona con FM. De esta manera, una AT positiva también favorece la recopilación de información para la toma de decisiones y personalización del tratamiento (39).
Entrevista clínica y valoración funcional
La entrevista clínica es un proceso complejo, flexible y dinámico (17). Facilita la recolección de información sobre los problemas principales de la persona con FM. Para este propósito se deben considerar factores físicos, emocionales, cognitivos, sociales y estilos de vida que podrían influir en la funcionalidad, discapacidad y perpetuación de la experiencia dolorosa (40). En lo práctico, se sugiere comenzar la entrevista con preguntas abiertas que permitan conocer cómo las personas con FM le dan sentido a su condición y experiencia, mientras el clínico puede empatizar, escuchar activamente y responder con asertividad (41). El uso de preguntas directas o cerradas se recomienda solo para corroborar datos (41). Además, el clínico debe desarrollar la habilidad para identificar cuándo es pertinente utilizar una pregunta abierta o cerrada.
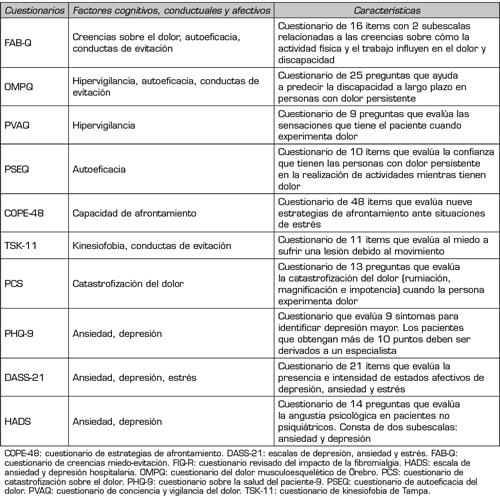
Respecto al uso de medidas de resultados, el Cuestionario de Impacto de la Fibromialgia (FIQ-R) es un instrumento de 21 preguntas, válido para evaluar la funcionalidad, el impacto general y los síntomas de la FM (42). Por otro lado, el Cuestionario SF-36 es una herramienta de uso común para medir la calidad de vida relacionada con la salud (CVRS) (1). El SF-36 consta de 36 preguntas que valoran ocho dominios: función física, rol físico, dolor, salud general, vitalidad, función social, rol emocional y salud mental (43). En la Tabla I se presentan otros cuestionarios que podrían ser útiles para la evaluación en personas con FM.
En relación con la evaluación funcional, las personas con FM habitualmente presentan comportamiento sedentario con bajos niveles de AF (51), lo que influye negativamente en su condición física y funcionalidad (52). En este sentido, se ha observado que una mejor condición física se asocia con menor severidad de síntomas (53); y una menor fuerza muscular está asociada con menor calidad de vida y mayor sintomatología ansioso-depresiva (54). Por lo tanto, la evaluación objetiva de la condición física es necesaria para la planificación de la intervención, especialmente porque la evaluación subjetiva a través del autorreporte puede estar sesgada por los niveles de catastrofización (55). La Tabla II muestra pruebas funcionales para evaluar la condición física en personas con FM.
Tabla I. Cuestionarios para la evaluación de factores cognitivos, conductuales y emocionales en la entrevista clínica de personas con FM (37,40,44-50)

Toma de decisiones compartidas
La toma de decisiones compartidas (TDC) se define como un proceso clínico en el cual terapeuta y paciente participan de manera colaborativa para tomar una decisión relacionada a la salud (62). Los profesionales de la salud deben considerar que los abordajes paternalistas pueden actuar como barrera para la TDC, influenciar negativamente la adherencia al tratamiento y poner en riesgo los resultados de la terapia (63). La TDC requiere considerar lo que para la persona con FM es valioso, sus preferencias y circunstancias individuales (64). La satisfacción de los pacientes con el cuidado que reciben depende fuertemente de si sus expectativas han sido cumplidas y de si sus preferencias han sido tomadas en cuenta (65). Respecto a esto, se ha demostrado que considerar las preferencias del paciente puede mejorar la adherencia a la terapia, el sentido de autonomía y la satisfacción con las decisiones tomadas (66). Sin embargo, las preferencias de cada persona pueden variar ampliamente y por eso el clínico debe individualizar el cuidado (66). La clave es poder integrar la perspectiva de la persona en el proceso (67). La TDC es un proceso esencialmente relacional que busca preparar a la persona con FM para la rehabilitación. Esto exige que los profesionales de la salud posean habilidades de comunicación efectiva, además de conocer los resultados de la evidencia científica en el área para poder consensuar el uso de estrategias de intervención efectivas y personalizadas (Tabla III).
Tabla II. Pruebas funcionales para evaular la condición física en personas con FM (52,56-61)
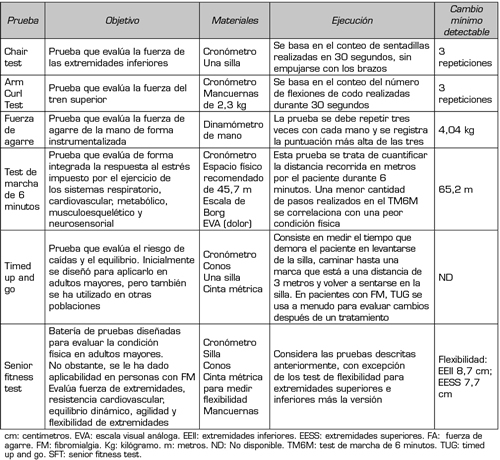
Tabla III. Ejercicio y toma de decisiones compartidas en personas con FM

Adherencia terapéutica
La adherencia terapéutica se define como la medida en la que el comportamiento y las acciones del paciente coinciden con las recomendaciones del profesional de la salud (68). Por ejemplo, en personas con FM el ejercicio es una de las intervenciones no-farmacológicas de primera línea (69-71) y se considera adherencia al ejercicio satisfactoria cuando el paciente alcanza niveles de cumplimiento > 80 % de la dosis recomendada (72).
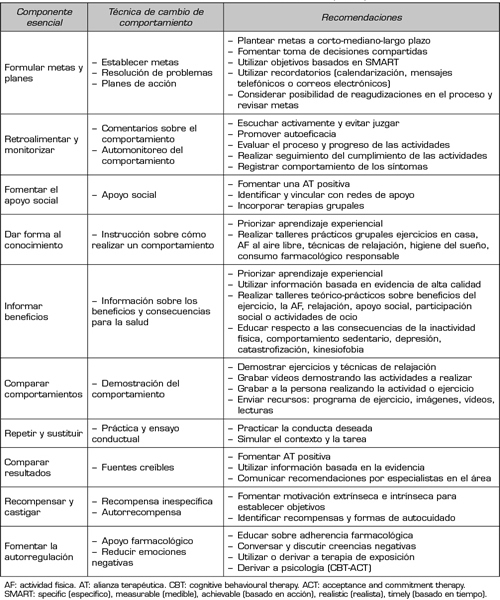
Se ha observado que niveles altos de adherencia al ejercicio pueden facilitar una mejora sostenible de la capacidad física, los síntomas y la calidad de vida a largo plazo (73,74). Por otro lado, el clínico debe considerar que la AT y los factores psicosociales han demostrado ser predictores del nivel de adherencia terapéutica de las personas con FM (75). Además, los niveles de adherencia al ejercicio dependen del nivel de autoeficacia frente al dolor (76,77), la cual se define como la creencia en las capacidades personales para manejar y realizar una tarea específica a pesar del dolor (68). Los clínicos pueden fomentar la autoeficacia de diferentes formas, ya sea mediante maestría, modelamiento, persuasión verbal o educación de la respuesta corporal (68). El ejercicio progresivo y continuo, sumado al desarrollo de la tolerancia al esfuerzo y la mejora de las capacidades físicas, promueven la confianza para la actividad objetivo (78). Por otro lado, modelar implica un aprendizaje indirecto, donde el clínico u otros pacientes mediante ejercicios grupales son modelos a seguir, lo que genera un entorno seguro y enriquecido de aprendizaje social (78). También se puede usar retroalimentación positiva mientras se ejecuta la actividad o al comentar los beneficios y efectos del tratamiento (78). La Tabla IV resume recomendaciones clínicas para mejorar la adherencia al ejercicio.
Tabla IV. Recomendaciones clínicas para fomentar la adherencia al ejercicio y el automanejo en personas con FM (79-82)
Educación
La educación en salud se puede definir como cualquier combinación de experiencias de aprendizaje diseñadas para facilitar la adaptación de comportamientos que conduzcan a la salud y el bienestar (83). Además, la educación es una oportunidad para dar sentido a la condición del paciente y disminuir la incertidumbre que rodea a la etiqueta de FM (7). Conocer y discutir respecto a los factores biopsicosociales que influyen en la FM y relacionarlos con las percepciones, creencias y contextos de los pacientes facilita la identificación de oportunidades de intervención y de automanejo (84,85). Respecto a esto, se han observado resultados positivos en la autoeficacia y automanejo después de intervenciones educativas en programas multimodales de manejo del dolor crónico (86).
La educación debe tener como objetivo el fomentar el afrontamiento, la autoeficacia y el automanejo (82). Sin embargo, en etapas iniciales el foco debe orientarse a reducir la hipervigilancia, el miedo y la catastrofización (12). Para esto, el clínico debe considerar explorar las creencias de los pacientes con el fin de entregar información oportuna y atingente. El modelo de SC (12), y más reciente, el modelo del error evaluativo (87), pueden ser herramientas útiles para explicar los síntomas en personas con FM. El modelo de SC es frecuentemente utilizado en la educación en neurociencias del dolor (PNE) (12). Sin embargo, no será una explicación plausible para todos los pacientes, especialmente porque se ha observado que aproximadamente un 29 % de las personas con FM no cursan con SC (88). Como alternativa, el modelo del error evaluativo explica los estados de alerta y protección (dolor por ejemplo) no por un mal procesamiento de datos sensoriales, sino por el error evaluativo que inducen las creencias y expectativas acumuladas a largo de la vida (87). En este modelo, la instrucción profesional es habitualmente el gatillante de los estados de alerta y protección (87), lo que coincide con la evidencia del efecto nocebo (29,89). Recientemente, la combinación de ambos modelos en clínica ha demostrado mejorar la calidad de vida y los síntomas en personas con FM (90). La utilización clínica del modelo del error evaluativo es prometedora, pero necesita de mayor investigación.
Por otro lado, la PNE es una de las intervenciones educativas más estudiadas en personas con dolor crónico. En este sentido, la aplicación aislada de PNE ha demostrado no generar cambios en la intensidad del dolor y la discapacidad (91). Sin embargo, beneficios clínicos pequeños se observaron en variables como la kinesiofobia y la catastrofización (91). Incluso, los resultados de un reciente metanálisis muestran que los efectos de la PNE pueden deberse a fluctuaciones normales producto del tiempo cuando se ajustan los resultados a diferencias interindividuales en función de la discapacidad (92). La conceptualización teórica de la neurofisiología/neurobiología del dolor crónico que puede ofrecer el profesional puede favorecer el diálogo, la discusión y la reflexión, por lo que se sugiere combinar con sesiones de PNE grupal para maximizar la interacción (86,93).
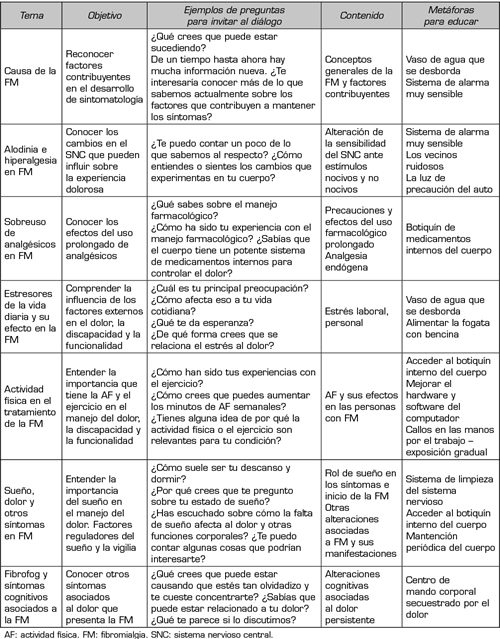
Por lo tanto, el contenido y desarrollo de la educación es persona-contexto-dependiente, por lo que el clínico debe disponer de sus conocimientos para dar sentido a un diálogo centrado en la experiencia del paciente (94). Si bien metáforas y ejemplos ayudan a mejorar el entendimiento, estas no deben ser el centro de la educación y deben ser consideradas como un complemento (95). La estrategia educativa deberá contemplar y adecuarse a la capacidad receptiva de cada persona y abarcará los principales factores que podrían estar influyendo en la condición. La Tabla V resume algunas temáticas, ejemplos y metáforas de una educación en FM.
Tabla V. Temas sugeridos de abordar en educación a la persona con FM
Actividad física
La AF está definida por la OMS como cualquier movimiento producido por el musculoesquelético que genere gasto de energía (96). Clínicamente, se ha demostrado que las personas con dolor crónico son menos activas, que aquellas sin dolor (97). Respecto a esto, un 80 % de las personas con FM no logra llegar al mínimo sugerido de 150 minutos de intensidad física moderada semanal, o 75 minutos de intensidad vigorosa (98). En consecuencia, se ha observado que el dolor crónico y los bajos niveles de AF aumentan el riesgo morbilidad, mortalidad precoz y mortalidad por todas las causas (99,100). En pacientes con FM, el tiempo sedentario se ha asociado con peor regulación del dolor, fatiga e impacto de la condición (101). Sin embargo, los profesionales de la salud no solo deben incentivar el desarrollo de AF en personas con FM para disminuir los síntomas o controlar las comorbilidades, sino para fomentar la participación social y los estilos de vida saludables. Para esto, se deben utilizar estrategias que fomenten un cambio de comportamiento en las personas con FM que sea sostenible en el tiempo.
Los profesionales de la salud deberían conocer las preocupaciones y barreras percibidas por las personas con FM, antes de fomentar el desarrollo de AF (102). Posteriormente, se debe informar a las personas de los beneficios que conlleva el aumento de los niveles AF en los síntomas, la función física, estado de ánimo, sueño y discapacidad (80). Por ejemplo, el fomento de la AF en personas con dolor musculoesquelético crónico ha demostrado reducir el dolor y la discapacidad (99). También, aumentar los niveles de AF puede generar beneficios multisistémicos en la salud (103), como la reducción del riesgo de desarrollar enfermedades cardiovasculares, obesidad, diabetes tipo 2, osteoporosis, cáncer de colon y cáncer de mama (104). Además, se ha reportado que reemplazar el tiempo sedentario con AF de intensidad ligera-moderada está asociado con mejorías en el dolor, vitalidad y funcionamiento social en personas con FM (101). Un estudio de cohorte longitudinal prospectivo de 9 años de seguimiento demostró que un grupo de personas con FM físicamente activas tiene mejores resultados en el dolor, impacto de la condición y presencia de puntos sensibles que un control inactivo (61).
Ejercicio físico
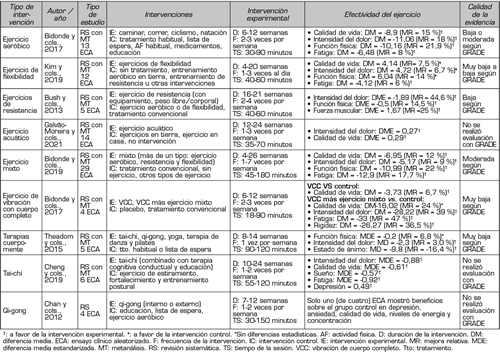
El ejercicio físico es un tipo de AF planificada, estructurada y repetida en el tiempo, con el propósito de adquirir, mantener o mejorar la condición física (99). Para la rehabilitación de personas con FM, el ejercicio es la intervención activa con mayor grado de recomendación (69). A pesar de que diferentes modalidades de ejercicio que han demostrado mejorar el dolor, discapacidad, calidad de vida, función física, fatiga, fuerza muscular, rigidez, sueño y el estado de ánimo en personas con FM, ninguna modalidad parece ser superior. Por lo tanto, para favorecer la adherencia al ejercicio se recomienda que el paciente escoja la modalidad a realizar con la asesoría del clínico (105). La Tabla VI muestra la efectividad de diferentes modalidades de ejercicio.
Respecto a la aplicabilidad clínica, inicialmente el terapeuta físico es quien debe adaptar e incorporar gradualmente los ejercicios de acuerdo con las características de cada persona (115). Sin embargo, también se debe incentivar progresivamente a las personas con FM a regular y planificar de manera autónoma sus rutinas de ejercicio y desarrollo de AF. El ejercicio se puede realizar con supervisión individual o grupal, e incluso de manera autónoma a través de programas de ejercicio domiciliario (18). Durante la realización del ejercicio no es necesario intensidades y volúmenes que generen sobresfuerzo, al punto de empeorar los síntomas. Frente a esta situación, los ejercicios de relajación postejercicio pueden ayudar a mejorar los síntomas (115). Además, se aconseja incluir ejercicios de áreas del cuerpo que no están afectadas, permitir un aumento leve del síntoma durante el ejercicio (pero evitar un incremento constante) y usar un abordaje basado en tiempo, por sobre el número de repeticiones (116). Si bien no hay una dosis clara, la mayoría de recomendaciones apuntan a realizar ejercicios 2 a 3 veces por semana por un mínimo de 30 minutos, por un periodo de 3 a 6 meses (117).
La persona con FM suele ser menos activa que una persona sana del mismo rango etario (118). Por esta razón, la musculatura podría ser una fuente de dolor postejercicio (119). Sin embargo, el dolor postejercicio es una respuesta inflamatoria normal, tanto en personas sanas como con alguna condición de salud, durante el proceso de reparación, adaptación y crecimiento muscular (119). Es común que algunos pacientes atribuyan la aparición de dolor postejercicio al empeoramiento de la condición o desarrollo de lesión (120). Por lo tanto, para mejorar la adherencia terapéutica es necesario educar respecto al dolor postejercicio antes de iniciar cualquier programa de ejercicio.
Tabla VI. Modalidades de ejercicio terapéutico y su efectividad en personas con FM (106-114)
Terapia psicológica
El rol de la psicología en la FM se puede desglosar desde dos especialidades. Por un lado, la psicología clínica trata junto con la psiquiatría los costos sanitarios del dolor (trastornos del ánimo depresivo y trastornos de ansiedad). Por otro lado, la psicología de la salud o médica con la subespecialidad del dolor que evalúa e interviene en los factores psicológicos que influyen en el dolor. En la FM, los efectos del tratamiento farmacológico son cuestionables y se recomienda tratamientos no farmacológicos, por lo cual toda persona con FM debería ser tratada psicológicamente de manera sincrónica junto con los demás abordajes terapéuticos (121). El abordaje de la FM debe ser interdisciplinario, ya que genera un efecto mayor en la discapacidad física, impacto psicosocial y depresión (121,122). Además, las intervenciones unimodales han demostrado ser insuficientes, por lo que debería primar el multicomponente o multimodalidad en cada abordaje(78,122).
En relación con el tipo de terapia psicológica, las terapias cognitivas conductuales (TCC) de la segunda y tercera generación cuentan con la mayor evidencia. Las TCC son efectivas en la reducción de factores de riesgo cognitivos como catastrofización elevada, creencias limitantes, baja autoeficacia y factores de riesgo afectivos, como baja aceptación, sentimiento de injusticia, emociones negativas (106,123-126). Dentro de las terapias de la tercera generación, como la de reducción del estrés basada en la atención plena, la terapia cognitiva basada en la atención plena y la terapia de aceptación y compromiso, son intervenciones prometedoras para las personas con FM, pero sus efectos en la salud son inciertos debido a resultados pequeños a moderados (122).
Terapia de exposición
La terapia de exposición es parte de las TCC y se enfoca en el afrontamiento durante el proceso de rehabilitación a situaciones específicas que provocan miedo (127,128). La terapia de exposición se basa en el modelo miedo-evitación (129) y la teoría del aprendizaje condicionado (130). Este marco teórico considera que el dolor y otros síntomas de la FM son mantenidos y exacerbados, en parte, por la evitación generalizada (131). La investigación respecto a la efectividad de la terapia de exposición en FM es emergente. En este sentido, se ha demostrado que la terapia de exposición vía internet mejora los síntomas, impacto de la FM, fatiga, discapacidad, calidad de vida, insomnio, depresión, ansiedad, comportamientos de evitación y angustia relacionada al dolor, en comparación a un grupo en lista de espera (132).
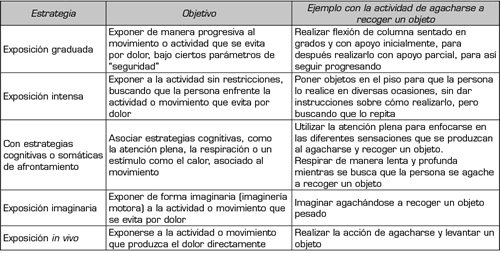
La terapia de exposición utiliza estímulos externos (actividades o movimientos) e internos (dolor y otras sensaciones corporales aversivas) para generar un afrontamiento repetido y sistemático (131). Además, la terapia de exposición se puede combinar con entrenamiento de la atención, específicamente a través del uso de la distracción para prevenir la evitación(131). El afrontamiento en la terapia se puede realizar de diferentes maneras: graduada o intensa, corta o prolongada, asociado o no a estrategias cognitivas o somáticas de afrontamiento, y de manera imaginaria, interoceptiva o in vivo (130). Se ha sugerido que la exposición también debe ser a estímulos y actividades relacionadas con el dolor, incluso si no se presenta miedo a ellas (132). Esto es debido a que la evitación y preocupación por los síntomas en la FM, podrían exacerbar los mismos (132). En la Tabla VII se dan ejemplos prácticos de la terapia de exposición en dolor crónico.
Tabla VII. Estrategias, objetivos y ejemplos del uso de la terapaia de exposición en el dolor crónico (133)
DISCUSIÓN
Esta revisión de la literatura tuvo como objetivo describir recomendaciones clínicas basadas en evidencia para la rehabilitación de personas con FM. En primer lugar, los profesionales de la salud deben conocer aspectos teóricos contemporáneos del dolor crónico y de la FM con el fin de evitar el sobrediagnóstico, la estigmatización y la persistencia de síntomas por instrucción profesional. Segundo, la evaluación clínica debe ser multidimensional e integrar evaluaciones objetivas y subjetivas en un contexto positivo con énfasis en la construcción de AT. Tercero, la TDC y la práctica basada en evidencia aumentan las probabilidades de escoger opciones de intervención exitosas. Cuarto, la educación es el punto de inicio de la rehabilitación y su combinación con terapia psicológica, facilita el afrontamiento activo y la adherencia terapéutica. Quinto, la AF y el ejercicio regular son las intervenciones no farmacológicas con mayor evidencia para mejorar el dolor, discapacidad, calidad de vida, función física, fatiga, fuerza muscular, rigidez, sueño y el estado de ánimo en personas con FM.
Las intervenciones no farmacológicas descritas en esta revisión presentan una oportunidad para mejorar la calidad de vida, salud, impacto económico y la polifarmacia de personas con FM, incluso el uso de opioides a largo plazo (69,134). Sin embargo, el uso de intervenciones no farmacológicas como tratamiento de primera línea exige que los profesionales del equipo de salud tengan un paradigma común que facilite la coordinación de sus acciones. Respecto a lo anterior, el currículo de la Asociación Internacional de Estudio del Dolor (IASP) describe que los profesionales deben integrar conceptos fundamentales actualizados sobre el dolor crónico que faciliten un lenguaje y una visión común del impacto del dolor en el paciente y la sociedad (135,136).
Además, los equipos de salud deberían conocer las necesidades de las personas con FM, identificar los roles y competencias de cada profesional, como también las formas de valoración y de intervención de cada uno (136,137). Asimismo, la IASP considera el abordaje del dolor como un derecho humano y describe que la abogacía, empatía, compasión, habilidades comunicacionales, colaboración, tratamiento ético, práctica basada en evidencia, reducción de las disparidades sanitarias, inclusión cultural y atención centrada en el paciente son valores y principios fundamentales que los equipos de salud deben desarrollar (136).
Por otro lado, las diferencias en los abordajes, recomendaciones y explicaciones que pueden existir por parte de los diferentes profesionales de un equipo de rehabilitación pueden facilitar el aumento de los síntomas y la discapacidad percibida a través del desarrollo de creencias catastrofistas y efecto nocebo (138). En este sentido, se ha demostrado que el lenguaje puede influir en los pensamientos y las acciones de los pacientes (89). Además, se debe considerar que la FM es una etiqueta que la sociedad ha estigmatizado y a la cual se le ha asignado una serie de creencias negativas que también pueden influir en el agravamiento de la sintomatología (6,139). Por lo tanto, evitar el sobrediagnóstico y el efecto nocebo por instrucción profesional son requisitos mínimos antes de iniciar la rehabilitación.
La rehabilitación de personas con FM no debe centrarse solo en el manejo y automanejo efectivo del dolor, sino también en la mejora de la funcionalidad, participación social, estilos de vida saludable y sufrimiento (140). Además, intervenciones individuales presenciales o a través de telerrehabilitación se pueden enriquecer con actividades grupales, las cuales podrían ser apropiadas dependiendo de las características de la persona con FM (intensidad del dolor, apoyo social, nivel de deterioro físico y mental, niveles de autoeficacia, depresión y AF) (141-143). Sin embargo, todo lo anterior puede implicar un cambio importante en el funcionamiento del equipo de salud. Por este motivo, se sugiere el desarrollo de actividades de capacitación a través de tutorías personalizadas con equipos que tengan experiencia en el abordaje interdisciplinario de personas con dolor crónico (144,145).
Limitaciones
Los resultados de esta revisión se deben considerar con precaución. Limitaciones como la ausencia de una búsqueda sistemática e independiente, como también la no valoración de la calidad metodológica, son aspectos que considerar previo a la aplicabilidad clínica de las recomendaciones.
CONFLICTO DE INTERESES
Los autores declaran que no tienen ningún conflicto de intereses potencial con respecto a la investigación, autoría y/o publicación de este artículo.
FINANCIACIÓN
Los autores no recibieron ningún apoyo económico para la investigación, autoría y/o publicación de este artículo.
BIBLIOGRAFÍA