
DOI: 10.20986/resed.2020.3747/2019
ORIGINAL
Efectividad de la analgesia controlada por el paciente en el dolor agudo y crónico después de cirugía cardiaca: estudio prospectivo
Effectiveness of patient-controlled analgesia in acute and chronic pain after cardiac surgery: a prospective study
N. Esteve-Pérez1,2, J. Iborra-Escalona1, G. Gómez-Romero1,2, C. Sansaloni-Perelló1, A. M. Verger-Bennasar1, S. Tejada-Gavela3, M. Riera-Sagrera4 y L. C. Mora-Fernández1,2,5
1Servicio de Anestesia, Reanimación y Terapia del Dolor. Hospital Universitario Son Espases. Palma de Mallorca, España. 2Instituto de Investigación Sanitaria de las Islas Baleares (IdISBA), Palma de Mallorca, España.3Departamento de Biología de la Universidad de las Islas Baleares. CIBEROBN (Physiopathology of Obesity and Nutrition), Palma de Mallorca, España. 4Jefe de Sección de la Unidad de Cuidados Intensivos. Hospital Universitario Son Espases. Palma de Mallorca, España. 5Jefe de Servicio de Anestesia, Reanimación y Terapia del Dolor. Hospital Universitario Son Espases. Palma de Mallorca, España
Recibido: 02-06-2019
Aceptado: 02-01-2020
Correspondencia: Neus Esteve-Pérez
neus.esteve@ssib.es
ABSTRACT
Introduction: The intensity of postoperative moderate/intense pain after cardiac surgery (CC), varies according to the different studies, from 45 % to 85 %. There is no evidence about which is the optimal analgesic regimen in the postoperative period.
The main objective of this study is to evaluate the effectiveness of the application of a multimodal analgesic protocol, based on patient-controlled analgesia (PCA) with morphine, in patients undergoing cardiac surgery with extracorporeal circulation (ECC).
Patients and methods: Prospective observational study of all patients undergoing CS with ECC, during the first 3 days postoperatively. There were included 102 patients in two periods, first, in November 2016 with conventional analgesia and second, in January - February 2017 with PCA.
Results: The pain at rest was controlled (median numerical scale <3). An average of 27 % of moderate and intense pain was recorded. There was no difference in pain intensity between patients with CA and those with PCA. The PCA group required less rescue analgesia in the first postoperative days (63 % vs. 44 % p = 0.0487). The incidence of Post-surgical Chronic Pain was 39 % at three months, and 3 % at one year. There was a correlation between preoperative pain and anxiety with the intensity of the dynamic pain (r = 0.287, p = 0.03).
Conclusions: PCA with on-demand opioids and multimodal analgesia is an effective alternative after cardiac surgery. Good control of postoperative pain is obtained without increasing adverse effects, and requiring less rescue analgesia administered by the nursing staff.
Key words: Postoperative Analgesia, cardiac surgery, multimodal analgesia, patient controlled analgesia (PCA).
RESUMEN
Introducción: La intensidad del dolor postoperatorio moderado-intenso después de una cirugía cardiaca (CC) varía, según los estudios, de un 45 a un 85 %. No existe evidencia sobre cuál es la pauta analgésica óptima en el postoperatorio de estos pacientes.
El objetivo de este estudio es evaluar la efectividad de la aplicación de un protocolo analgésico multimodal, basado en la analgesia controlada por el paciente (PCA) con morfina, en pacientes sometidos a CC con circulación extracorpórea (CEC).
Pacientes y métodos: Estudio prospectivo de todos los pacientes sometidos a CC con CEC, durante los primeros 3 días del postoperatorio (DPO). Se incluyeron 102 pacientes en dos periodos, noviembre de 2016, con analgesia convencional (AC) y enero-febrero de 2017 con PCA.
Resultados: El dolor en reposo se mantuvo controlado (mediana escala numérica < 3). Se registró un 27 % de pacientes con dolor moderado e intenso. No hubo diferencias en la intensidad del dolor entre los pacientes con AC y los de PCA. El grupo de PCA precisó menos analgesia de rescate (63 vs. 44 %, p = 0,0487). La incidencia de dolor crónico postquirúrgico fue de un 39 % a los tres meses y un 3 % al año. El dolor y la ansiedad preoperatorios se correlacionaron con la intensidad del dolor dinámico (r = 0,287, p = 0,03).
Conclusiones: La PCA con opioides a demanda y analgesia multimodal es una alternativa efectiva después de la CC. Se obtiene un buen control del dolor postoperatorio sin incrementar los efectos adversos y precisando menos analgesia de rescate administrada por enfermería.
Palabras clave: Analgesia postoperatoria, cirugía cardiaca, analgesia multimodal, analgesia controlada por el paciente (PCA).
INTRODUCCIÓN
El control eficaz del dolor agudo postoperatorio (DAP) se ha convertido en una parte esencial de los cuidados perioperatorios y su adecuado tratamiento, junto a otros factores como la movilización y la nutrición precoz, se relacionan con la disminución de las complicaciones postoperatorias y de la estancia hospitalaria (1). La presencia de DAP se ha asociado a un aumento de la morbilidad y de los costes (2), a una disminución del bienestar del paciente y a un riesgo más elevado de desarrollar dolor crónico (3).
El DAP tras cirugía cardiaca (CC) se describe como de moderado a intenso y con una repercusión fisiopatológica potencial importante. El máximo grado de dolor se percibe durante los dos primeros días del postoperatorio. Comienza a disminuir a partir del tercer día tras la cirugía y se considera leve a partir de la primera semana (4). Se origina en diversos puntos anatómicos: esternotomía, retracción esternal y costal, pericardiotomía, disección de la arteria mamaria interna, de la vena safena, manipulación de la pleura parietal, inserción de tubos torácicos (mediastínicos y pleurales), canulación de vías venosas o arteriales y otros traumatismos musculoesqueléticos (5).
La prevalencia del DAP en CC varía mucho según los estudios. Navarro y cols. (6) describieron que un 45 % de los pacientes presentaban dolor de moderado a intenso en las primeras 24 horas. Keawnantawat y cols. (7) registraron un 70 % y Bjørnnes y cols. (8) un 85 %. Los estudios son muy heterogéneos, por lo que es difícil obtener conclusiones válidas. No obstante, los autores coinciden en que la incidencia de dolor moderado a intenso en la CC es elevada, y que probablemente se prescriban tratamientos analgésicos insuficientes. Por otro lado, no existe evidencia concluyente sobre cuál es la pauta analgésica óptima en el postoperatorio de estos pacientes (9).
El objetivo principal de este estudio es evaluar la efectividad de la aplicación de un protocolo analgésico multimodal, basado en la analgesia controlada por el paciente con morfina intravenosa, en pacientes sometidos a cirugía cardiaca con circulación extracorpórea (CEC), durante los 3 primeros días del postoperatorio. La intensidad del dolor se relaciona con las variables demográficas, la comorbilidad de los pacientes, los datos intra y postoperatorios y también con la presencia de dolor crónico postquirúrgico (DCPQ), al año de la intervención.
MATERIAL Y MÉTODOS
Diseño
Estudio prospectivo, observacional, mediante entrevista y revisión de la historia clínica, de todos los pacientes sometidos a CC con CEC, durante los 3 primeros días del postoperatorio, en la Unidad de Cuidados Intensivos (UCI) y en la planta de hospitalización. Se incluyen todos los pacientes antes y después de la implementación de un protocolo de analgesia multimodal perioperatoria, basada en la analgesia controlada por el paciente con morfina.
El estudio fue aprobado por el Comité de Ética en la Investigación de las Islas Baleares, (N.º IB 3376/16 PI) y se siguieron las recomendaciones de la Declaración de Helsinki, referente a la investigación en biomedicina. Todos los pacientes fueron informados sobre el protocolo del estudio antes de firmar el consentimiento informado específico.
Población
Se incluyeron todos los pacientes en dos periodos consecutivos, en noviembre de 2016 con analgesia convencional (grupo AC), y en enero-febrero 2017 con analgesia controlada por el paciente (grupo PCA).
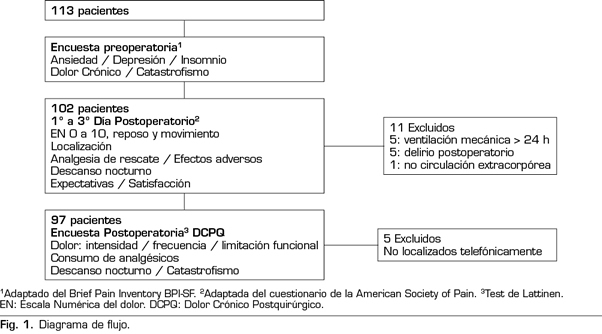
Se incluyeron todos los pacientes mayores de 18 años, que aceptaron participar en el estudio y que firmaron el consentimiento informado, programados para CC con CEC y posterior ingreso en UCI. Se excluyeron los pacientes menores de edad, pacientes que rechazaron participar en el estudio, pacientes con déficit cognitivo o imposibilidad de comunicación verbal o pacientes cuya conexión a ventilación mecánica invasiva se prolongó más de 24 horas posteriores a la cirugía.
Procedimientos
Los pacientes fueron sometidos a cirugía coronaria, cirugía valvular o ambas, programada o urgente. El protocolo quirúrgico incluyó esternotomía media, o toracotomía o abordaje mínimamente invasivo, circulación extracorpórea con moderada hipotermia (32 °C), y disección de la arteria mamaria interna, de la vena safena o de ambas.
El protocolo anestésico incluyó la monitorización hemodinámica invasiva, ventilatoria y de la profundidad anestésica. Se aplicó la oximetría cerebral no invasiva y la ecocardiografía transesofágica según indicación del anestesiólogo. La inducción se realizó con midazolam, fentanilo y propofol. El mantenimiento con sevofurano o propofol, según preferencias del anestesiólogo. La analgesia intraoperatoria se realizó con bolos a demanda de fentanilo (dosis total 10-15 µg kg-1) o perfusión de remifentanilo (dosis < 0,2 µg kg-1 min-1). Para la relajación muscular se utilizó rocuronio o cisatracurio. Se aplicó analgesia preventiva como parte del protocolo analgésico a los pacientes del grupo PCA, 30 minutos antes de la salida de quirófano, con dexketoprofeno (50 mg) o metamizol (2 g), paracetamol (1 g), dexametasona (8 mg) y tramadol (100 mg) o morfina (5 mg). Los pacientes se trasladaron a UCI, siendo extubados cuando cumplieron criterios de estabilidad hemodinámica y respiratoria.
En el grupo AC, tras la extubación, se pautó dexketoprofeno (50 mg/8 h) o metamizol (2 g/8 h) y paracetamol (1 g/6 h) con 5 mg intravenosos de morfina, como analgesia de rescate, cuando la EN > 4.
Intervención
En el grupo PCA, tras la extubación, se pautó una bomba de PCA con morfina (1 mg/1 ml), a demanda, con bolos de 1 mg, tiempo de cierre de 10 min y un máximo de 6 bolos/hora. Además se administró dexketoprofeno (50 mg/8 h) o metamizol (2 g / 8 h) y paracetamol (1 g/
6 h) y bolos de 5 mg intravenosos de morfina, como analgesia de rescate, cuando la EN > 4. La bomba se retiró a las 48 horas, si el dolor estaba controlado (EN < 4) y se consumieron menos de 10 bolos /24 h.
Registro de datos
Los pacientes incluidos en el estudio respondieron a tres encuestas diferentes: una encuesta preoperatoria, una postoperatoria del DAP en los tres primeros días del postoperatorio, y una encuesta telefónica postoperatoria del DCPQ que se cumplimentó a los 3, 6 y 12 meses del postoperatorio. Además, se recogieron los datos de la historia clínica de los pacientes.
Las encuestas a los pacientes fueron realizadas por tres miembros del equipo del estudio, entrenados en la evaluación del dolor postoperatorio.
La encuesta preoperatoria, adaptada del Brief Pain Inventory (10) (BPI) (Anexo 1), explora la presencia de dolor, ansiedad, depresión y catastrofismo.
La encuesta postoperatoria del DAP (Anexo 2) se basa en el cuestionario adaptado de la Sociedad Americana del Dolor (11). Se registró la intensidad del dolor en reposo y en movimiento medida con la escala numérica verbal (EN 0 a 10, 0 = no dolor, 10 = máximo dolor). El grado de dolor fue registrado en el momento de la entrevista (dolor observado), así como la máxima intensidad que refirió el paciente en el postoperatorio (dolor máximo percibido). Los pacientes se clasificaron según el grado de dolor: ausencia de dolor o dolor leve (EN < 3), dolor moderado (EN 4-6), dolor intenso (EN > 6) y cualquier grado de dolor (EN > 4). Se registró también la localización del dolor en tres áreas (la esternotomía, la salida de los drenajes y dolor musculoesquelético), la necesidad de analgesia de rescate, los posibles efectos adversos de los analgésicos y el grado de descanso nocturno.
Finalmente, se preguntó a los pacientes acerca de las expectativas y la realidad sobre el dolor percibido, y la satisfacción sobre el tratamiento analgésico recibido.
La encuesta postoperatoria del DCPQ (Anexo 3) se basa en el test de Lattinen (12) sobre el dolor crónico. Se repitieron las preguntas sobre el catastrofismo realizadas en la encuesta preoperatoria.


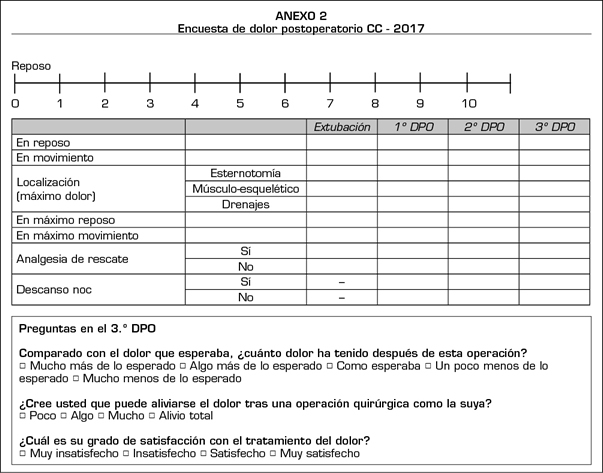
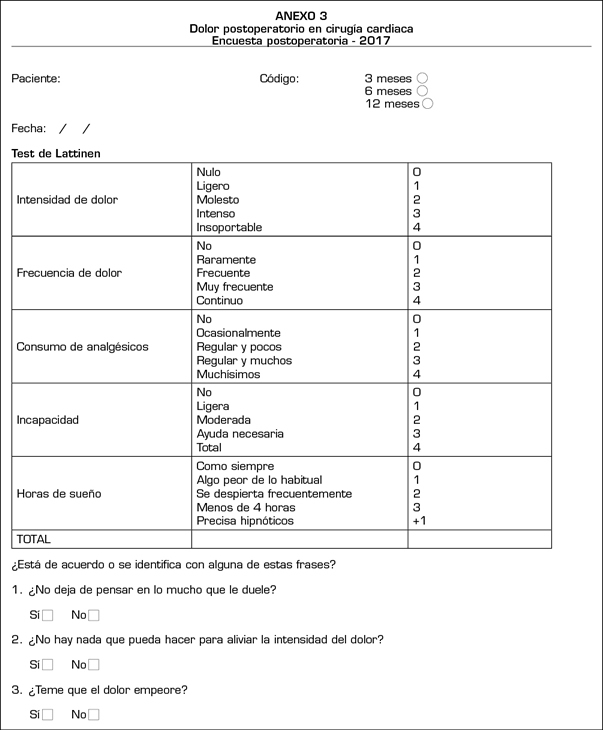
Variables
Se registraron las variables demográficas, el ASA (American Society of Anesthesiologists), la escala NYHA (New York Heart Association) y el EUROSCORE (European System for Cardiac Operative Risk Evaluation) versión I y II.
Como variables de comorbilidad se definieron, Diabetes mellitus, riesgo insuficiencia renal (creatinina > 1,2), dolor crónico (dolor de más de 3 meses de duración en cualquier localización, con consumo crónico de analgésicos), síndrome ansioso-depresivo (consumo crónico de benzodiacepinas o psicótropos), cirugía mayor previa, cirugía cardiaca previa y consumo de opioides o drogas.
Las variables perioperatorias registradas fueron el tipo de cirugía cardiaca, el tipo de abordaje quirúrgico, los tipos de drenajes, la duración de la CCA y la CEC, el manejo anestésico de mantenimiento y analgesia (propofol, sevofurane, remifentanilo, fentanilo o morfina), la administración de analgesia preventiva, los analgésicos pautados en los 3 primeros días del postoperatorio (intravenosos u orales) y la analgesia de rescate.
Las variables de la encuesta postoperatoria del DCPQ que se registraron fueron la intensidad y frecuencia del dolor (de 0 a 4), el consumo de analgésicos (de 0 a 4), la capacidad funcional (de 0 a 4) y la calidad del sueño (de 0 a 4).
Tamaño de la muestra
Revisada la literatura sobre la efectividad analgésica, esta se definió como una reducción del 20 % en la puntuación de la EN en el grupo PCA (13). Con un poder de 0,8 y un nivel de significación del 0,05, se necesitarían un mínimo de 26 pacientes en cada grupo.
Análisis estadístico
Se llevó a cabo con el paquete estadístico SPSS, versión 24.0. Para describir las variables cualitativas se utilizaron las frecuencias absolutas y los porcentajes. La descripción de las variables cuantitativas se realizó mediante valores medios y desviación estándar o medianas y rango intercuartil (RIQ Q1-Q3). Para comparar las características de los pacientes dependiendo del tipo de pauta analgésica y la identificación de variables relacionadas con el grado de dolor se aplicaron los test U de Mann-Whitney y Chi cuadrado o la prueba exacta de Fisher para variables cuantitativas y cualitativas, respectivamente. Se consideraron estadísticamente significativos valores de p < 0,05.
RESULTADOS
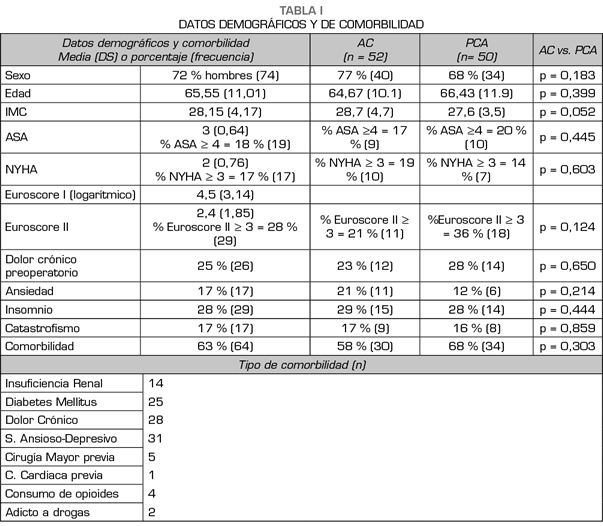
Se evaluaron 102 pacientes, 52 con tratamiento analgésico convencional (AC) y 50 con PCA. En la Figura 1 se muestra el diagrama de flujo con el protocolo del estudio y los pacientes excluidos. En las Tablas I y II se muestran los datos demográficos, de comorbilidad, y los datos intraoperatorios. No hubo diferencias en los datos demográficos, la comorbilidad, las escalas de riesgo o el tipo de intervención quirúrgica, entre los dos grupos. No se registró ningún fallecimiento.
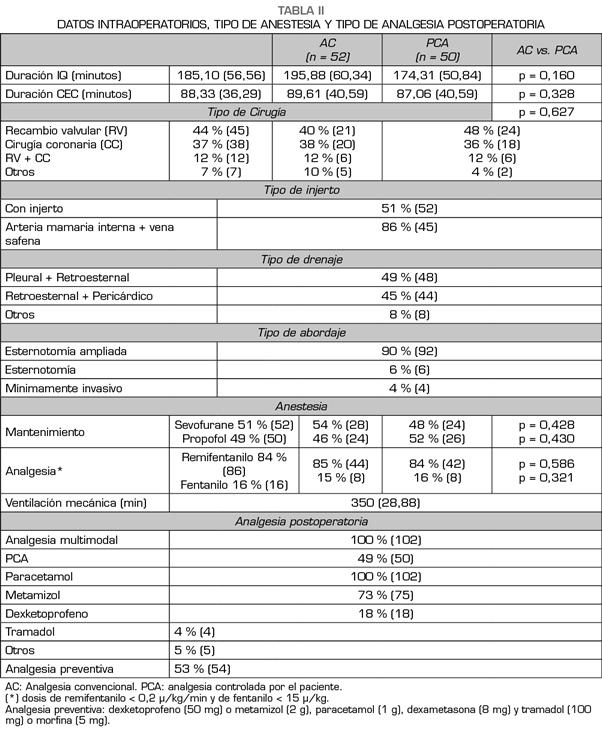
El dolor en reposo se mantuvo controlado (mediana EN < 3), mientras que se registró dolor de moderado a intenso en movimiento, desde la extubación (mediana EN 5, rango intercuartil [RIQ] 2-8) hasta el tercer DPO, (mediana EN 5, RIQ 3-7). Se registró una gran variabilidad interindividual, con rangos máximo y mínimo de 10 y 0 respectivamente. El porcentaje de pacientes con dolor controlado en reposo fue del 68 % en la extubación y del 85 % en el tercer DPO. El dolor moderado e intenso en reposo fue del 27 %, con una evolución desde un 19 % moderado y 14 % intenso en la extubación hasta un 13 % moderado y 4 % intenso en el tercer DPO. El dolor máximo referido por el paciente en reposo se mantuvo por debajo de EN 3, con un 44 % de los pacientes con dolor moderado el primer día postoperatorio, y un 25 % al tercer día.
En la Figura 2 mostramos la evolución del dolor observado desde la extubación hasta el tercer día postoperatorio. En la Figura 3, se muestra la evolución del dolor máximo referido por el paciente.
La localización del dolor en la extubación y a lo largo de los primeros 3 días fue de un 89 % en la esternotomía, un 9 % de origen musculoesquelético y un 2 % en los drenajes.
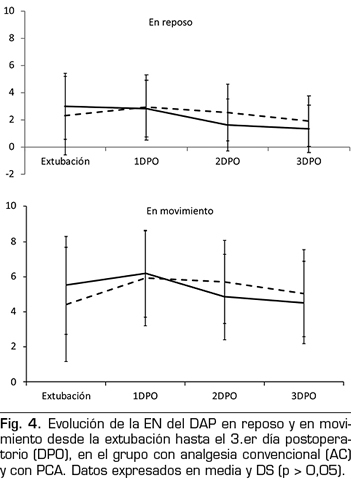
No hubo diferencias en la intensidad del dolor entre los pacientes con AC y los de PCA, ni en reposo ni en movimiento, en los tres DPO (Figura 4).
Precisaron analgesia de rescate el 54 % de los pacientes en la extubación, el 54 % en el primer DPO y el 10 % y el 1 % en el 2 y 3 DPO, respectivamente. El grupo de PCA precisó menos analgesia de rescate en el primer DPO que el grupo con analgesia convencional, (63 % vs. 44 %, p = 0,0487) y también menos milígramos de morfina, (1,9 mg/paciente vs. 4,5 mg/paciente, p = 0,0461). La conversión de la analgesia a vía oral se realizó al tercer DPO en un 92 % de los pacientes del grupo PCA y en un 46 % de los pacientes del grupo de AC (p < 0,001).
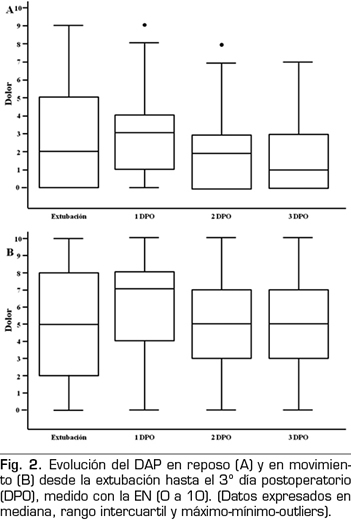
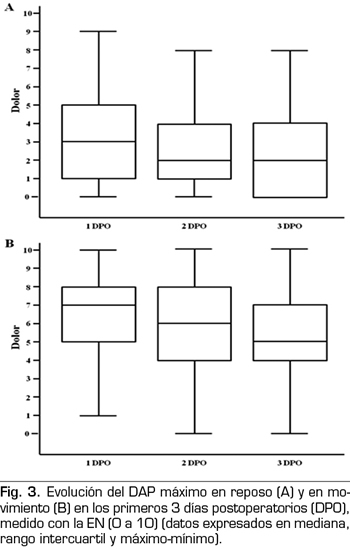
Con respecto al descanso nocturno, no pudieron conciliar el sueño un 40 % de los pacientes el primer DPO y un 34 % y 25 % en el 2 y 3 DPO, respectivamente. Sin diferencias entre ambos grupos.
Un 35 % de los pacientes refirieron haber tenido más dolor del que esperaban, sin diferencias entre los dos grupos de pacientes, (PCA 34 % vs. AC 36 %,
p = 0,788). El 95 % mostró su satisfacción con el tratamiento analgésico recibido. No hubo diferencias entre los dos grupos de pacientes (PCA 98 % vs. AC 92 %, p = 0,183).
Se registraron un 7 % de eventos adversos en relación con la analgesia, 3 pacientes con náuseas/vómitos, 3 con síndrome confusional y un íleo postoperatorio. Sin diferencias significativas entre los dos grupos, (PCA 4 % vs. AC 10 %, p = 0,262).
No hubo diferencias en la estancia media (EM) en UCI (2,2 vs. 2,2 días) o en el hospital, (PCA 10,5 vs. AC 10,7 días).
No se registraron diferencias en la intensidad del dolor entre los pacientes con remifentanilo (84 %) o con fentanilo (16 %) (p = 0,201).
La incidencia de DCPQ fue de un 39 % a los tres meses, 11 % a los 6 meses y 3 % al año. El porcentaje de pacientes con DCPQ intenso fue de 9, 1 y 1 %, respectivamente. Sin diferencias significativas entre los dos grupos de pacientes a los tres meses (PCA 44 % vs. AC 37 %, p = 0,533).
A los tres meses, un 2 % de los pacientes con DCPQ consumió regularmente analgésicos y tuvo una limitación funcional importante, y un 14 % presentó insomnio y perfil catastrofista. Al año, ningún paciente tomaba regularmente analgésicos ni tenía ninguna limitación funcional por el dolor, un 3 % tomaba hipnóticos y 1 % presentaba un perfil catastrofista.
La intensidad del DAP se correlacionó negativamente con la edad, sobre todo en el 2.º DPO (r = -0,311, p = 0,01). Se registró una correlación positiva entre el dolor dinámico, el insomnio, la ansiedad y la presencia de dolor preoperatorios (r = 0,287, p = 0,03). El perfil del paciente catastrofista se relacionó con mayor intensidad de DAP, sobre todo en el 3.er DPO (r = 0,285, p = 0,04). No se encontró correlación entre el DAP y el sexo ni con el tipo y duración de la cirugía.
DISCUSIÓN
Los datos de este estudio muestran una mediana de dolor en reposo inferior a EN 3 para todos los pacientes. Sin embargo, un 20 % de los pacientes tuvieron dolor moderado y un 9 % dolor intenso en reposo. En movimiento se registró un 34 % de dolor moderado y un 38 % de dolor intenso. Estos datos confirman el hecho de que las medias de dolor en un procedimiento quirúrgico no describen adecuadamente la efectividad de los tratamientos analgésicos para todos los pacientes.
El dolor dinámico fue siempre de moderado a intenso. El control del dolor al movimiento en CC es indispensable para garantizar una movilización y fisioterapia respiratoria precoz, un bloqueo de estímulos adrenérgicos, un confort adecuado del paciente y minimizar la posibilidad de presentar dolor crónico postquirúrgico (DCPQ). No obstante, los resultados de la práctica quirúrgica actual (14) cuestionan el hecho de que el control del DAP se base solo en el objetivo de obtener un valor en la EN < 3. Se ha demostrado que el inicio precoz de la deambulación, de la fisioterapia o de la rehabilitación, son factibles con un nivel moderado de dolor. Pretender un dolor dinámico con EN < 3 sin tener en cuenta la repercusión funcional, puede asociarse a inmovilidad del paciente o a efectos secundarios de los analgésicos que retrasen la recuperación. Se plantea el concepto de analgesia óptima postoperatoria (15), que se basa en optimizar el bienestar del paciente, acelerar la recuperación funcional y minimizar efectos secundarios.
La localización del dolor en la esternotomía en el 89 % de los pacientes, coincide con otros estudios (16) en los 3 primeros DPO, aunque se ha descrito dolor en el área de la safenectomía a partir del cuarto día, coincidiendo con una mayor deambulación.
No se registraron diferencias significativas en la intensidad del DAP entre los dos grupos de pacientes. El porcentaje de dolor en reposo de moderado a intenso (27 %) es inferior al 45-85 % registrado en otros estudios (6,8). Esto indica que ambas pautas de analgesia fueron eficaces y que, en el grupo de la analgesia convencional, la enfermería actuó con la misma efectividad que los bolos administrados a demanda del paciente en el grupo PCA.
Los pacientes con PCA precisaron menos analgesia de rescate, menos dosis de morfina de rescate y pasaron más rápidamente a la analgesia vía oral.
La percepción del DAP presenta una gran variabilidad interindividual. Los factores que se han asociado a una mayor intensidad del DAP en CC son la edad menor a 65 años, el injerto de arteria mamaria interna, la ansiedad preoperatoria (6) y el catastrofismo (17). En este estudio, además de la menor edad, la ansiedad y un perfil catastrofista, la presencia de dolor preoperatorio y de insomnio, se asoció también a una mayor intensidad del dolor. Se han descrito consumos medios de morfina intravenosa de 50 ± 15 mg en los tres primeros días del postoperatorio (18). Estos valores medios indican que los requerimientos de los pacientes pueden variar mucho. Se registran requerimientos de analgesia de rescate en un 65 % de los pacientes (19). Este porcentaje es similar al 63 % de los pacientes del grupo de AC que precisaron analgesia de rescate, y mayor que las demandas analgésicas de rescate del grupo PCA, (63 % vs. 44 %, p = 0,0487). Estos datos refuerzan la necesidad de pautar siempre analgesia de rescate, además de la pauta analgésica basal, para adecuar el tratamiento a cada paciente. Otros factores que pueden modificar las necesidades analgésicas y que, por tanto, hay que tener en cuenta al planificar la analgesia postoperatoria son: el consumo previo de opioides, la reintervención quirúrgica, la duración prolongada de la intervención, el síndrome ansioso-depresivo u otra intervención quirúrgica asociada.
La detección en el preoperatorio de estos grupos de pacientes con mayor riesgo de presentar dolor intenso en el postoperatorio, permitiría aplicar medidas terapéuticas específicas, como la PCA en modo continuo, la analgesia regional o los fármacos coadyuvantes que puedan potenciar los analgésicos.
Los opioides i.v. son los analgésicos más efectivos en el tratamiento dolor de moderado a intenso. No obstante, hoy en día se aplican pautas de ahorro de opioides (opioid-sparing o low-opioid) para minimizar sus potenciales efectos adversos y contribuir a una recuperación postoperatoria precoz. El modo de administración más efectivo es el controlado por el paciente (19-21)(PCA), que se ha demostrado que disminuye el consumo de morfina, controla mejor el dolor y se adapta a las necesidades individuales de cada paciente, además de disminuir las cargas de trabajo de enfermería. Sin embargo, en este estudio no registramos diferencias entre la PCA y la analgesia convencional con dosis a demanda administradas por la enfermería. En la revisión sistemática de Nachiyunde y cols. (21) se describen también diferentes resultados según los estudios. Este hecho se basa en la presencia de factores determinantes, como son la formación de la enfermería con respecto a la analgesia, la ratio enfermera/paciente y la existencia de protocolos analgésicos específicos (8). Por otro lado, la efectividad de la PCA (22) es mayor en cirugías que presentan mayor intensidad de dolor en reposo, como la cirugía abdominal mayor abierta o la toracotomía.
No detectamos diferencias en la satisfacción del paciente, según el tipo de analgesia. Aunque el porcentaje de satisfacción fue superior en el grupo PCA, no alcanzó diferencias significativas, (PCA 98 % vs. AC 92 %, p = 0,183). Este es un indicador complejo, relacionado con las expectativas del paciente y también con las experiencias previas. Por ello, pueden darse tasas de satisfacción elevadas junto a un control deficiente del dolor.
Se ha demostrado que la analgesia multimodal disminuye el consumo de opioides y sus efectos secundarios (5). En este estudio, el 100 % de los pacientes recibieron analgesia multimodal. Un 100 % de paracetamol, un 73 % de metamizol, además de la morfina en PCA o en dosis de rescate.
En CCA existe controversia sobre el uso de los AINE (20). Se han demostrado seguros en pacientes menores de 70 años y con función renal preoperatoria normal. Su uso durante un corto periodo de tiempo, en estos pacientes, no se ha asociado a mayor mortalidad, infarto de miocardio, disfunción renal o sangrado gastrointestinal (19,20).
Se han descrito otras opciones analgésicas efectivas desde un punto de vista multimodal (23,24), sin que haya suficiente evidencia para su recomendación generalizada. Se ha utilizado la analgesia epidural (25), la pregabalina (26), la oxicodona vía oral (27), la dexmedetomidina o la analgesia regional (bloqueo paravertebral (28), bloqueo intercostal o bloqueo paraesternal (29)).
Se han registrado incidencias de DCPQ en CC entre un 11 y 46 % de los pacientes, aunque solo de un 2 a un 10 % de los mismos presentan dolor severo (24,29). La incidencia registrada en este estudio de un 3 % de DCPQ al año es inferior a otras series, como la de Hoogd y cols. (30) de un 19 % o la de Lahtinen y cols. (31) de un 16 %. Todos coinciden en que el porcentaje de pacientes con dolor intenso y limitación funcional al año es bajo. En nuestro caso fue de un 1 %, sin diferencias entre los dos grupos de pacientes. Hay que destacar la heterogeneidad de los estudios y de los métodos de evaluación del DCPQ. Así, por ejemplo, Setälä y cols. (32) señalaban la discordancia entre los datos registrados por un cuestionario telefónico (38 %) y por la exploración clínica (15 %).
El 84 % de los pacientes recibieron una perfusión de remifentanilo con dosis inferiores a < 0,2 µ/kg/min. El uso de remifentanilo se ha asociado a mayor intensidad de DAP y a mayor incidencia de DCPQ. No obstante, los datos son controvertidos. En el estudio de Hoogd y cols. (33) se registra más dolor y más consumo de opioides postoperatorios junto a mayor incidencia de DCPQ a los 3 meses, pero no al año. Esto puede explicar los resultados contradictorios de los distintos trabajos. Nuestros resultados no muestran relación entre el uso de remifentanilo o fentanilo y el DAP o el DCPQ. No obstante, el grupo con fentanilo fue muy bajo (16 %).
No hubo diferencias en la estancia media en la UCI o en el hospital. Sin embargo, la validez de la EM como indicador de efectividad analgésica es limitada, porque depende de otros factores como la variabilidad de la práctica clínica o las distintas formas de organización hospitalaria.
Las limitaciones de este estudio se derivan de su carácter observacional y de la evaluación antes-después de la aplicación del protocolo analgésico de PCA. A pesar de la homogeneidad de ambos grupos de pacientes, no se pueden descartar sesgos por la falta de aleatorización.
CONCLUSIONES
La PCA con opioides a demanda y analgesia multimodal es una alternativa efectiva después de una cirugía cardiaca. Se obtiene un buen control del dolor, un paso rápido a la analgesia vía oral, sin incrementar efectos adversos y precisando menos analgesia de rescate administrada por enfermería. El tipo de analgesia no influyó en la estancia media ni en la incidencia de DCPQ. Se registra un porcentaje de pacientes con dolor moderado e intenso que precisarían protocolos analgésicos específicos para poder mejorar los resultados postoperatorios.
AGRADECIMIENTOS
A la sección de anestesiólogos de Cirugía Cardiaca, al Dr. J. I. Sáez de Ibarra-Sánchez, Jefe de Servicio y al equipo de cirujanos del Servicio de Cirugía Cardiaca, a la Dra. L. Vidal-Bonet del Servicio de Cardiología, a la enfermería de la Unidad de Recuperación Postanestésica y a la enfermería de la Unidad de Cuidados Intensivos, cuya colaboración ha sido imprescindible para la realización de este trabajo.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA