DOI: 10.20986/resed.2019. 3715-2018
CARTAS AL DIRECTOR
Parálisis del nervio abducens asociada a punción dural y a compresión neurovascular
Abducens nerve palsy associated with dural puncture and neurovascular compression
Sr. Director:
La espondilitis anquilosante (EA) es una espondiloartropatía autoinmune seronegativa que afecta principalmente a la columna, causando su fusión y rigidez, y a la articulación sacroilíaca (1). Puede estar asociada a colitis ulcerosa, enfermedad de Crohn, psoriasis y síndrome de Reiter (1). Es más prevalente en varones con un pico de edad a los 20-30 años (1).
La cefalea postpunción dural (CPPD) se puede producir tanto por una punción lumbar (anestésica o diagnóstica) (2) como por una punción dural accidental (PDA) durante una epidural (3). La hipótesis fisiopatológica más aceptada de la CPPD es que la pérdida de líquido cefalorraquídeo (LCR) a través del defecto dural, produce una hipotensión intracraneal, lo que causa un desplazamiento caudal del cerebro y tracción de pares craneales (2,3). Por su disposición anatómica el par craneal (PC) más susceptible de ser dañado es el VI PC (3). El riesgo de desarrollar una parálisis del VI PC parece ser bajo en los diferentes estudios, pues es difícil estimar la incidencia actual, dado que la mayoría son casos individuales o series de casos, variando entre 1:500 a 1:5800 (3). Sin embargo, esta incidencia podría estar infraestimada debido a la pérdida del seguimiento de estos pacientes (3). En el 80 % de los casos es unilateral (4). Se presenta típicamente entre el 4.º y el 10.º día tras la PDA, aunque se puede presentar hasta la 3.ª semana tras el procedimiento (4). La diplopía puede persistir de semanas a meses, recuperándose el 89 % en 8 meses (4). Aquellas parálisis que duren más de 8 meses pueden ser permanentes (4).
La parálisis del VI par también ha sido asociada a la compresión neurovascular (5-9). Aunque la parálisis recurrente del VI PC es frecuente en niños, rara vez ocurre en adultos (5,6). La compresión neurovascular puede causar un daño reversible del VI PC en adultos (5).
CASO CLÍNICO
Paciente varón de 59 años con antecedentes personales de EA y enfermedad de Crohn, programado para la realización de laparotomía y resección ileal por estenosis, con indicación de anestesia combinada general y epidural, esta última para control analgésico postoperatorio. su tratamiento habitual era: infliximab, mesalazina, pantoprazol, calcio, cianocobalamina, hierro, ácido fólico, prednisona y azatioprina.
Se informa al paciente de los riesgos y beneficios de la técnica epidural, en su caso, y se le da el consentimiento informado. Tras la preparación de la piel con antiséptico y la inyección de lidocaína 5 ml en el subcutáneo, se localiza el espacio epidural, se hacen tres intentos, con la técnica de pérdida de resistencia con aire, a nivel de L2-L3 con una aguja Tuohy 17G y se observa salida de LCR, retirándose la aguja inmediatamente. Posteriormente, se coloca catéter epidural a nivel L1-L2, siendo el test aspirativo de LCR y sangre, y la dosis test con bupivacaína 0,25 % con adrenalina, negativas. Para la anestesia general se precisa de fibrobroncoscopio flexible, por vía aérea difícil conocida. Para la inducción se utiliza fentanilo 200 mg, propofol 150 mg y rocuronio 50 mg. El mantenimiento se hizo con sevoflurane con 1 concentración alveolar mínima, con electroencefalografía procesada. La perfusión epidural se comenzó durante la intervención con bupivacaína a 0,1 % y fentanilo 5 mg/mL-1 a 6 ml/hr-1. La intervención transcurre sin incidencias. En la sala de recuperación no se objetiva bloqueo motor y sí un adecuado control analgésico. Por buena evolución, es dado de alta de la unidad a la planta de hospitalización con la misma perfusión epidural.
El paciente es seguido en la planta de hospitalización por la Unidad de Dolor Agudo (UDA), retirándose el catéter epidural a las 48 horas sin incidencias. A las 24 horas de la retirada del catéter, el paciente refiere cuadro de cefalea bifronto-parieto-occipital compresiva con predominio en bipedestación y mejoría en decúbito, no impidiéndole la sedestación ni la deambulación, compatible con CPPD leve. Se maneja de forma conservadora con hidratación, cafeína y un primer escalón analgésico. Es dado de alta hospitalaria al 4.º día postoperatorio, con seguimiento telefónico por la UDA. En el seguimiento telefónico, la cefalea remite al 7.º día, pero al 9.º día postoperatorio aparece clínica repentina de diplopía, no acompañado de náuseas, vómitos, fiebre ni otros síntomas. Es dirigido al servicio de urgencias, donde es valorado por el servicio de oftalmología y neurología, y lo único que destaca en la exploración física es una paresia del músculo recto externo del ojo derecho secundaria a la afectación del VI PC derecho, siendo el resto de la exploración normal. La analítica (hemograma, coagulación y bioquímica), electrocardiograma, radiografía de tórax y TAC cerebral, fueron normales. Se solicita resonancia magnética (RM) craneal de modo preferente, dada la normalidad del TAC.
Se plantea la realización de un parche hemático epidural (PHE) como tratamiento de la parálisis del VI PC, se valoran riesgos/beneficios del paciente, y, dado que habían transcurrido más de 24 h de la aparición de la diplopía, se decide tratamiento conservador, con oclusión ocular del ojo afecto y complejos vitamínicos de los grupos B y C.
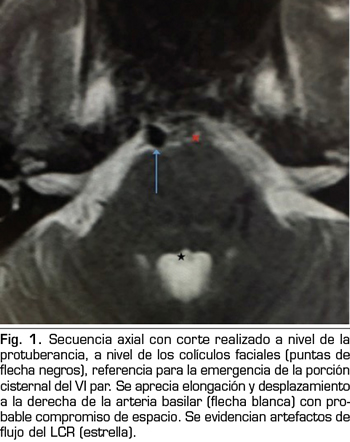
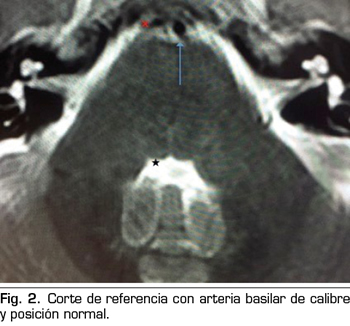
Se hace RM a los 10 días de la aparición de la diplopía objetivando un discreto agrandamiento, elongación y desplazamiento lateral derecho de la arteria basilar, con probable compromiso de espacio en la emergencia de la porción cisternal del VI par derecho (Figuras 1 y 2).
Se continúa con el manejo conservador hasta que su evolución fue favorable, recuperándose por completo a los 4 meses. Actualmente está en seguimiento por el servicio de neurología.

DISCUSIÓN
La EA presenta particularidades en su manejo anestésico debido a la potencial vía aérea difícil, complicaciones cardiovasculares y respiratorias, y la medicación utilizada para reducir el dolor y el control de la enfermedad (1). A esto se le suma que la anestesia espinal y la epidural son técnicamente difíciles, aumentando el riesgo de complicaciones (1). La colocación de un catéter epidural es más difícil, y está asociada con mayor riesgo de hematoma epidural (1). En nuestro caso, a pesar de las dificultades técnicas, se decide la colocación del catéter epidural para lograr un mejor control analgésico. El control del dolor efectivo es muy importante después de una cirugía abdominal mayor, para promover una adecuada recuperación (10). Múltiples estudios han demostrado que la analgesia epidural reduce las complicaciones cardiacas y pulmonares en el postoperatorio de pacientes de alto riesgo (10).
Una vez aparece la clínica de CPPD, al paciente se le aplica el protocolo de manejo de CPPD de nuestro hospital, en el que la CPPD de intensidad leve se trata de forma conservadora y seguimiento telefónico, tras el alta hospitalaria. Como gran ventaja este protocolo hace que sigamos a todos los pacientes con PDA constatada o con sospecha de CPPD, desde el inicio del cuadro y contactemos con los servicios responsables para su atención.
Cuando se diagnostica la parálisis del VI PC, se plantea la realización de un PHE, valorándose los riesgos y beneficios. Se decide no realizar dado que ya no existía clínica de CPPD, lo que podría implicar que ya no hubiese hipotensión licuoral en ese momento, y que si persistía la clínica de parálisis del VI PC debía ser por daño neural ya instaurado, y no recuperable por la realización del PHE (4). Aunque el PHE proporciona un alivio parcial o total de la CPPD en el 61 a 95 % de los casos, no es probable que revierta la parálisis del VI PC debido a que se ha producido una desmielinización del nervio (3). En nuestro caso, además, habían pasado más de 24 horas desde la aparición de la parálisis, siendo el periodo más beneficioso para revertir la diplopia, la realización del PHE en las primeras 24 horas (3,11). Hay múltiples casos en la literatura que muestran la no respuesta del PHE, en la parálisis del VI PC, si se hace más allá de las 24 horas del inicio de la diplopía (11). A esto se suma un paciente con dificultades técnicas para la realización del PHE, por la EA, en el que se podría producir una mayor yatrogenia.
La parálisis del VI PC asociada a CPPD es un diagnóstico por exclusión que requiere la consideración de otras anormalidades neurológicas y oftalmológicas (3). Si la parálisis del VI PC ocurre dentro de las 3 primeras semanas tras la PDA y es precedida de una CPPD, es probablemente consecuencia de la PDA (4). La imagen de la RM puede revelar signos de hipotensión intracraneal, incluyendo engrosamiento meníngeo, colecciones de líquido subdurales y desplazamiento cerebral caudal (11). Estos hallazgos son debidos a la hipotensión intracraneal, sin embargo, no son específicos de la parálisis del VI PC (11). En nuestro caso, la RM no aportaba ninguno de estos signos, pero lo que sí reveló fueron datos de probable compromiso de espacio de una estructura neurológica (emergencia del VI PC derecho) por una estructura vascular (arteria basilar en nuestro caso), planteando el diagnóstico diferencial con un síndrome de compresión neurovascular. El síndrome de compresión neurovascular es definido como el contacto directo con irritación mecánica de los PC por vasos sanguíneos (7). Varios autores han comunicado casos de parálisis unilateral del VI PC, asociada con el contacto neurovascular entre el VI PC y la arteria vertebral o basilar en la RM (6).
Valorando la secuencia temporal de los hechos, lo más probable es que el daño fuese desencadenado por el cuadro de hipotensión de LCR. Cuando los resultados de la RM aparecen normales, una vez que se ha resuelto la hipotensión intracraneal, el daño isquémico del nervio puede perdurar como secuela (4). La isquemia neural puede producir una desmielinización y una interrupción axonal (4). Esto puede justificar la ausencia de otros signos de hipotensión licuoral en la RM de nuestro caso. Posiblemente, la variante anatómica vascular de este paciente, lo haya predispuesto a una mayor vulnerabilidad del VI PC. La tracción y elongación del nervio lo llevó a un periodo de isquemia, convirtiendo a la hipotensión de LCR en el posible desencadenante de la parálisis del VI PC. Este paciente está en seguimiento actual por el servicio de neurología, ya que la compresión neurovascular podría producir una parálisis del VI PC recurrente (6) y precisar, en un futuro, de una descompresión vascular (8).
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FUENTES DE FINANCIACIÓN
El presente artículo no ha recibido ninguna beca específica de agencias de los sectores público, comercial, o sin ánimo de lucro.
BIBLIOGRAFÍA
M. B. Perdomo Perdomo1, S. Hernández González1, V. Martín García2, E. M. Carrillo González1 y E. Espinosa Domínguez1
1Servicio de Anestesiología y Reanimación. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife, España. 2Servicio de Radiología. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife, España
Correspondencia: María Beatriz Perdomo Perdomo
mbperper@gmail.com