DOI: 10.20986/resed.2018.3656/2018
ORIGINAL
Dexmedetomidina versus lidocaína endovenosa en el control de dolor irruptivo y la funcionalidad en pacientes con canal lumbar estrecho
N. Guillén Ramírez1, M. Jiménez Olvera1, M. A. Morales Águila1, J. C. Arista Villanueva1,
R. O. Vallejo Estrella1, A. Reding-Bernal2 y C. O. López López3
1Clínica del Dolor, 2Dirección de investigación y 3Servicio de Rehabilitación. Hospital General de México “Dr. Eduardo Liceaga”. Ciudad de México, México
Recibido: 18-01-2018
Aceptado: 06-04-2018
Correspondencia: Nayely Guillén Ramírez
eyan.me@hotmail.com
ABSTRACT
Introduction: The pain is a reason for absenteeism labour, especially breakthrough pain secondary to narrow lumbar canal. Dexmedetomidine is an analgesic, act by inhibiting the release of substance P in the nociceptive pathway and blocks the aspartate and glutamate receptors. On the other hand, lidocaine also prevents and relieves pain by interrupting neuroconduction, binding to its specific receptor within the sodium channels.
Objective: To evaluate the analgesic efficacy of dexmedetomidine versus lidocaine in intravenous perfusion as a treatment for breakthrough pain secondary to narrow lumbar canal.
Material and methods: Controlled clinical trial, randomized, triple-blind, performed at the HGM pain clinic, two groups of patients with diagnosis of breakthrough pain secondary to narrow lumbar canal were evaluated; group one was treated with dexmedetomidine (0.3 mcg/kg) and the other group was treated with lidocaine (2 mg/kg) in intravenous infusion. Measurement of pain intensity and sedation status was made before starting the treatment and after 30, 60 and 120 minutes. The functionality of the patients was also assessed through the Oswestry disability index before and seven days after treatment. Secondarily evaluated the effect of treatments on vital signs.
Results: There was not any statistically significant difference in the reduction of pain intensity at 120 minutes between patients treated with dexmedetomidine (EVA 1.29 ± 1.63) compared with those who were treated with lidocaine (EVA 1 ± 1.19, p = 0.594), it was observed that at the end of drugs perfusion, dexmedetomidine produced greater sedation, unlike lidocaine
(p = 0.003), both treatments improved functionality in all patients without having a statistically significant difference between treatments (p = 0.508), they were not observed depressant effects on vital signs.
Conclusions: Dexmedetomidine and lidocaine are just as equally effective for the treatment of breakthrough pain, with onset of action in the first 30 minutes after the infusion started until the next 2 hours, no adverse drug events were observed at the recommended doses.
Key words: Breakthrough pain, dexmedetomidine, lidocaine, narrow lumbar canal.
RESUMEN
Introducción: El dolor es un motivo de ausentismo laboral, en especial el dolor irruptivo secundario a canal lumbar estrecho. La dexmedetomidina como analgésico actúa inhibiendo la liberación de sustancia P en la vía nociceptiva y bloquea los receptores de aspartato y glutamato. Por otro lado, la lidocaína también previene y alivia el dolor mediante la interrupción de la neuroconducción, uniéndose a su receptor específico dentro de los canales de sodio.
Objetivo: Evaluar la eficacia analgésica de la dexmedetomidina versus lidocaína en perfusión endovenosa como tratamiento del dolor irruptivo secundario a canal lumbar estrecho.
Material y métodos: Ensayo clínico controlado, aleatorizado, triple ciego, realizado en la clínica del dolor del HGM, se evaluaron dos grupos de pacientes con diagnóstico de dolor irruptivo secundario a canal lumbar estrecho; un grupo tratado con dexmedetomidina (0,3 mcg/kg) y otro grupo tratado con lidocaína (2 mg/kg) en perfusión endovenosa. Se realizó medición de la intensidad del dolor y el estado de sedación antes de iniciar el tratamiento y posteriormente a los 30, 60 y 120 minutos. También se evaluó la funcionalidad de los pacientes a través del índice de discapacidad de Oswestry antes y a los siete días del tratamiento. Se evaluó de forma secundaria el efecto de los tratamientos sobre los signos vitales.
Resultados: No hubo diferencia estadísticamente significativa en la reducción de la intensidad del dolor a los 120 minutos entre los pacientes tratados con dexmedetomidina (EVA 1,29 ± 1,63) comparados con los tratados con lidocaína (EVA 1 ± 1,19, p = 0,594). Se observó que al final de la perfusión de los fármacos, la dexmedetomidina produjo mayor sedación a diferencia de la lidocaína
(p = 0,003). Ambos tratamientos mejoran la funcionalidad en todos los pacientes sin haber diferencia estadísticamente significativa entre los tratamientos (p = 0,508) no se observaron efectos depresores sobre los signos vitales.
Conclusiones: La dexmedetomidina y la lidocaína son igual de eficaces para el tratamiento del dolor irruptivo, con inicio de acción en los primeros 30 minutos de iniciada la perfusión hasta las siguientes 2 horas. No se observaron eventos adversos medicamentosos a las dosis recomendadas.
Palabras clave: Dolor irruptivo, dexmedetomidina, lidocaína, canal lumbar estrecho.
INTRODUCCIÓN
El dolor es un síntoma que el ser humano ha experimentado desde tiempos muy remotos. Se describe de manera diferente dependiendo el área anatómica afectada, el mecanismo que lo desencadena y la experiencia previa de dolor (1). Es un problema para quien lo padece, ya que repercute en su vida familiar, social y es uno de los principales motivos de ausentismo laboral (2). El dolor lumbar es referido por un gran porcentaje de la población adulta, con predominio en los mayores de 45 años, descrito como una sensación desagradable dentro de un área anatómica que inicia a nivel de la última apófisis espinosa torácica y termina inferiormente a nivel del primer proceso espinoso sacro, limitado lateralmente por líneas tangenciales a los bordes laterales de los erectores espinales lumbares (3,4). Es un síntoma de etiología multifactorial, puede ser secundario a canal lumbar estrecho con irradiación a uno o ambos miembros pélvicos, condicionando discapacidad al comprometer estructuras nerviosas (5). Las principales causas del canal lumbar estrecho son de origen degenerativo y de forma secundaria por hipertrofia del ligamento amarillo, desarrollo de osteofitos o abombamiento de los discos intervertebrales. (6). Puede clasificarse en aguda cuando se experimenta por primera vez, con duración menor a seis semanas y crónica cuando es mayor a este periodo (7). Sin embargo, el dolor lumbar crónico secundario a canal lumbar estrecho puede desencadenar cuadros de dolor irruptivo (8), caracterizados por periodos transitorios de dolor intenso e incontrolado (9). Se presenta hasta en un 70 % de pacientes con dolor crónico no oncológico, con intensidad máxima a los 10 minutos y de duración incluso mayor a una hora, deteriorando la calidad de vida de quien lo padece (10), aun cuando el paciente emplee opioides como parte de su tratamiento (11).
Ante un cuadro de dolor irruptivo se debe considerar la intervención de un equipo multidisciplinario, incluyendo un especialista en dolor, siendo necesaria una valoración inicial minuciosa y evaluar de forma periódica si hay respuesta adecuada al tratamiento (12,13). El tratamiento estándar del dolor irruptivo son los opioides, pero su uso es controversial, ya que pueden generar adicción y efectos colaterales severos (14). Son la primera opción terapéutica siempre y cuando el paciente esté previamente tratado con dichos fármacos (15). En muchas ocasiones el dolor irruptivo es tratado por el médico general el cual, al tener uso limitado de los opioides, desconoce la adecuada titulación de las dosis, reportándose efectos adversos e incluso la muerte al emplearlos de manera errónea (16). Se ha sugerido emplear fármacos diferentes a los opioides para el manejo del dolor irruptivo y así evitar complicaciones; tales fármacos son los antinflamatorios no esteroideos, corticoesteroides, antiepilépticos, α 2 agonistas (dexmedetomidina), anestésicos locales (lidocaína) y sustancias líticas que han mostrado reducir la frecuencia y duración de estos episodios (17-19). La dexmedetomidina es un α 2 agonista con efecto analgésico, ansiolítico, sedativo y simpaticolítico, actúa inhibiendo la liberación de sustancia P en la vía nociceptiva y bloquea los receptores de aspartato y glutamato; hasta el momento no existen estudios que documenten su utilidad en el manejo del dolor irruptivo (20,21). Por otro lado, tenemos a los anestésicos locales como la lidocaína, a la cual se le ha encontrado utilidad como adyuvante en el tratamiento del dolor de gran intensidad, en donde otras opciones terapéuticas han fallado o cuando no se ha alcanzado el objetivo analgésico, previene y alivia el dolor mediante la interrupción de la neuroconducción, uniéndose a su receptor específico dentro de los canales de sodio (22-24). Es importante recordar que el paciente que vive con dolor crónico aunado a episodios de dolor irruptivo tiene limitaciones que se pueden traducir en discapacidad (1). Se ha observado que no en todos los pacientes los hallazgos radiográficos y pruebas de laboratorio se correlacionan con la clínica reportada, por lo cual se han empleado diversas escalas de medición como el índice de discapacidad de Oswestry para evaluar el grado de afectación que la lumbalgia por canal lumbar estrecho puede generar (25).
OBJETIVO
Comparar la eficacia analgésica de la dexmedetomidina por vía endovenosa versus lidocaína por vía endovenosa en el tratamiento del dolor irruptivo secundario a canal lumbar estrecho.
METODOLOGÍA
Después de la evaluación y aprobación del comité de investigación y ética del Hospital General de México (HGM) “Dr. Eduardo Liceaga”, y previa autorización de los pacientes a través de la firma del consentimiento informado, se realizó un ensayo clínico controlado, aleatorizado, triple ciego. Se evaluaron pacientes derechohabientes a la clínica del dolor del HGM, con un rango de edad entre los 40 y 80 años, los cuales cumplieron los siguientes criterios de inclusión: canal lumbar estrecho corroborado por resonancia magnética nuclear (RMN), episodio de dolor irruptivo (intensidad en la Escala Visual Análoga [EVA] mayor a 6 y con menos de 60 minutos de evolución), que pudieran trasladarse en los primeros 30 minutos de iniciado el cuadro a la clínica del dolor del HGM sin la ingesta de analgésicos de ningún tipo (AINE, opioides, neuromoduladores). Se excluyeron pacientes con antecedente de alergia a alguno de los fármacos en estudio, cardiópatas, con hipotensión arterial, demencia, embarazo, alteraciones mentales y antecedentes de crisis convulsivas, se eliminaron a los pacientes que no desearon continuar en el estudio y los que presentaron complicaciones hemodinámicas durante el tratamiento.
El estudio fue realizado de marzo de 2014 a junio de 2016, en el cual se asignó a los pacientes en dos grupos a través de una tabla de números aleatorios; un grupo con 14 pacientes, los cuales fueron tratados con dexmedetomidina por vía endovenosa a dosis de 0,3 mcg/kg diluidos en 250 ml de solución salina al 0,9 % en perfusión continua durante dos horas y otro grupo de 15 pacientes tratados con lidocaína a dosis de 2 mg/kg diluidos en 250 ml de solución salina al 0,9 % en perfusión por vía endovenosa en el mismo periodo de tiempo.
Se registraron los datos generales de los pacientes en un formato establecido que incluía: sexo, edad, talla, peso e índice de masa corporal (IMC). Previo a la perfusión de los fármacos en estudio se les explicó a los pacientes el uso de la EVA y se hizo un registro basal (a la llegada del paciente) y posteriormente a los 30, 60 y 120 minutos de los signos vitales: frecuencia cardiaca, frecuencia respiratoria, saturación de oxígeno por oximetría de pulso y tensión arterial media (FC, FR, SpO2, TAM, respectivamente), también se documentaron los valores basales y durante la perfusión de los fármacos en estudio de la intensidad del dolor (EVA 0 = sin dolor, EVA 10 = máximo dolor), el porcentaje en el índice de discapacidad de Oswestry (inicial, previa perfusión de medicamentos y final, una semana posterior al tratamiento, el cual consta de 10 apartados con seis posibles respuestas cada uno, donde las puntuaciones abarcan porcentajes que van desde 0-20 %, el cual indica una limitación funcional mínima, hasta un porcentaje mayor a 80 %, indicando una limitación funcional máxima) y la puntuación en la escala de sedación de Ramsay (con 6 clasificaciones, donde 1 representa a un paciente ansioso, agitado e inquieto y 6 un paciente sin respuesta considerado el máximo grado de sedación). El médico responsable de administrar el tratamiento, los médicos encargados de recabar los resultados y los pacientes desconocieron el tratamiento empleado hasta el final del estudio. Durante el tiempo de perfusión de los fármacos en estudio se mantuvo al paciente con monitoreo básico el cual constaba de electrocardiografía continua (ECG), SpO2, FR, FC y tensión arterial no invasiva (TANI), se contó con oxígeno suplementario el cual estuvo disponible en caso de que fuera necesario (SpO2 menor del 92 % y Ramsay mayor a 3).
Análisis estadístico
Se realizó estadística descriptiva para todas las variables calculando medias y desviaciones estándar para variables cuantitativas, frecuencias y porcentajes para variables cualitativas. Mediante la prueba de T de Student para muestras independientes, se valoró el efecto del tratamiento en el manejo del dolor, el nivel de sedación, la funcionalidad y los signos vitales entre ambos grupos. Para valorar el efecto de los tratamientos de forma individual, se realizó prueba de T de Student para muestras relacionadas, considerando estadísticamente significativo un valor de p = 0,05 para todas las pruebas. Todo el análisis se realizó con el paquete estadístico SPSS versión 22 para Windows.
RESULTADOS
Se incluyeron 29 pacientes en el presente estudio con una edad de 66,31 ± 11,14 años, la mayoría los pacientes fueron del sexo femenino 86,2 % (n = 25) y solo el 13,8 % (n = 4) fueron hombres, el peso fue de 67,90 ± 10,74 kilogramos, talla de 1,51 ± 0,090 metros e IMC de 29,43 ± 4,68. No se observaron diferencias estadísticamente significativas en las variables antropométricas entre los grupos como se muestra en la Tabla I. La distribución de pacientes en porcentaje por grupo de tratamiento fue la siguiente, en el grupo de dexmedetomidina del 48,3 % (n = 14) contra el 51,7 % (n = 15) perteneciente al grupo de lidocaína. Se realizó una evaluación inicial donde se valoró la intensidad del dolor con la EVA, el estado de sedación con la escala de Ramsay, la funcionalidad con el índice de discapacidad de Oswestry y signos vitales previa a la administración de los medicamentos sin observar diferencias estadísticamente significativas entre los grupos de tratamiento (Tabla I).
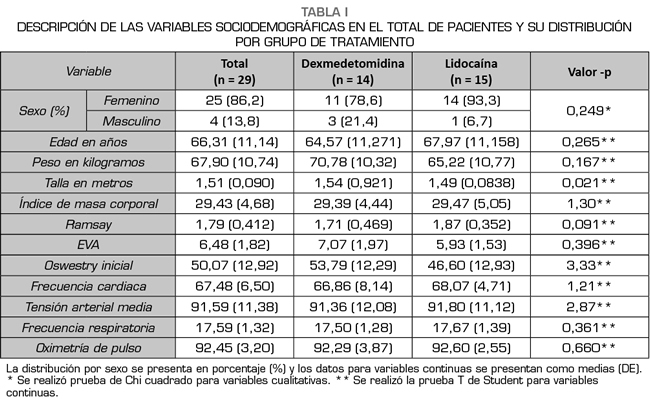
Se buscó el efecto analgésico de ambos tratamientos empleados observando disminución de la intensidad del dolor en ambos grupos, con descensos estadísticamente significativos del dolor durante el seguimiento, sin embargo, no hubo diferencias entre los grupos de tratamiento (p = 0,594), observando igual beneficio en el total de pacientes, se observó que la dexmedetomidina tiene un efecto analgésico constante durante todo el periodo de seguimiento (120 minutos) mientras que la lidocaína alcanza su máximo efecto analgésico solo hasta los primeros 60 minutos del seguimiento (Figura 1).
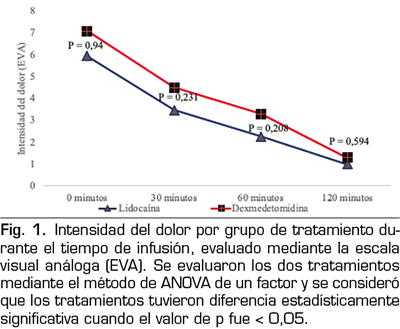
Dado que el nivel de sedación es una variable importante al emplear este tipo de tratamientos, se realizó un seguimiento del estado de sedación en ambos grupos observando que al ingreso todos los pacientes se encontraban conscientes y cooperadores en una clasificación en la escala de Ramsay de 1,79 ± 0,412, sin diferencia estadística entre los grupos, conforme se fueron evaluando en los intervalos de tiempo descritos (30, 60 y 120 minutos), se observó que hasta los
60 minutos la lidocaína tenía una puntuación ligeramente más alta en la escala de sedación, sin haber diferencia estadísticamente significativa con respecto a la dexmedetomidina (2,47 vs. 2,36, p = 0,613), sin embargo al final del seguimiento, es decir a los 120 minutos, el efecto sedativo de la lidocaína disminuyó, a diferencia de la dexmedetomidina, observando que su efecto sedativo se mantiene e incluso aumenta a medida que se prolonga el tiempo de perfusión, con una diferencia estadísticamente significativa al compararla con la lidocaína (p = 0,003) (Figura 2).
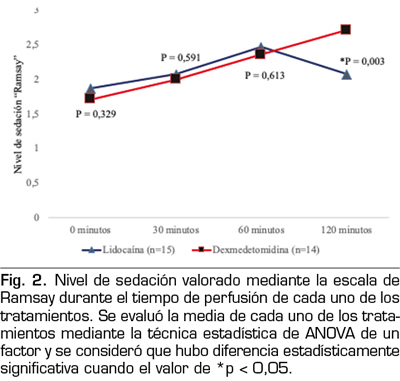
Además, se evaluó la funcionalidad de los pacientes, para lo cual se aplicó el índice de discapacidad de Oswestry al inicio del estudio y 7 días posteriores a la administración de los medicamentos, observando que ambos fármacos mejoran la funcionalidad en los pacientes reflejado con mejores puntajes (p = 0,000), sin embargo, no se encontró que hubiera diferencia estadísticamente significativa entre los tratamientos
(p = 0,508) (Figura 3).
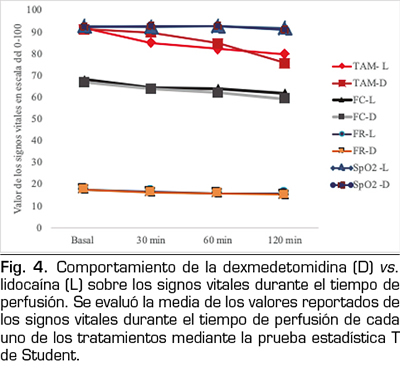
Como parte de la vigilancia durante la perfusión de los medicamentos se monitorizaron sus efectos sobre los signos vitales, sin observar diferencias estadísticamente significativas entre los valores reportados al inicio y durante el tiempo de seguimiento en ninguno de los medicamentos, ni entre los tratamientos (Figura 4).
DISCUSIÓN
El dolor irruptivo secundario a canal lumbar estrecho continúa siendo un motivo frecuente de consulta, ya que tiene alta prevalencia en la población con dolor crónico de tipo no oncológico y puede ocasionar discapacidad en la persona que lo padece, el objetivo del tratamiento debe ser la rápida recuperación y la mejoría de los síntomas (3).
Nuestro estudio es el primero que describe a la dexmedetomidina y a la lidocaína como tratamiento alternativo del dolor irruptivo secundario a canal lumbar estrecho. Existen reportes donde se han empleado a los α 2 agonistas, como la dexmedetomidina para el tratamiento del dolor oncológico de difícil control, demostrando que este tipo de fármacos pueden reducir las dosis de opioide para producir analgesia en cuadros de dolor agudo oncológico y no oncológico, incluso cuando la terapia con estos o cualquier otro adyuvante analgésico y el manejo intervencionista del dolor han mostrado resultados poco favorables. Además de tener un rápido inicio de acción, presenta cierto margen de seguridad para su uso fuera del ámbito hospitalario incluso a dosis superiores
(0,7 mcg/kg/h) a las utilizadas en nuestro estudio (26). Por otro lado, la lidocaína por vía endovenosa se ha descrito como un analgésico dosis-dependiente, siendo de utilidad para el tratamiento del dolor neuropático, oncológico, dolor agudo postoperatorio, dolor central y por desaferentación, aunque no figura como el tratamiento de elección para episodios de dolor agudo, si es de utilidad como adyuvante en el manejo multimodal del dolor, cuando los opioides han sido ineficaces o los efectos indeseables de estos no son tolerados. Puede producir analgesia por un tiempo superior al de su administración, acelera la recuperación y acorta el tiempo de estancia intrahospitalaria de los pacientes con dolor agudo e intenso, también ha mostrado resultados favorables en el tratamiento del dolor resistente a otras opciones terapeúticas (27,28). Se han reportado que dosis de 1,5 a 5 mg/kg/h por vía intravenosa reducen la intensidad del dolor lumbar radicular hasta por 21 días, lo cual la hace una opción terapéutica para el manejo del dolor agudo (29).
En este estudio ambos fármacos mostraron ser eficaces en el tratamiento del dolor irruptivo secundario a canal lumbar estrecho, con resultados similares a los reportados en otros estudios donde se emplearon para manejar diversos tipos de dolor, observando reducción en la intensidad del dolor en todos los pacientes, desde los primeros 30 minutos de perfusión, con efecto analgésico hasta el final del seguimiento, haciendo de ambos fármacos una opción para el manejo del dolor irruptivo que se suman a la terapéutica actual.
La dexmedetomidina, además de sus propiedades analgésicas, ha sido utilizada ampliamente en otros campos de la medicina por su efecto sedante, que permite tener una respuesta rápida del paciente a los estímulos del medio. A diferencia de otros fármacos con poder sedativo como el midazolam, la dexmedetomidina no ha presentado efectos adversos postsedación, sus propiedades farmacológicas hacen que sea una alternativa más para el manejo de los pacientes con dolor agudo e intenso sin presentar eventos adversos importantes, siempre y cuando se administre a las dosis descritas (30).
Se ha observado que la lidocaína a dosis bajas resulta segura y eficaz para el manejo del dolor. La presencia de efectos secundarios que se han descrito (mareo, vértigo, disartria, parestesia periorbitaria, insomnio, xerostomía, taquicardia, temblor, sabor metálico, diplopía e incoordinación) se deben a una sensibilidad previa al fármaco o por su acumulación plasmática hasta dosis toxica, aun así, estas complicaciones son menores y predecibles comparada a los efectos ocasionados por otros analgésicos opioides y no opioides (28,31). Sin embargo, en un reporte de caso, donde se utilizó una dosis de lidocaína en bolo intravenoso de 1 mg/kg,
seguida de una perfusión intravenosa a 2 mg/kg durante 2 horas, se reportó sedación profunda asociada a debilidad muscular en el total de pacientes (n = 8), lo cual hizo sospechar una posible toxicidad, por lo que se sugiere mantener un monitoreo del estado de conciencia a través del BIS (32).
En este estudio, en relación con la literatura consultada, coincidimos en el efecto sedativo de la dexmedetomidina, el cual es directamente proporcional a la dosis y al tiempo de administración, al utilizarla a dosis menores a las descritas por otros autores observamos que su efecto depresor sobre el nivel de conciencia es mínimo, lo que permite tener un estado alerta en todos los pacientes durante el tiempo de seguimiento y alcanzar nuestro objetivo terapéutico. Por otro lado, la lidocaína a pesar de tener efecto sedativo en nuestro grupo de pacientes, este efecto no deseado del medicamento no se perpetua más allá de los 60 minutos del seguimiento, estos resultados difieren a lo reportado en otros estudios (32).
El dolor irruptivo, además de generar sufrimiento, ocasiona incapacidad funcional que limita las actividades de la vida diaria de quien lo padece. No se ha hecho ninguna revisión en la cual se incluya a la lidocaína o dexmedetomidina como parte del tratamiento farmacológico por vía intravenosa para mejorar los síntomas y la funcionalidad en pacientes con dolor irruptivo secundario a estenosis del canal lumbar; solo se ha reportado que al asociar estos fármacos como coadyuvantes al tratamiento de elección se puede optimizar la analgesia y reducir la frecuencia e intensidad de estos episodios, además de que se disminuyen los efectos tóxicos del resto de los fármacos que forman parte del tratamiento (15,18,33,34). Se ha descrito el uso de los anestésicos locales y los α 2 agonistas por vía peridural y el uso de parches de lidocaína por vía tópica reportando mejoría analgésica y en la capacidad funcional en pacientes con dolor irruptivo, pero ninguno enfocado a dolor por canal lumbar estrecho (35,36).
En nuestro estudio observamos que ambos tratamientos mejoraron las puntuaciones en el índice de Oswestry al final del seguimiento (7 días) y, aunque se reportan mejores puntajes con dexmedetomidina, no hay diferencia estadísticamente significativa entre los tratamientos.
La dexmedetomidina, al actuar sobre los receptores α 2 agonistas ubicados en el cerebro y médula espinal, inhibe la descarga neuronal, produciendo hipotensión y bradicardia, con escasa repercusión sobre la frecuencia respiratoria manteniendo la pendiente de la curva en respuesta al CO2 aunque se genere una sedación considerable (19).
En un estudio donde se evaluó la eficacia analgésica de la lidocaína por vía intravenosa a diferentes dosis (1 a 5 mg/kg/h) para el tratamiento del dolor neuropático en etapa aguda, se observó que en el total de los pacientes los valores reportados de la frecuencia cardiaca y la presión arterial permanecieron estables y dentro de rangos normales, en el registro electrocardiográfico no se observaron variaciones en el trazo (31).
En el presente trabajo encontramos resultados similares a los reportados por otros autores en cuanto a los efectos secundarios de la dexmedetomidina y la lidocaína sobre los signos vitales, documentando que, a dosis bajas además de obtener una adecuada analgesia, mantenemos mínimos cambios sobre los valores basales de la FC, FR, SpO2, además de que no se observaron alteraciones electrocardiográficas.
Unas de las limitaciones de este estudio fue el tamaño de la muestra y la proporción entre hombres y mujeres, lo cual pudiera condicionar algún tipo de sesgo al no poder evaluar de forma equitativa la frecuencia e intensidad del dolor por género, tampoco se pudo evaluar el tipo de actividad laboral y las limitaciones que el dolor irruptivo generaba. La desventaja de este estudio radica en la incapacidad de determinar la diferencia en el efecto analgésico y sedante entre los medicamentos que sometieron a prueba, sin embargo, ambos tratamientos cumplen con lo esperado para el manejo del dolor irruptivo ayudando al paciente a recuperar su funcionalidad. Es probable que este problema se resuelva al incrementar el tamaño de muestra y realizar un manejo más minucioso de otras variables que podrían modificar el resultado.
CONCLUSIONES
La analgesia reportada en los pacientes tratados con dexmedetomidina y lidocaína es similar, con inicio de acción rápido y cuyo efecto analgésico se mantiene hasta terminada la perfusión. El efecto sedativo de los tratamientos fue muy semejante ambos grupos con menor efecto sedante a largo plazo con el uso de lidocaína, a pesar de ello es posible emplear estos fármacos con cierto margen de seguridad fuera del entorno hospitalario.
Tanto la dexmedetomidina como la lidocaína mejoran la funcionalidad de los pacientes que cursan con dolor irruptivo secundario a canal lumbar estrecho durante los primeros 7 días postratamiento, lo cual se podría traducir en mayor tiempo de analgesia independientemente del tiempo que dure la perfusión intravenosa de estos fármacos.
AGRADECIMIENTOS
Agradecemos la colaboración del personal médico del Hospital General de México, para poder llevar a cabo este trabajo de investigación, así como a los pacientes por su colaboración durante todo el estudio.
CONFLICTO DE INTERESES
Los autores declaran que no tienen ningún conflicto de intereses.
BIBLIOGRAFÍA
- Muriel C, Llorca G. Máster del dolor: Módulo 1. Tema 1. Conceptos generales en dolor. pp. 1-14. Disponible en http://www.catedradeldolor.com/PDFs/Cursos/Tema%201.pdf
- Herrero V, López-González AA, Ramírez Iñiguez de la Torre MV, Capdevila García LM, Terradillos García MJ, Aguilar Jiménez E. Dolor en la población laboral y su interferencia en actividades de la vida diaria. Rev Soc Esp Dolor 2016;23(2):64-74.
- IASP. International Association for the Study of Pain. Classification of chronic pain, second edition (revised). https://www.iasp-pain.org/files/Content/ContentFolders/Publications2/ClassificationofChronicPain/PART_I-C.pdf
- Waterman B, Belmont P, Schoenfeld A. Low back pain in the United State: incidence and risk factors for presentation in the emergency setting. Spine J 2012;12(1):63-70. DOI: 10.1016/j.spinee.2011.09.002.
- Backstrom K, Whitman J, Flynn T. Lumbar spinal stenosis-diagnosis and management of the aging spine. Manual Therapy 2011;16(4):208-317. DOI: 10.1016/j.math.2011.01.010.
- Rosales L, Manzur D, Miramontes V, Alpízar A, Reyes AA. Conducto lumbar estrecho. Medigraphic 2006;4(2):101-10.
- Casser H, Seddigh S, Rauschmann M. Acute lumbar back pain. Dtsch Arztebl Int 2016;113(13):223-34. DOI: 10.3238/arztebl.2016.0223.
- Aréchiga-Ornelas G, Mille-Loera JE, Ramírez Guerrero A. Abordaje multimodal para el manejo del dolor agudo. Revista Mexicana de Anestesiología 2010;33(1):18-21.
- Farrar JT, Messina J, Xie F, Portenoy RK. A novel 12-week study, with three randomized, double-blind placebo-controlled periods to evaluate fentanyl buccal tablets for the relief of breakthrough pain in opioid-tolerant patients with noncancer-related chronic pain. Pain Med 2010;11(9):1313-27. DOI: 10.1111/j.1526-4637.2010.00939.x.
- Smith H. A comprehensive review of rapid-onset opioids for breakthrough pain. CNS Drugs 2012;26(6):509-35. DOI: 10.2165/11630580-000000000-00000.
- Fine PG, Messina J, Xie F, Rathmell J. Long-term safety and tolerability of fentanyl buccal tablet for the treatment of breakthrough pain in opioid-tolerant patients with chronic pain: an 18-month study. J Pain Symptom Manage 2010;40(5):747-60. DOI: 10.1016/j.jpainsymman.2010.02.009.
- McCarberg BH. The treatment of breakthrough pain. Pain Med 2007;8(1):S8-S13.
- Gordon DB, Dahl JL, Miaskowski C, et al. American Pain Society recommendations for improving the quality of acute and cancer pain management American Pain Society quality of care task force. Arch Intern Med 2005;165(14):1574-80.
- Ma K, Jiang W, Zhou Q, Du DP. The efficacy of oxycodone for management of acute pain episodes in chronic neck pain patients. Int J Clin Pract 2008;62(2):241-7.
- Escobar Álvarez Y, Biete i Solà A, Camba Rodríguez M, Gálvez Mateos R, Mañas Rueda A, Rodríguez Sánchez CA, et al. Diagnóstico y tratamiento del dolor irruptivo oncológico: recomendaciones de consenso. Rev Soc Esp Dolor 2013;20(2):61-8.
- Watson M. Back to the future, current trends in breakthrough pain treatments. Indian J Palliat Care 2011;17(1):26-8. DOI: 10.4103/0973-1075.76237.
- Cánovas L, Rodríguez AB, Castro M, Pérez L, López C, Román R. Tratamiento del dolor irruptivo. Rev Soc Esp Dolor 2012;19(6):318-24.
- Ballester I, García S. Dolor oncológico de difícil control y papel del fentanilo intranasal con pectina, tratamiento del dolor irruptivo. Med Paliat 2015;22(1):15-9.
- Carrillo-Torres O, Medina-Hernández P. Entendiendo el concepto de dolor refractario a opioides. Revista Mexicana de Anestesiología 2017;(40):90-102.
- Mato M, Pérez A, Otero J, Torres LM. Dexmedetomidina, un fármaco prometedor. Rev Esp Anestesiol Reanim 2002;49(8):407-20.
- Carrillo-Torres O, Pliego-Sánchez MG, Gallegos-Allier MM, Santacruz-Martínez LC. Utilidad de la dexmedetomidina en diversos contextos en la medicina actual. Revista Mexicana de Anestesiología 2014;37(1):27-34.
- Vadivelu N, Mitra S, Narayan D. Recent advances in postoperative pain management. Yale J Biol Med 2010;83(1):11-25.
- Murillo M. Infusiones de anestésicos locales para el tratamiento del dolor crónico. Dol Clin Ter 2002;I(7):11-6.
- Hernández-Bernal E. Lidocaína intravenosa como anestésico de base en neurocirugía. Revista Mexicana de Anestesiología 2011;34(1):S133-S137.
- Alcántara-Bumbiedro S, Flórez-García MT, Echávarry-Pérez C, García-Pérez F. Escala de incapacidad por dolor lumbar de Oswestry. Rehabilitación 2006;40(3):150-8. DOI: 10.1016/S0048-7120(06)74881-2.
- Roberts SB, Wozencraft CP, Coyne JP, Smith TJ. Dexmedetomidine as an adjuvant analgesic for intractable cancer pain. J Palliat Med 2011;14(3):371-3. DOI: 10.1089/jpm.2010.0235.
- Pasero C. Intravenous lidocaine for acute pain treatment. J Perianesth Nurs. June 2011;26(3):166-9. DOI: 10.1016/j.jopan.2011.03.002.
- Golzari S, Soleimanpour H, Mahmooodpoor A, Safari S, Ala A. Lidocaine an pain management in the emergency department: A review article. Anesth Pain Med 2014;4(1):e15444. DOI: 10.5812/aapm.15444.
- Tanen DA, Shimada M, Danish DC, Dos Santos F, Makela M, Riffenburgh RH. Intravenous lidocaine for the emergency department treatment of acute radicular low back pain, a randomized controlled trial. J Emerg Med 2014;47(1):119-24. DOI: 10.1016/j.jemermed.2012.12.014.
- Hilliard N, Brown S, Mitchinson S. A case report of dexmedetomidine used to treat intractable pain and delirium in a tertiary palliative care unit. Palliat Med 2015;29(3):278-81. DOI: 10.1177/0269216314556923.
- Tremont-Lukast I, Hutson P, Backonja MM. A randomized, double-masked, placebo-controlled pilot trial of extended IV lidocaine infusion for relief of ongoing neuropathic pain. Clin J Pain 2006;22(3):266-71.
- Szmuk P, Farrow-Gillespie A, Sheeran P, Ezri T. The sedative effect of high dose lidocaine. Anesth Analg 2007;104(6):1613; author reply 1613-4.
- Lee SY, Kim TH, Oh JK, Lee SJ, Park MS. Lumbar stenosis: a recent update by review of literature. Asian Spine J 2015;9(5):818-28. DOI: 10.4184/asj.2015.9.5.818.
- Velázquez I. El dolor irruptor, ¿solo oncológico? Rev Soc Esp Dolor 2016;23(1):3-5.
- Daeninck P, Gagnon B, Gallagher R, Henderson JD, Shir Y, Zimmermann C, al. Canadian recommendations for the management of breakthrough cancer pain. Curr Oncol 2016;23(2):96-108.
- Yousefshahi F, Predescu O, Asenjo JF. The efficacy of systemic lidocaine in the management of chronic pain: A literature review. Anesth Pain Med 2017;7(3): e44732. DOI: 10.5812/aapm.44732.




