10.20986/resed.2025.4059/2023
ORIGINAL
Reacciones adversas asociadas con la prescripción de soluciones orales basadas en extractos de cannabis sativa: un estudio de farmacovigilancia post-comercialización
Adverse drug reactions associated with the prescription of oral solutions based on cannabis sativa extracts: a post-marketing pharmacovigilance study
Diana Russi Vergel1
Álvaro Madiedo-Gaviria1
Guillermo Moreno-Sanz2
1Khiron Life Sciences SAS. Bogotá, Colombia
2Khiron Life Sciences Spain. Madrid, España
RESUMEN
Introducción: Al igual que España, varios países latinoamericanos como Colombia, Chile, Ecuador, Argentina, Paraguay y Perú, han autorizado la prescripción de formulaciones orales de extractos de Cannabis sativa para su uso terapéutico como adyuvantes en el manejo clínico de distintas patologías crónicas que cursan con síntomas de dolor. Hasta la fecha, no se han realizado ensayos clínicos en estos países con estos medicamentos basados en extractos de cannabis (MBEC) y la evidencia sobre la seguridad de este tipo de especialidades en etapas poscomercialización es nula.
Pacientes y métodos: En el presente estudio se realizó un análisis de las notificaciones de casos de reacciones adversas a medicamento (RAM) recogidas por el sistema de farmacovigilancia de un establecimiento farmacéutico, con el objetivo de caracterizar el perfil de seguridad de 5 formulaciones orales basadas en cannabis en una cohorte de pacientes peruanos, durante el periodo entre marzo y octubre de 2022.
Resultados: De los pacientes que recibieron tratamiento con MBEC (n = 1060), solo 135 (12,7 %) reportaron al menos una reacción adversa. Las mujeres reportaron significativamente más RAM que los hombres (χ2 = 27,4; p = < 0,001) y la mayor parte de las RAM (77,8 %) ocurrieron en las primeras 4 semanas de tratamiento. La distribución de las RAM asociadas a cada producto fue proporcional a la frecuencia de prescripción de este y no se encontró una mayor incidencia en MBEC que contuvieran delta-9-tetrahidrocannabinol. Las reacciones adversas reportadas más frecuentemente correspondieron a trastornos del sistema nervioso (47,2 %) y trastornos gastrointestinales (17,9 %), los términos preferentes fueron mareo (17,9 %), somnolencia (12,7 %) y boca seca (5,7 %). El 93 % se caracterizaron como “leves” y el 50,2 % como “posibles”.
Discusión: Este estudio representa la primera descripción de reacciones adversas con MBEC en una cohorte de pacientes peruanos en un contexto clínico real y confirma el perfil de seguridad anteriormente reportado para este tipo de preparaciones farmacéuticas.
Palabras clave: Farmacovigilancia, reacción adversa a medicamento, cannabis, cannabinoides, perfil de seguridad, Perú.
ABSTRACT
Introduction: Like Spain, several Latin American countries, such as Colombia, Chile, Ecuador, Argentina, Paraguay and Peru, have authorized the prescription of oral formulations of Cannabis sativa extracts for their therapeutic use as adjuvants in the clinical management of various chronic pathologies with pain symptoms. To date, no clinical trials have been conducted in these countries with these cannabinoid-based medicinal products (CBMPs) and the evidence on the safety of this type of specialties in post-marketing stages is null.
Patients and methods: In the present study, an analysis of case reports of adverse drug reactions (ADRs) collected by the pharmacovigilance system of a pharmaceutical establishment was performed, with the aim of?characterizing the safety profile of 5 oral cannabis-based formulations in a cohort of Peruvian patients, during the period between March and October 2022.
Results: Of the patients who received treatment with CBMPs (n = 1060), only 135 (12.7 %) reported at least one adverse reaction. Women reported significantly more ADRs than men (χ2 = 27.4; P < 0.001) and most of the ADRs (77.8 %) occurred in the first 4 weeks of treatment. The distribution of ADRs associated with each product was proportional to the frequency of product prescription and no higher incidence was found in CBMPs containing Δ9-tetrahydrocannabinol. The most frequently reported adverse reactions corresponded to nervous system disorders (47.2 %) and gastrointestinal disorders (17.9 %), and the preferred terms were dizziness (17.9 %), drowsiness (12.7 %) and dry mouth (5.7 %). Ninety-three percent were characterized as “mild” and 50.2 % as “possible”.
Discussion: This study represents the first description of adverse reactions with CBMPs in a cohort of Peruvian patients in a real clinical setting and confirms the safety profile previously reported for this type of pharmaceutical preparations.
Key words: Pharmacovigilance, adverse drug reactions, cannabis, cannabinoids, safety profile, Peru
Correspondencia
Guillermo Moreno Sanz
Gmoreno@khiron.ca
Recibido: 10-02-2023
Aceptado: 28-04-2024
Russi D, Madiedo A, Moreno-Sanz G. Reacciones adversas asociadas con la prescripción de soluciones orales basadas en extractos de cannabis sativa: un estudio de farmacovigilancia post-comercialización. Rev Soc Esp Dolor. 2024;31(2):91-0
INTRODUCCIÓN
Los preparados farmacéuticos de Cannabis sativa L han sido utilizados históricamente con fines medicinales debido a las propiedades terapéuticas de sus 2 principales compuestos activos, el delta-9-tetrahidrocannabinol (THC) y el cannabidiol (CBD). La cantidad relativa de estos compuestos determina el quimiotipo de los medicamentos basados en extractos de cannabis (MBEC): quimiotipo 1, THC predominante; quimiotipo 2, THC y CBD equipotentes; quimiotipo 3, CBD predominante (1). A pesar de su valor terapéutico, en el año 1961 el cannabis y sus derivados se incluyeron en la categoría I del listado de la Convención Única de Estupefacientes de las Naciones Unidas, disminuyendo considerablemente su uso médico y estudios clínicos relacionados (2,3). En los años noventa, el sistema endocannabinoide emerge como un importante sistema de señalización celular compuesto por: i) 2 receptores acoplados a proteínas G, denominados CB1 y CB2; ii) sus ligandos endógenos, 2 lípidos con actividad señalizadora derivados del ácido araquidónico denominados endocannabinoides, la anandamida (N-araquidoniletanolamida) y el 2-araquidonilglicerol; y iii) las enzimas responsables de la síntesis y degradación de los endocannabinoides, la hidrolasa de amidas de ácido graso y la lipasa de monoacilgliceroles, respectivamente. El sistema endocannabinoide está implicado en la regulación de un amplio rango de procesos fisiológicos ejerciendo un papel regulador en funciones del sistema nervioso central, la cognición y el comportamiento, así como en el ciclo de vigilia y sueño, la función metabólica e inmunológica y la modulación del dolor (3,4). El THC es capaz de unirse a CB1 y CB2 actuando como un agonista parcial, modulando así la actividad de otros sistemas principales de neurotransmisión como son el glutamatérgico, el gabaérgico, dopaminérgico y serotoninérgico (5,6,7). Por otro lado, el CBD no parece unirse al sitio ortostérico de los receptores CB1 y CB2, sino que puede actuar como un modulador alostérico negativo de los mismos (1). El CBD es un ligando “promiscuo” que puede actuar también mediante la modulación de otras dianas moleculares como son el receptor acoplado a proteínas G, GPR55, los canales del receptor de potencial transitorio vaniloide l (TRPV1) (7), como agonista de los receptores serotonérgicos 5-HT1A, o inhibiendo la recaptación de adenosinas, entre otras (1).
Hasta la fecha, se ha autorizado la comercialización de ciertos medicamentos basados en cannabinoides: Epidiolex® para el tratamiento de epilepsias refractarias pediátricas en síndromes de Dravet y Lennox-Gastaut y el complejo de esclerosis tuberculosa en pacientes pediátricos (7); Marinol® y Syndros® para paliar náuseas/vómitos asociados a la quimioterapia y anorexia en pacientes con sida (8,9); Sativex® para tratar la espasticidad en esclerosis múltiple y como analgésico de tercera línea para dolor neuropático (6), y la nabilona (Cesamet®), un análogo sintético del THC para el tratamiento de náuseas/vómitos asociados a quimioterapia (10). También existen otros preparados derivados de cannabis, en diferentes formas farmacéuticas y presentaciones, a las que se pueden acceder con fines terapéuticos, dependiendo de los criterios definidos por las autoridades regulatorias de cada país en cumplimiento de lo establecido en la convención única de narcóticos de Naciones Unidas de 1961.
Perú reguló en 2017 la comercialización del cannabis y sus derivados para fines medicinales (Ley n.o 3081 y Decreto Supremo n.o 005-2019-SA) bajo las siguientes modalidades: i) los medicamentos de plantas medicinales, ii) productos naturales derivados de cannabis de uso en salud (ambos requieren de un registro sanitario emitido por la agencia regulatoria DIGEMID), y iii) las fórmulas magistrales preparadas con extractos de cannabis. Las fórmulas orales no estériles son la única presentación aprobada, ya que la dispensación de sumidades floridas (comúnmente denominados “cogollos”) para inhalación no está contemplada en el reglamento. La dispensación requiere de receta médica común retenida y, en el caso de las formulaciones que contienen THC, de receta médica especial (11). Actualmente, en Perú no existen registros de ensayos clínicos relacionados con MBEC en el Registro Peruano de Ensayos Clínicos (REPEC) y no hay información disponible acerca de su seguridad en fases de postcomercialización que detalle el comportamiento de estos productos en la práctica clínica real. Sin embargo, las comercializadoras deben contar con un sistema de farmacovigilancia que permita evaluar continuamente el balance riesgo beneficio de este tipo de especialidades (11,12) que esté acreditado en buenas prácticas de farmacovigilancia para asegurar la calidad y autenticidad de los datos de seguridad recolectados (13). El propósito general del presente análisis es caracterizar las reacciones adversas asociadas a 5 MBEC en una cohorte de pacientes peruanos a través de las notificaciones individuales recibidas entre marzo y octubre del año 2022 por el sistema de farmacovigilancia de un establecimiento farmacéutico.
MATERIALES Y MÉTODOS
Realizamos una revisión documental en la que se analizaron las notificaciones de casos individuales de sospechas de reacciones adversas a medicamentos (RAM) relacionados con MBEC, reportadas al sistema de farmacovigilancia de un establecimiento farmacéutico a través del programa de soporte a pacientes (PSP) entre marzo y octubre del año 2022.
Recolección y seguimiento de la información
El sistema de farmacovigilancia del establecimiento farmacéutico cuenta con procedimientos y metodologías estandarizadas para garantizar la recolección, procesamiento y custodia de la información de sospechas de RAM con los MBEC de los que es titular, con el objetivo de obtener información de seguridad y evaluar continuamente su perfil riesgo-beneficio. A través del PSP se monitoriza periódicamente a los pacientes que están recibiendo tratamiento con MBEC y se realiza la detección y seguimiento de las reacciones adversas que se puedan presentar con el fin de mantener una farmacovigilancia activa sobre las diferentes formulaciones. El PSP está compuesto por una coordinadora profesional de enfermería y 2 auxiliares de enfermería que son las encargadas de realizar el contacto con los pacientes que utilizan los MBEC, previo consentimiento informado. El modelo de seguimiento se basa en contactos periódicos con el paciente durante los primeros 3-5 días de iniciar el tratamiento, y posteriormente cada 10 días durante los primeros 45 días, durante los cuales se evalúa la aparición de posibles efectos adversos, el cumplimiento de objetivos terapéuticos y la adherencia al tratamiento. El paciente también cuenta con diferentes canales de atención, como correo electrónico y línea telefónica para contactar al PSP cada vez que lo requiera.
Formulario online
Las reacciones adversas detectadas por el programa de soporte a pacientes se notifican al establecimiento farmacéutico a través de un formulario online que contiene los siguientes campos:
Ingreso de los reportes a la base de datos interna
La unidad de farmacovigilancia recibe el reporte proveniente del PSP e ingresa la información a la base de datos interna, la cual se encuentra encriptada y con perfiles de acceso específicos, para garantizar la confidencialidad, y se asigna un código de identificación a cada caso para permitir trazabilidad.
Participantes y MBEC utilizados
Se incluyeron en la revisión a todos los pacientes que recibieron tratamiento con MBEC durante el periodo del estudio. Se introdujeron todas las sospechas de reacciones adversas asociadas a los MBEC durante el periodo de estudio.
Los participantes fueron prescritos con uno de los siguientes MBEC:
Descripción de las reacciones adversas
La codificación de las reacciones adversas se llevó a cabo utilizando el diccionario MedDRA (Medical Dictionary for Regulatory Activities) versión 25.1. Se escogió el término preferente (MedDRA PT) para asignar el nombre a cada signo/síntoma y se clasificó cada término en el sistema órgano afectado correspondiente (MedDRA SOC).
Gravedad de las reacciones adversas
Causalidad de las reacciones adversas
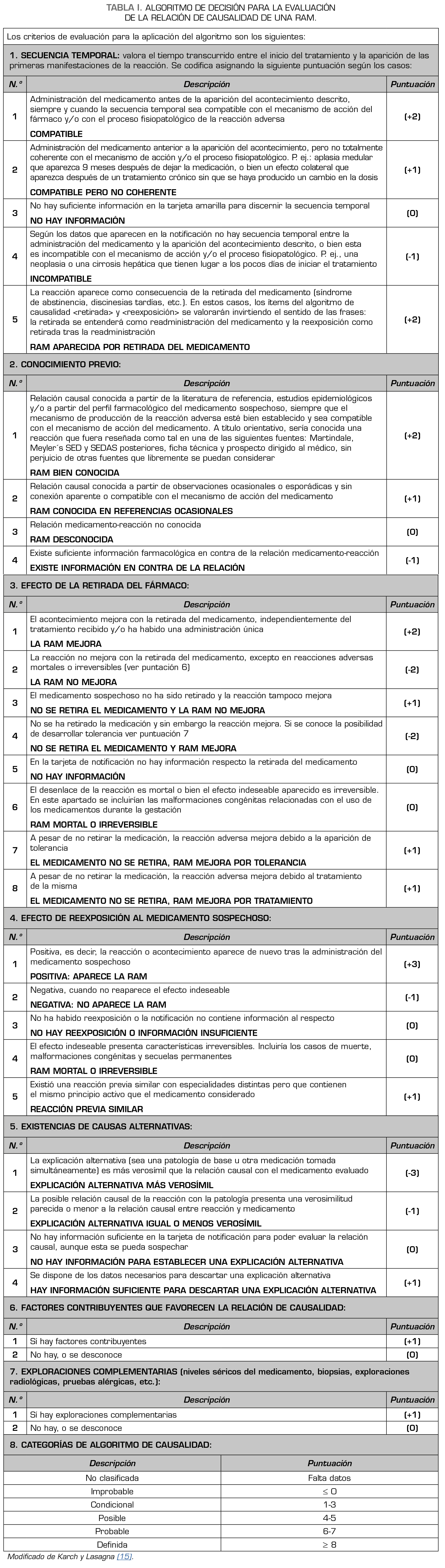
La causalidad de las reacciones adversas a MBEC se evaluó utilizando el algoritmo de Karch y Lasagna modificado Tabla 1 (15) y se clasificó utilizando las categorías de la Uppsala Monitoring Centre (16).

Análisis estadístico
Los datos se obtuvieron a partir de la base de información del sistema de farmacovigilancia del establecimiento farmacéutico. Se utilizaron estadísticas descriptivas para el análisis de los datos demográficos y las reacciones adversas reportadas. Se consideraron las variables de edad y sexo del paciente para el análisis. Para la caracterización de las reacciones adversas se tomaron en cuenta las variables de término preferente (MedDRA PT), sistema órgano afectado (MedDRA SOC), gravedad, seriedad y causalidad. Se calcularon frecuencias absolutas y relativas para las variables cualitativas. Los resultados de edad se expresaron como media ± desviación estándar para la edad. El análisis de correlación entre el género y el tipo de MBEC y la frecuencia de reporte de reacciones adversas se realizó mediante una prueba de chi-cuadrado utilizando el software libre Jamovi V2.2.2 (San Francisco, CA, EE. UU.). Se fijó la significación estadística en un valor de p < 0,05.
RESULTADOS
Datos demográficos
Un total de 1060 pacientes peruanos que recibieron tratamiento con MBEC durante el periodo de marzo a octubre de 2022 fueron incluidos en el análisis. La cohorte presentó un equilibrio en cuanto al sexo con una ligera mayoría de hombres (51,4 %) con respecto a las mujeres (Figura 1A). La frecuencia relativa de prescripción entre los 5 MBEC disponibles fue como sigue: el más utilizado fue el de quimiotipo 2 (FM-002) con un 47,4 %, seguido del quimiotipo 3 (FM-003) con un 29 % del total de prescripciones. Los MBEC de mayor concentración, FM-004 y FM-005, fueron prescritos a un 10,3 % y un 9,3 %, respectivamente. El producto FM-001, el único MBEC de quimiotipo 1 (THC predominante), fue el menos utilizado y representó el 4,1 % de las prescripciones (Figura 1C).

Figura 1. Análisis demográfico de la cohorte de participantes y de los medicamentos basados en cannabis prescritos. A: comparativa entre la distribución por sexos del total de los participantes en el estudio (n = 1060) y de aquellos que reportaron RAM (n = 135); χ2 = 27,4; p < 0,001. B: distribución por edades y sexo de los 135 pacientes que reportaron al menos una RAM asociada al tratamiento con MBEC. C: comparativa entre la distribución de la prescripción de los 5 MBEC utilizados entre la cohorte completa y en el grupo de pacientes que reportaron al menos un RAM; χ2 = 6,62; p = 0,158.
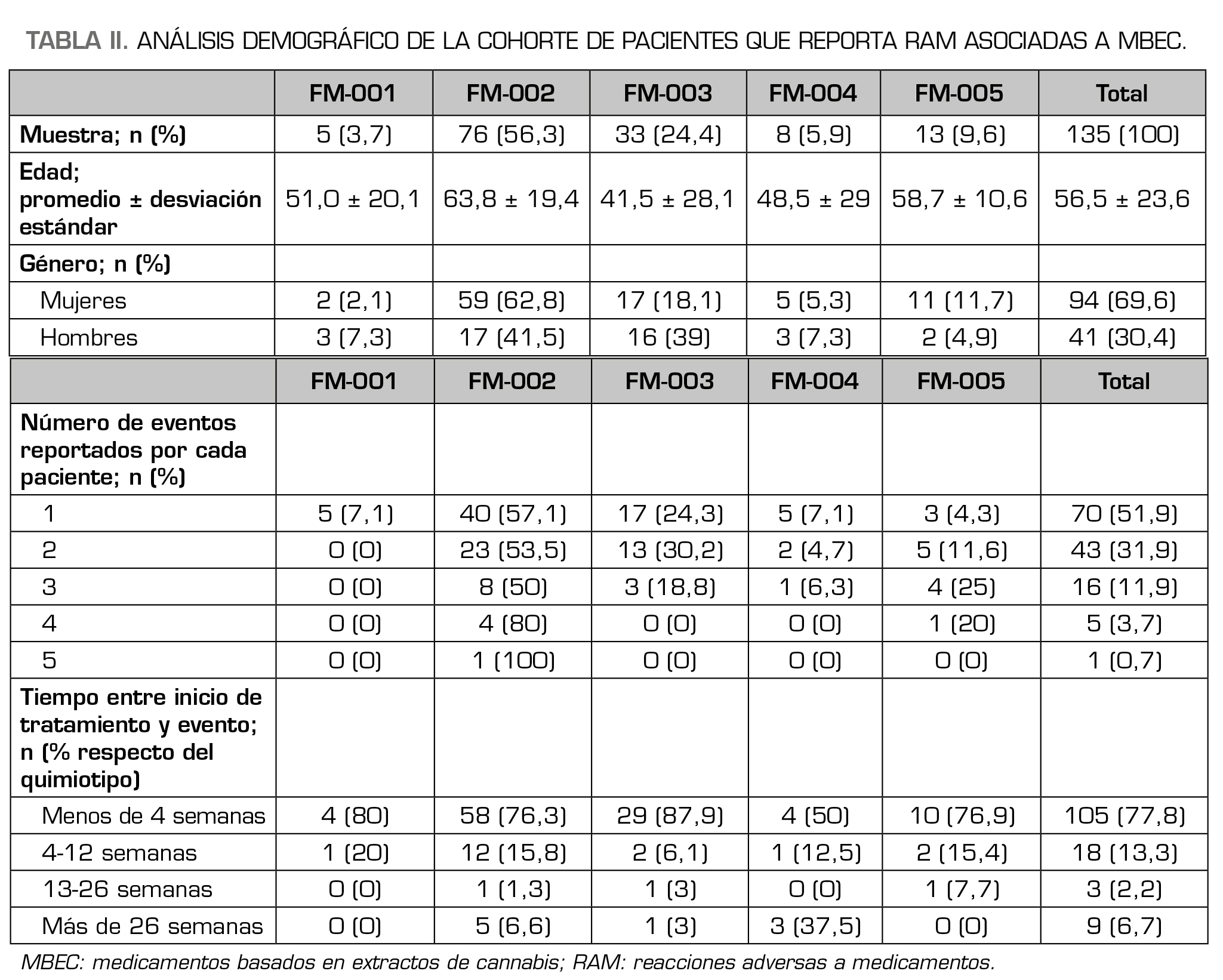
La mayoría de los pacientes (87,3 %) que recibieron tratamiento con MBEC durante el periodo de marzo a octubre de 2022 no informaron reacciones adversas asociadas al tratamiento. Un total de 135 pacientes, el 12,7 % de la de la cohorte, reportaron al menos una reacción adversa. La edad promedio de los pacientes que reportaron reacciones adversas fue de 56,5 ± 23,6 años, cubriendo un rango de entre 4 y 95 años. Como se aprecia en la Figura 1A, las mujeres reportaron significativamente más RAM (69,6 %) en comparación con los hombres (30,4 %; χ2 = 27,4; p < 0,001). La Figura 1B ilustra la distribución por grupos de edad y sexo de los pacientes que reportaron RAM. Dado que los datos de edad provienen del PSP, estos no están disponibles para aquellos pacientes que no reportaron al menos una reacción adversa (n = 925) y no es, por tanto, posible analizar el efecto de la edad sobre el reporte de reacciones adversas. La proporción relativa de prescripción de cada MBEC en toda la cohorte se mantiene en el grupo de pacientes que reportan al menos una RAM (χ2 = 27,4; p < 0,158), lo que parece indicar que las reacciones adversas no dependen de la composición del medicamento (Figura 1C). Un total de 229 sospechas de reacciones adversas fueron reportadas por 135 pacientes (Tabla 2). Cabe destacar que la mitad de estos pacientes (51,9 %) reportaron únicamente una reacción adversa, el 31,9 % reportaron 2 RAM y el 16,3 % reportaron 3 o más RAM. Analizamos también la distribución temporal desde el inicio del tratamiento de las RAM reportadas: el 77,8 % de la población reportó al menos una RAM dentro de las primeras 4 semanas de tratamiento con cannabis medicinal y el 13,3 % entre las 4 y 12 semanas. Solo 9 pacientes reportaron RAM después de 26 semanas de tratamiento. Los tiempos de latencia entre el inicio del tratamiento con las diferentes formulaciones derivadas de cannabis y la aparición de la reacción adversa se especifican en la Tabla 2.
Caracterización de las reacciones adversas
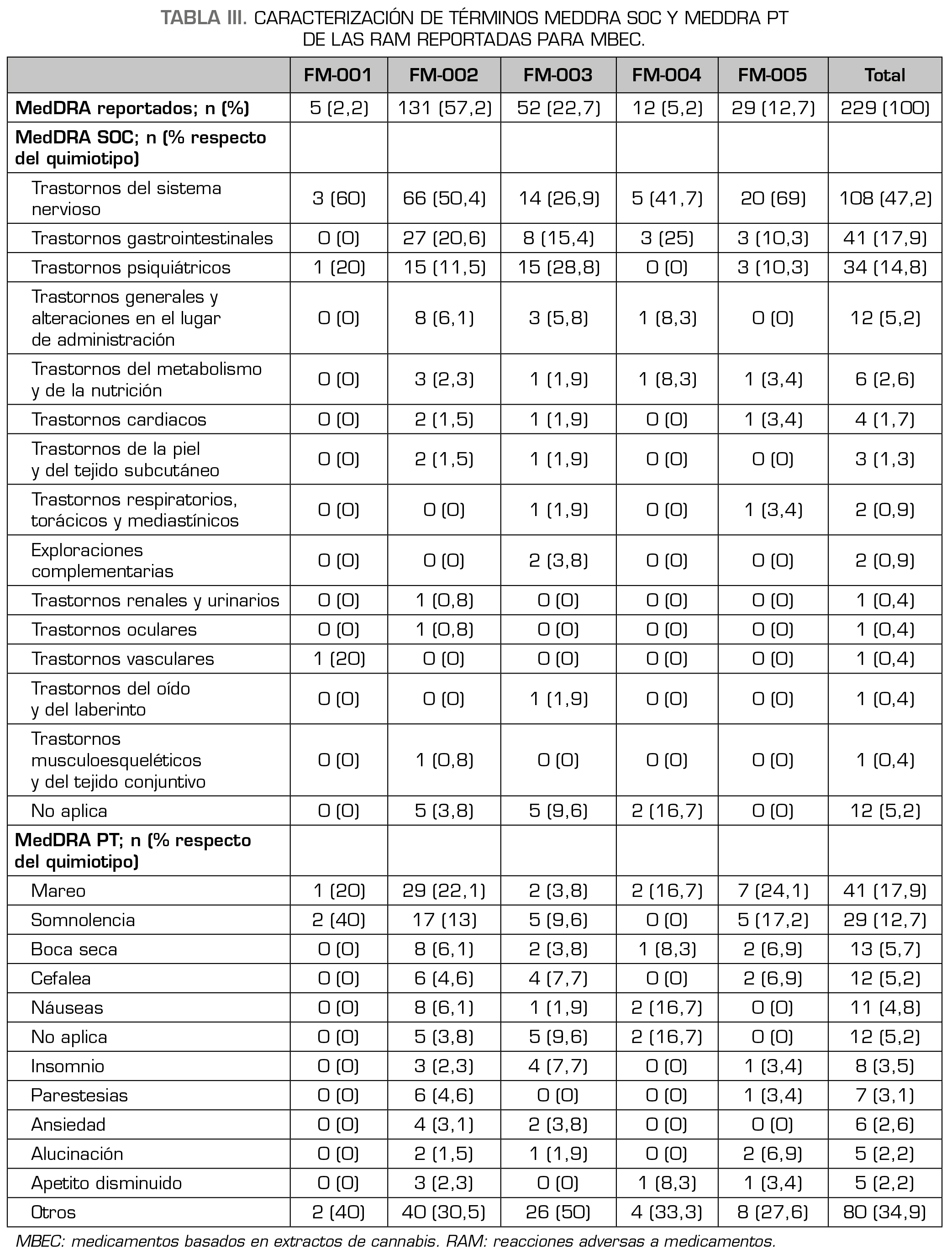
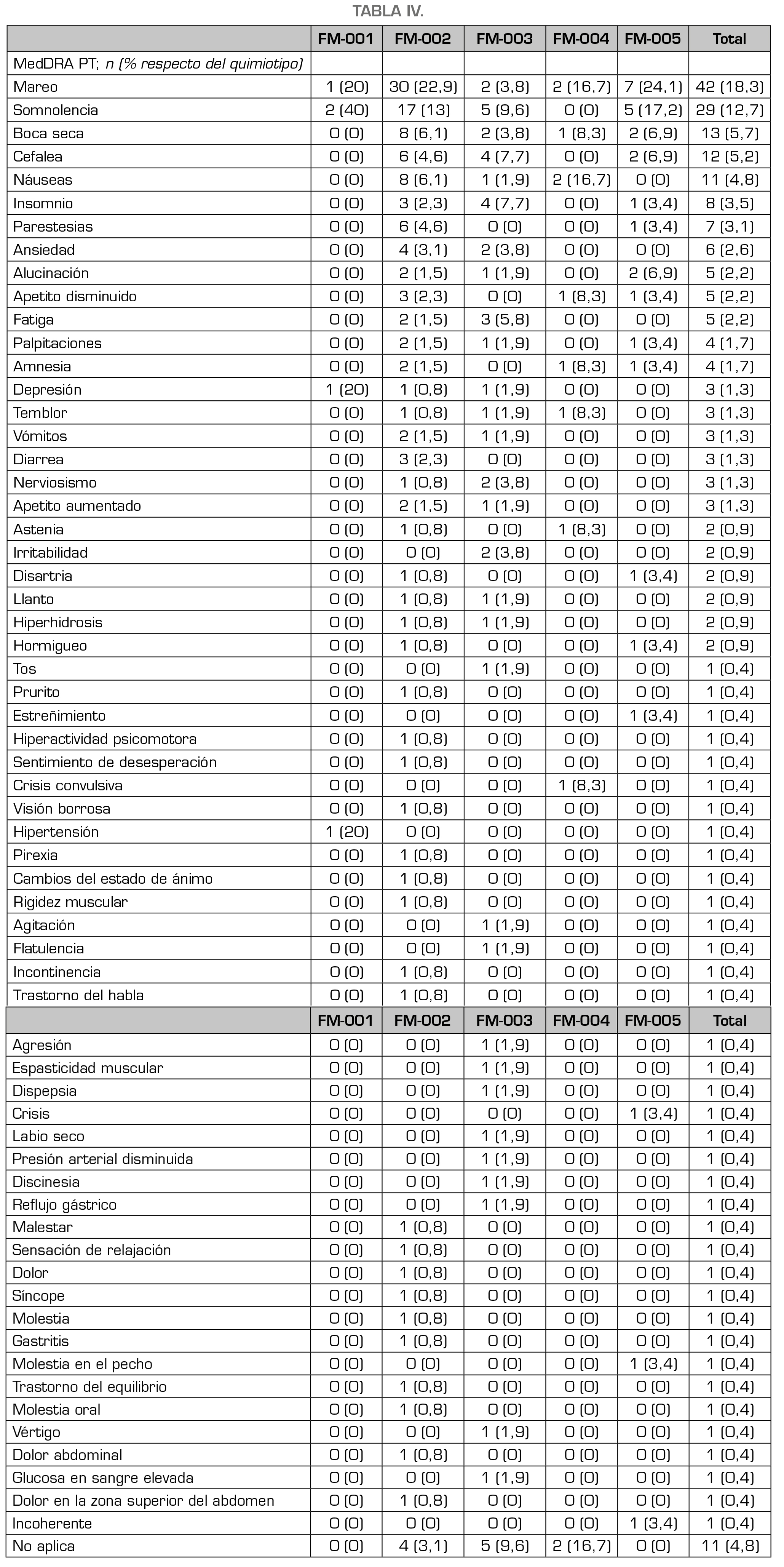
De acuerdo con la clasificación sistema órgano afectado de la terminología MedDRA (MedDRA SOC), las reacciones adversas reportadas más frecuentemente corresponden a trastornos del sistema nervioso (47,2 %), seguido de reaccionas adversas relacionadas con trastornos gastrointestinales (17,9 %) y trastornos psiquiátricos (14,8 %) (Tabla 3). Como cabía esperar, los MBEC de quimiotipos 1 y 2, que contienen una cantidad relativa mayor de THC, FM-001, FM-002 y FM-005, estuvieron relacionados preferentemente con trastornos del sistema nervioso (60, 50,4 y 69 % respectivamente) mientras que representaron el 26,9 % y el 41,7 % de los MBEC de quimiotipo 3 (FM-003 y FM-004, respectivamente). Cabe destacar que el 44,1 % de las RAM de origen psiquiátrico (15 de un total de 34, Tabla 3) estuvieron asociadas al producto de quimiotipo 3, FM-003, que se utiliza típicamente en pacientes con ansiedad generalizada. Las reacciones adversas reportadas con mayor frecuencia según el termino preferente (MedDRA PT) fueron mareo (17,9 %), somnolencia (12,7 %), boca seca (5,7 %). Al igual que en la clasificación anterior, mareo y somnolencia estuvieron preferentemente asociadas a los MBEC que contienen THC, FM-001, FM-002 y FM-005. Las frecuencias absolutas y relativas de todos los PT clasificadas por tipo de formulación se describen en la Tabla 4.
La Tabla 5 recoge la caracterización de las 229 RAM en función de la causalidad y la gravedad de estas. El 50,2 % de los reportes de RAM se clasificaron como posibles, según la evaluación de causalidad, seguido del 19,2 % condicionales y del 16,6 % probables. El 8,3 % de las reacciones adversas se consideraron improbables. En el 0,9 % de los reportes no fue posible la evaluación de causalidad debido a la insuficiencia de los datos en el formulario de notificación, y tampoco se estableció ninguna relación causal definitiva para ninguna de las RAM reportadas. Conforme a los criterios de gravedad estipulados, el 93 % de las RAM se clasificaron como leves, el 1,3 % moderadas y el 0,9 % RAM serias. Estas reacciones serias corresponden a 2 casos relacionados con los MBEC FM-002 y FM-003, respectivamente, y se describen en detalle a continuación. Cabe resaltar que no se evidencian reacciones adversas moderadas en las formulaciones que contienen THC, FM-001, FM-002 y FM-005, ni se informaron reacciones adversas que hayan ocasionado la muerte de algún paciente. El 4,8 % de los términos categorizados como No aplica en la descripción de causalidad y gravedad, corresponden a términos asociados con reportes duplicados, casos descartados y aquellos clasificados como otros problemas relacionados con medicamentos que no constituyen una sospecha de reacción adversa.
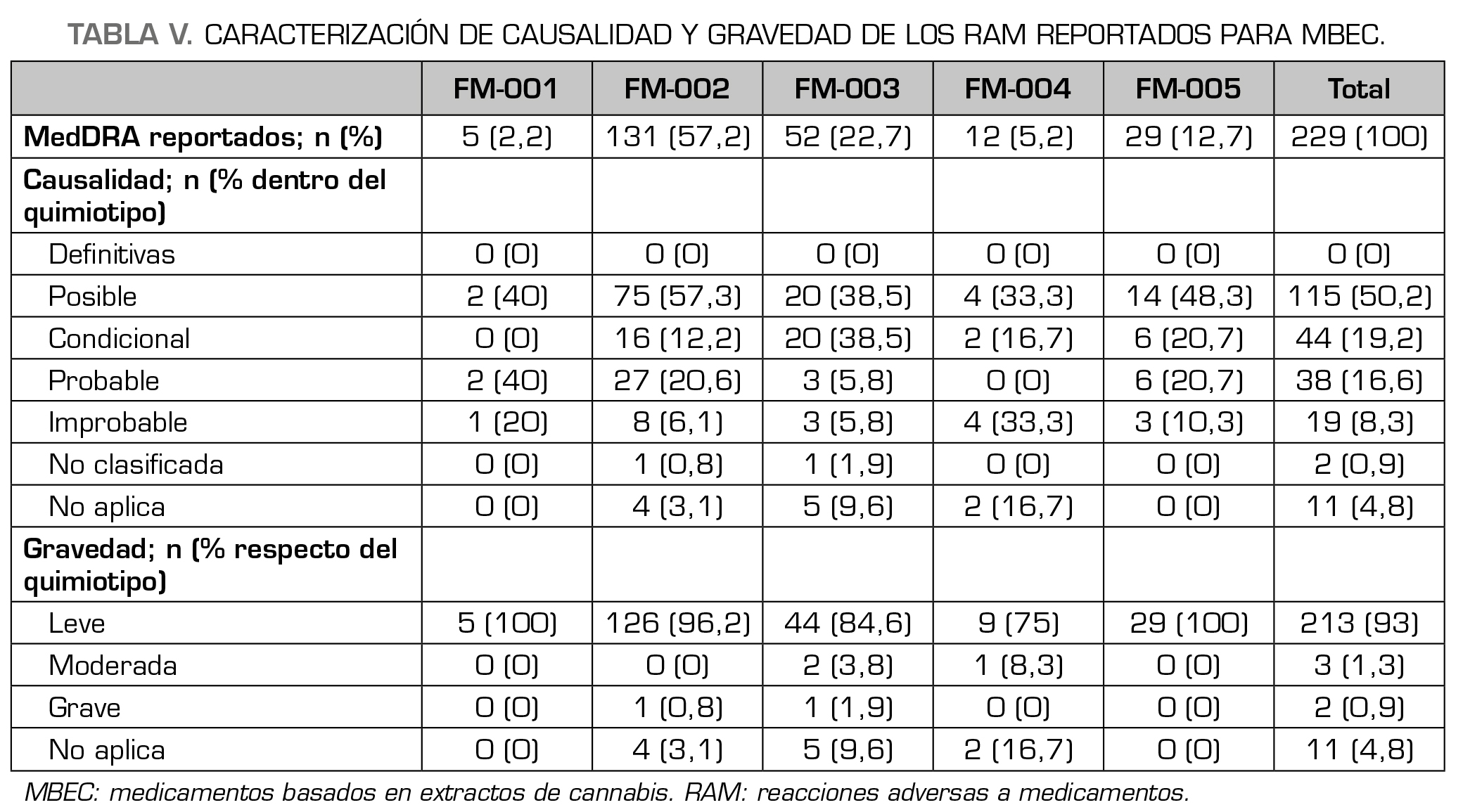
Descripción de reacciones adversas graves/serias
Durante el periodo de estudio se reportaron 2 reacciones adversas serias asociadas con los MBEC más frecuentemente utilizados, FM-002 y FM-003, y que representan un 0,9 % de los términos MedDRA informados:
El primer caso es el binomio vértigo (MedDRA PT)-FM-003, clasificado en el Sistema órgano (MedDRA SOC) Trastornos del oído y del laberinto. Es un paciente masculino de 51 años, con diagnóstico de fibromialgia, peso 74 kg, talla 175 cm, quien reporta antecedentes de tinnitus, no refiere medicamentos concomitantes, en tratamiento con FM-003, indicado para el manejo de dolor, dosis de titulación con la que presentó el evento adverso de 0,3 ml cada 8 h, vía oral; fecha de inicio: 26 de junio de 2022, fecha de suspensión: 3 de julio de 2022. El paciente manifiesta síntomas de desvanecimiento, mareo, visión borrosa, por lo que acude al servicio de urgencias de una institución de salud (fecha de ingreso 3 de julio de 2022, fecha de alta: 4 julio de 2022) en donde realizan manejo farmacológico con dimenhidrinato 50 mg cada 8 h por vía intravenosa. El concepto médico al alta del paciente fue de efecto adverso no especificado a droga o medicamento; derivados de cannabis, recuperado sin secuelas. Paciente suspende tratamiento con CBD. Según el seguimiento realizado con el paciente, posterior al reporte del evento adverso se confirmó que tuvo tratamiento previo con la formulación FM-005 (THC 27 mg/ml; CBD 25 mg/ml) con fecha de inicio 1 de mayo de 2022, el paciente reportó episodio de mareo a su médico tratante quien realiza cambio de esquema farmacológico con FM-003 (THC < 2 mg/ml; CBD 30 mg/ml), con el que presenta el evento adverso. Conforme al análisis causal realizado con el algoritmo Karch y Lasagna modificado, se categorizó como una reacción condicional, ya que la búsqueda bibliográfica no arrojó reportes de este tipo de síntoma en los ensayos clínicos controlados con formulaciones de CBD. Asimismo, el antecedente patológico que refiere el paciente (tinnitus), presenta verosimilitud con el evento adverso reportado.
El segundo caso es el binomio síncope (MedDRA PT)-FM-002. Es un paciente masculino, de 60 años, con diagnóstico de enfermedad de Parkinson, no reporta peso, talla, ni otros antecedentes y medicamentos concomitantes, en tratamiento con FM-002 (THC 12 mg ml, CBD 14 mg/ml), indicado para movimientos anormales, dosis de titulación con la que presentó el evento adverso de 0,2 ml cada 12 h, por vía oral, fecha de inicio 16 de julio de 2022. Familiar reporta que el paciente suspendió el tratamiento derivado de cannabis ya que presentó episodio de pérdida de la consciencia el día 17 de julio de 2022, por lo que estuvo internado 2 días en una institución de salud, donde le informaron que la causa del evento fue derivada del tratamiento con cannabis medicinal, recuperado/ resuelto sin secuelas, al alta. Conforme al análisis de causalidad, se categorizó como una reacción adversa posible. Síncope se referencia en los ensayos clínicos controlados con formulaciones que contienen THC y CBD, con una frecuencia de ≥ 1/1000 a < 1/100 (poco frecuentes) (6); también se han evidenciado reportes en la experiencia posventa con formulaciones principalmente de THC, efecto que se puede presentar al iniciar el tratamiento o al aumentar la dosis de este y es un riesgo que se incrementa en pacientes con trastornos cardiacos (6).
DISCUSIÓN
Los datos disponibles sobre la seguridad de cannabinoides en humanos provienen de estudios clínicos aleatorizados, la mayoría con medicamentos aprobados para su comercialización como Epidiolex®, Marinol®, y Sativex®, entre otros. Hasta la fecha, no se han llevado a cabo estudios rigurosos en materia de seguridad de otras preparaciones farmacéuticas derivadas de cannabis de espectro completo, en gran medida por las diferentes restricciones regulatorias de cada país que han dificultado su acceso y porque se consideran productos relativamente nuevos. Este estudio representa la primera caracterización sistemática de reacciones adversas asociadas a fórmulas orales basadas en extractos de Cannabis sativa en una población peruana, en un contexto de práctica clínica real, desde que el país estableciera en el año 2018 la normativa que regula el acceso a medicamentos basados en cannabis y sus derivados con fines terapéuticos (11).
Los datos de la presente investigación indican que el tratamiento con MBEC fue bien tolerado por la población clínica estudiada, donde solo el 12,7 % reportó al menos una reacción adversa asociada al tratamiento. Pese a que sería razonable especular que la incidencia de las reacciones adversas reflejase una mayor proporción en composiciones que incluyen THC (FM-001, FM-002 y FM-005), la frecuencia de reacciones adversas fue directamente proporcional al patrón de prescripción por quimiotipo. Sin embargo, nuestros datos nos permitieron identificar un sesgo de género, dado que las pacientes mujeres notificaron significativamente más reacciones adversas en comparación con los hombres. Estudios realizados anteriormente por nuestro grupo y por otros investigadores de manera independiente han demostrado dimorfismos sexuales similares que indican que las mujeres son más susceptibles a los efectos neurológicos adversos de los cannabinoides (17).
La mayor parte de las RAM se reportaron en las primeras 4 semanas de tratamiento, lo que también se corresponde con lo reportado en la literatura. Los tratamientos con derivados de cannabis presentan la particularidad de requerir un periodo inicial de titulación de dosis con el objetivo de alcanzar una dosis terapéutica óptima que minimice la aparición de efectos adversos (18). Durante ese periodo, que por lo general es de uno a 3 meses, es más habitual experimentar reacciones adversas esperadas mientras se alcanza la dosis más tolerable para el paciente. Los trastornos del sistema nervioso, trastornos gastrointestinales y trastornos psiquiátricos fueron las categorías reportadas con mayor frecuencia tomando en cuenta el sistema órgano afectado MedDRA (MedDRA SOC). Esto coincide con los resultados de una revisión sistemática de efectos adversos asociados a cannabinoides, donde los trastornos del sistema nerviosos central, gastrointestinales, generales y psiquiátricos, son los principales grupos reportados en los participantes expuestos a cannabinoides en ensayos clínicos controlados (19). En el presente estudio, al tratarse de una base de datos proveniente de un servicio de farmacovigilancia, el historial médico de los pacientes que reportan RAM no se encontraba disponible por lo que no fue posible realizar un análisis por indicación. Sin embargo, en líneas generales, se puede afirmar que los MBEC de quimiotipo 1 y 2 se prescribieron a pacientes con dolor crónico y trastornos neurológicos, mientras que los MBEC de quimiotipo 3 se prescribieron preferentemente en epilepsias pediátricas refractarias (FM-004) y en pacientes adultos con trastornos de ansiedad no especificada (FM-003) (20), lo que podría ofrecer una explicación a la elevada incidencia relativa de los trastornos psiquiátricos observada para el FM-003 (44,1 %, Tabla 3). En cuanto a la clasificación MedDRA PT, mareo, somnolencia y boca seca fueron las RAM no serias reportadas con mayor frecuencia. Una distribución idéntica sereportó recientemente en una cohorte de más de 2000 pacientes colombianos con dolor crónico que recibían tratamiento con los mismos MBEC (21).
Con respecto al análisis de causalidad, el 50 % de las RAM se categorizó como “posible”, lo que significa que en el proceso del análisis se observaron factores adicionales, como las comorbilidades de base y otros medicamentos concomitantes, que pudieran estar relacionados con la aparición de las reacciones adversas, o aquellos efectos adversos que remiten con la continuidad del tratamiento por procesos de tolerancia. El 19,2 % se clasificaron como “condicionales”, ya que se observó una secuencia temporal entre las RAM reportadas y la administración del tratamiento de cannabis medicinal, pero es indispensable obtener más información para garantizar un grado de certeza entre la asociación RAM-medicamento. Estas reacciones normalmente corresponden a efectos adversos que no están ampliamente documentados en los estudios clínicos de cannabinoides, pero que sugieren una relación causal. El 16,6 % de los términos se catalogaron como “probables”, lo que indica una mayor fuerza de la asociación RAM-medicamento, pues son RAM que mejoraron con la suspensión del tratamiento derivado de cannabis. El 8,3 % se clasificaron como “improbables”, ya que posterior al análisis se determinó que los antecedentes del paciente y/o medicamentos concomitantes al momento de presentar la reacción tienen una explicación más verosímil que la administración del tratamiento derivado de cannabis. Finalmente, al 0,9 % se le asignó la categoría “no clasificada”, pues no se contó con la información mínima del reporte para realizar una evaluación apropiada y ninguna RAM fue clasificada como “definitiva”.
Según los criterios de gravedad, la mayoría de los términos MedDRA, corresponden a signos y síntomas clínicamente irrelevantes para el paciente y que remitieron con la continuidad del tratamiento con cannabis medicinal. Asimismo, reportamos 3 reacciones adversas moderadas, que requirieron de la suspensión del tratamiento para observar una mejoría de los síntomas y 2 reacciones adversas graves que generaron la hospitalización del paciente, con posterior recuperación sin secuelas. También se observaron reacciones adversas inesperadas, no serias, en su mayoría asociadas a trastornos del sistema nervioso central como parestesias, temblores, discinesias, espasticidad muscular, entre otras, que no se encuentran recogidas en los diferentes estudios clínicos y fichas técnicas de los medicamentos a base de cannabis aprobados para su comercialización y que sugieren una revisión profunda a fin de realizar un proceso de detección, validación, priorización y evaluación de señales, que permitan caracterizar nuevos riesgos asociados a los MBEC.
CONCLUSIONES
Este estudio representa el primer análisis sistemático de reacciones adversas a medicamentos basados en cannabis en una cohorte de pacientes peruanos en un contexto clínico real. Nuestros resultados confirman que este tipo de especialidades farmacéuticas tiene un perfil de seguridad relativamente alto, donde la mayoría de los efectos adversos corresponden a manifestaciones clínicas leves y tolerables por los pacientes. No se observó ningún caso de reacción adversa mortal que impacte el balance riesgo beneficio de los diferentes MBEC que comercializa el establecimiento farmacéutico. Los hallazgos de nuestra revisión pueden servir para informar la realización de futuras investigaciones que exploren la seguridad de los medicamentos basados en cannabis en las etapas de postcomercialización con el fin de aportar a la toma de decisiones clínicas teniendo en cuenta la falta actual de evidencia científica.
CONFLICTOS DE INTERESES
Los autores del estudio son trabajadores a tiempo completo de Khiron Life Sciences, la empresa que fabrica y exporta a Perú los MBEC investigados. La recogida de datos fue realizada por un operador independiente que gestiona el PSP. Ningún otro ejecutivo o trabajador de la empresa estuvo involucrado en la recogida, análisis o decisión de publicar estos datos.
BIBLIOGRAFÍA