DOI: 10.20986/resed.2020.3789/2019
CARTAS AL DIRECTOR
Metadona intraoperatoria: ¿una isla en la anestesia libre de opioides?
Intraoperative methadone; an island among opioid free anesthesia drugs?
B. Mugabure Bujedo1
1Unidad del Dolor, Servicio de Anestesiología, Reanimación y Tratamiento del dolor. Hospital Universitario Donostia, San Sebastián, España
Correspondencia: Borja Mugabure Bujedo
mugabure@yahoo.es
Sr. Director:
A lo largo de las últimas 4 décadas ha acontecido un gran cambio en las prácticas y hábitos de uso farmacológico entre los anestesiólogos. Hemos pasado de utilizar fármacos intraoperatorios de acción más prolongada como pancuronio, morfina o halotano, a otros de acción más corta como rocuronio, remifentanilo o desfluorano. Todo ello de cara a conseguir una más pronta recuperación tras la anestesia, con un menor bloqueo neuromuscular residual, mejor nivel de conciencia, y sobre todo, abolir la temida depresión respiratoria tardía postoperatoria. Las vías de recuperación después de la cirugía (ERAS) dentro de los modelos de atención multimodal postoperatoria representan una gran oportunidad para que los anestesiólogos administren menos opioides y realicen una analgesia libre (OFA, Opioid Free Analgesia) o reducida (OLA, Opioid Less Anesthesia) de estos fármacos, con el objetivo de disminuir el uso prolongado de estos fármacos en el entorno ambulatorio. En los últimos 15 años, el interés en las vías ERAS ha aumentado mucho, ya que los tiempos de recuperación quirúrgica y las estadísticas intrahospitalarias han sido analizados tanto por los propios médicos como por los administradores para mejorar la autogestión. Aunque el enfoque ERAS para reducir la duración de la estancia hospitalaria es multifactorial e incluye objetivos de manejo para varios parámetros perioperatorios, el manejo del dolor postoperatorio debe ser un área primordial de enfoque final. Los opioides son ampliamente conocidos por tener un perfil de efectos secundarios que ralentiza la recuperación hospitalaria, retrasando tanto el alta hospitalaria como el retorno a la normalidad. Estos efectos secundarios incluyen aumento del estreñimiento, disminución de la motilidad intestinal, íleo, náuseas y vómitos postoperatorios, sedación y delirio. Los anestesiólogos están bien posicionados para influir en el éxito de los protocolos ERAS para el control adecuado del dolor, teniendo herramientas a su disposición para proporcionar una preservación de opioides durante el período perioperatorio (1).
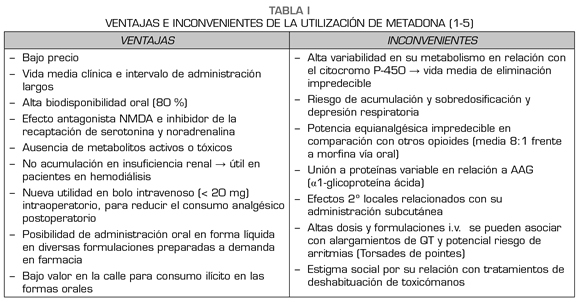
Por todo lo anteriormente expuesto, parece contracorriente el plantear como novedoso el uso de un viejo opioide como la metadona en el intraoperatorio. La metadona fue introducida en la práctica clínica en 1939 en Alemania y es un opioide de síntesis con una vida media de eliminación larga, alrededor de 35 h. Este dato, junto su alta biodisponibilidad oral, la ha convertido en un fármaco de elección en la terapia de deshabituación en pacientes con un trastorno en el consumo de opioides con un éxito de alrededor del 60 %. Asimismo, se ha utilizado como alternativa en la rotación de opioides de pacientes oncológicos, ante la falta de eficacia o presencia de efectos adversos. En este caso, la mayor dificultad reside en el cálculo de la dosis equivalente al opioide basal del paciente, ya que la metadona presenta un ratio analgésico muy amplio frente a morfina, con una media de 8:1 a favor de metadona con dosis diarias inferiores a 60 mg (Tabla I). La metadona es un opioide potente que ejerce un efecto analgésico a través de su acción sobre el receptor opioide mu y del antagonismo de los receptores de N-metil-d-aspartato así como la inhibición de la recaptación de serotonina y noradrenalina. Por ello, tiene propiedades antihiperalgésicas y un buen perfil para prevenir el dolor postoperatorio persistente (2).

En una reciente revisión sistemática con metanáli-sis, el objetivo fue determinar si el uso intraoperatorio de metadona reduce las puntuaciones de dolor postoperatorio y el consumo de opioides en comparación con otros fármacos opioides. Se incluyeron ensayos controlados doble ciego sin restricciones de idioma de MEDLINE, Embase, LILACS, el Registro Cochrane Central de Ensayos Controlados y CINAHL a través de EBSCOhost. Los estudios incluidos hicieron un seguimiento del consumo total de opioides, las puntuaciones de dolor postoperatorio, los efectos secundarios relacionados con los opioides,y la satisfacción de los pacientes hasta 72 h después de la intervención. Se utilizó la diferencia de medias (DM) para medir el tamaño del efecto. En total, se identificaron 476 artículos y 13 se consideraron elegibles para su inclusión en el metanálisis. En 486 pacientes (7 ensayos), el dolor en reposo (DM: 1,09; intervalo de confianza [IC] del 95 %: 1,47-0,72; p < 0,00001) y en movimiento (DM: 2,48; IC del 95 %: 3,04-1,92; p = 0,00001) favoreció la metadona 24 h después de la cirugía. En 374 pacientes (6 ensayos), el dolor en reposo (DM: 1,47; IC del 95 %: 3,04-1,02; p < 0,00001) y en movimiento (DM: 2,03; IC del 95 %: 3,04-1,02; p < 0,00001) favoreció la metadona 48 h después de la cirugía. En 320 pacientes (4 ensayos), el dolor en reposo (DM: 1,02; IC del 95 %: 1,65-0,39; p = 0,001) y en movimiento (DM: 1,34; IC del 95 %: 1,82-0,87; p < 0,00001) favoreció la metadona 72 h después de la cirugía. Se realizó un análisis secuencial de ensayo y la curva acumulativa Z para la metadona cruzó el límite de la monitorización en todas las evaluaciones, cruzando además el tamaño de la información requerida a las 24 y 48 h en reposo. El grupo de metadona también mostró un menor consumo postoperatorio de opioides en dosis equivalentes de morfina (mg) a las 24 h (DM: 8,42; IC del 95 %: 12,99-3,84; p < 0,00001), 24-48 h (DM: 14,33; IC del 95 %: 26,96-1,91; p < 0,00001), 48-72 h (DM, 3,59; IC del 95 %: 6,18-1,0; p = 0,007) después de la operación (3).
Machado y cols. también informaron que las complicaciones postoperatorias no difirieron entre los grupos de metadona y control. No se observaron diferencias entre los grupos en la incidencia de náuseas y vómitos, complicaciones cardiovasculares o eventos respiratorios adversos. De particular preocupación para los anestesiólogos es el potencial riesgo de depresión respiratoria prolongada después del uso de un opioide de acción prolongada. Sin embargo, debido a la rápida redistribución después de una dosis de bolo en el momento de la inducción de la anestesia, la metadona en sangre prevista disminuye por debajo del umbral de la depresión respiratoria (aproximadamente 100 ng/ml) en un plazo de 45 min, ya en un momento en que las vías respiratorias están controladas (4). Además, la administración de metadona intraoperatoria puede atenuar potencialmente el riesgo de depresión respiratoria al disminuir la necesidad de otros opioides postoperatorios. Sin embargo, se debe educar a los cuidadores a todos los niveles para que administren la dosis más baja posible de opioides postoperatorios, a fin de evitar la posibilidad de un efecto depresivo respiratorio aditivo o sinérgico con la dosis intraoperatoria de metadona. Aunque ningún estudio (aleatorizado, observacional o retrospectivo) ha documentado un mayor riesgo de depresión respiratoria o eventos hipoxémicos en pacientes a los que se les administró metadona durante la hospitalización, es importante señalar que la monitorización continua de la frecuencia respiratoria y la oximetría de pulso no se utilizaron en ninguno de los estudios, y ninguna investigación tuvo el poder estadístico adecuado para evaluar estos resultados. Los autores han aportado conclusiones importantes sobre cómo una única dosis de metadona intravenosa (< 20 mg) administrada durante la inducción anestésica mejoraba la puntuación del dolor, tanto en reposo como en movimiento, a las 24, 48 y 72 h postoperatorias, en comparación con opioides de acción más corta. Los efectos beneficiosos sobre el ahorro de opioides de rescate postoperatorios se prolongaron 48-72 h, a pesar de que las concentraciones plasmáticas de metadona fueron inferiores a la mínima concentración analgésica efectiva (31,6 ± 11,1 ng/ml) a partir de las primeras 24 h. Estos hallazgos sugieren que el mecanismo de producción analgésica de la metadona no se limita exclusivamente a su acción sobre el receptor mu opioide, sino que su amplio abanico de acción sobre diversos receptores le hace desempeñar un papel importante en la prevención del dolor crónico y habrá que evaluar en futuros estudios si podrá entrar a formar parte de los programas de recuperación anestésica ERAS.
Se necesitan por tanto, ensayos clínicos adicionales bien diseñados y con un poder estadístico adecuado para evaluar con mayor claridad los beneficios y los riesgos de la metadona perioperatoria (5). Además, antes de que la metadona sea ampliamente adoptada en las prácticas clínicas, hay preguntas adicionales importantes que deben ser abordadas, entre las que se incluyen: ¿Cuál es la dosis que proporciona una analgesia óptima sin inducir eventos postoperatorios adversos?, ¿El riesgo de depresión respiratoria postoperatoria con metadona es mayor o menor que el de los opioides convencionales, especialmente en pacientes con apnea obstructiva del sueño?, ¿La dosificación intraoperatoria mejora la calidad de la recuperación percibida por el paciente y/o reduce el riesgo de desarrollo de dolor postquirúrgico persistente?, y ¿Cuál es el papel de la metadona en el momento actual dentro de los protocolos de recuperación después de la cirugía, especialmente cuando se usa en combinación con otros agentes que ahorran opioides? Las respuestas a las preguntas ayudarán a los anestesiólogos a determinar qué pacientes quirúrgicos obtendrán el mayor beneficio de este opioide único en el entorno perioperatorio.
BIBLIOGRAFÍA