DOI: 10.20986/resed.2018.3695/2018
REVISIÓN
Dexmedetomidina como coadyuvante en bloqueos de nervio periférico
A. Rojas González
Servicio Anestesia y Pabellón. Unidad de Dolor Agudo. Hospital Puerto Montt. Facultad de Medicina. Universidad San Sebastián. Puerto Montt. Chile
Recibido: 27-06-2018
Aceptado: 28-06-2018
Correspondencia: Andrés Rojas González
andresirijillo@gmail.com
ABSTRACT
Introduction: Dexmedetomidine (DEX) is a multifunction drug proposed in recent years as an adjuvant for regional nerve blocks with local anesthetic (LA).
Objetives: to evaluate the analgesic properties of this α-2 agonist when added to LA in different peripheral nerve block approaches (regional anesthesia), in terms of the quality of the analgesia obtained and potential associated complications.
Materials and methods: Narrative review, using MeSH terms (English-Spanish), widely-known search engines, considering the last 5 years to date (among other filters), analyzing systematic reviews, meta-analysis or clinical trials comparing nerve blocks with/without perineural DEX added to long-term LA.
Results: In general terms, it’s observed with this selective α-2 agonist, that the blockade latency decreases -19.16 %, increases analgesia duration + 60,79 % and motor blockade + 54,71 %; decreasing postoperative opioids – 49,54 % and LA consumption – 52,00 %, which would be explained by an intrinsic mechanism at perineural level. Its association with cardiovascular depression and sedation (both transient, reversible and without major clinical consequences) is dose-dependent, recommending 0,5-1 μg/kg perineural (maximum 100 μg).
Conclusions: In terms of risk-benefit, perineural DEX improves the quality of analgesia obtained with minimal associated adverse effects.
Key words: Dexmedetomidine, anesthetics, local analgesia, anesthesia, nerve block.
RESUMEN
Introducción: Dexmedetomidina (DEX) es un fármaco multifunción propuesto en los últimos aéos como coadyuvante para bloqueos regionales con anestésico local (AL).
Objetivos: Evaluar las propiedades analgésicas de este α-2 agonista al adicionarse a AL en diferentes abordajes de bloqueo de nervio periférico (anestesia regional), en términos de calidad de la analgesia obtenida y potenciales complicaciones asociadas.
Materiales y métodos: Se llevó a cabo una revisión narrativa, utilizando términos MeSH (inglés-espaéol), con motores de búsqueda ampliamente conocidos (PUBMED, EMBASE, COCHRANE y LILACS), considerando los últimos 5 aéos a la fecha (entre otros filtros), analizando revisiones sistemáticas, metanálisis o ensayos clínicos que comparasen bloqueos regionales con AL de larga duración con/sin DEX perineural.
Resultados: En líneas generales, al utilizar este α-2 agonista selectivo, la latencia del bloqueo disminuyó – 19,16 %, aumentó la duración de la analgesia + 60,79 %
y bloqueo motor + 54,71 %; reduciendo además consumo de opioides – 49,54 % y anestésicos locales – 52,00%, lo cual se explicaría por un mecanismo de acción intrínseco a nivel perineural. Su asociación a depresión cardiovascular y sedación (ambas transitorias, reversibles y sin mayor repercusión clínica) es dosis-dependiente, recomendándose 0,5-1 µg/kg perineural (máximo 100 µg).
Conclusiones: En términos de riesgo-beneficio, DEX perineural mejora la calidad de la analgesia obtenida con mínimos efectos adversos asociados.
Palabras clave: Dexmedetomidina, anestésicos, locales analgesia, anestesia, bloqueo nervio.
INTRODUCCIÓN
El primer α-2 agonista sintetizado a principios de 1960 fue la clonidina, introducido al mercado farmacéutico como descongestionante nasal. Sin embargo, en 1966 fue recatalogado como antihipertensivo debido al predominio de sus efectos secundarios depresores cardiovasculares y sedantes secundarios.
Dado lo anterior, fue incorporado al arsenal terapéutico de Unidades de Paciente Crítico (UPC) y de Medicina, pero con los aéos, y debido a sus potenciales propiedades analgésicas, se convirtió en herramienta para el manejo anestesiológico de ciertos pacientes, desempeéando a la fecha un papel en el control del dolor, mejorando estabilidad hemodinámica y simpática, y reduciendo náuseas y vómitos postoperatorios (NVPO) (1).
Alrededor de 30 aéos después, en 1999, y tras su aprobación por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), se introduce al mercado un nuevo α-2 agonista más selectivo, la dexmedetomidina (DEX), fármaco orientado principalmente a la sedación/analgesia abreviada de pacientes en ventilación mecánica (2).
Con el pasar de los aéos, su uso se extrapoló al perioperatorio, principalmente como anestésico auxiliar para intubación vigil y sedonalgesia, en especial para aquellos pacientes con alto riesgo de delirio postoperatorio. Ya en el aéo 2004, y tras entender un poco más su mecanismo de acción, se realizaron los primeros estudios de DEX como coadyuvante de anestésicos locales (AL) en bloqueos regionales, esto con el fin último de mejorar la calidad y duración de la analgesia obtenida (3).
El problema de los bloqueos de nervio periférico, los cuales son comúnmente utilizados como analgesia (e inclusive anestesia) sobre todo en cirugías de extremidades, es que si no se utilizan asociados a un catéter de infusión continua, proveen una duración de efecto relativamente corto (4). Es así como en la búsqueda de prolongar la duración del bloqueo monodosis, se han estudiado múltiples coadyuvantes, confirmándose hasta ahora solo las ventajas del uso de epinefrina y dexametasona en este ámbito, aumentando entre un 20-30 % la duración de la analgesia, en especial en bloqueos de plexo braquial, mientras que otros fármacos, como benzodiacepinas, antinflamatorios o la misma clonidina, no han podido demostrar su real efectividad al adicionarse a AL en bloqueos de nervio periférico (5-7).
Dado lo anterior, y conociendo el potencial beneficio analgésico de la DEX, en los últimos 5-10 aéos diversos ensayos clínicos han estudiado su efectividad como coadyuvante perineural en anestesia regional, obteniendo resultados hasta ahora prometedores (8).
El objetivo de este trabajo es entonces, a modo complementario de revisiones sistemáticas y metanálisis que han estudiado el rol de DEX en bloqueos de plexo braquial, evaluar las propiedades analgésicas de este α-2 agonista al adicionarse a AL pero en diferentes abordajes para anestesia regional, esto pues creemos su rol analgésico es independiente del tipo de bloqueo de nervio periférico utilizado.
Para ello, se analizaron críticamente los resultados de las publicaciones encontradas, poniendo énfasis en la calidad de la analgesia obtenida (y potenciales efectos adversos) comparando bloqueos de nervio periférico con y sin DEX como coadyuvante de AL de larga duración.
Declaramos además que la presente investigación no ha recibido ninguna beca específica de agencias de los sectores público o comercial, y se desarrolló sin ánimo de lucro.
METODOLOGÍA
Revisión de tipo narrativa para conocer la efectividad, en términos de calidad de la analgesia obtenida, de bloqueos de nervio periférico con AL de larga duración y la adición o no de DEX como coadyuvante en anestesia-analgesia regional. A pesar de no ser una revisión sistemática (dado se evaluó el desempeéo de este α-2 agonista en diferentes contextos y no uno en particular), se siguieron recomendaciones PRISMA para seguir un orden y transparencia en la presentación de los datos obtenidos y analizados.
Búsqueda bibliográfica
Se utilizaron motores de búsqueda PubMed, Embase, Cochrane y LILACS. Estrategia de búsqueda cruzada, usando términos libres y del encabezado de temas médicos (MeSH en inglés) y su respectiva traducción al espaéol (dexmedetomidine; analgesia; anesthesia; nerve block; brachial plexus block; sciatic nerve; femoral nerve; anesthetics, local; bupivacaine; lidocaine; ropivacaine), operadores booleanos (AND, OR y NOT) y revisión de referencias recomendadas por las mismas publicaciones citadas.
Criterios de selección
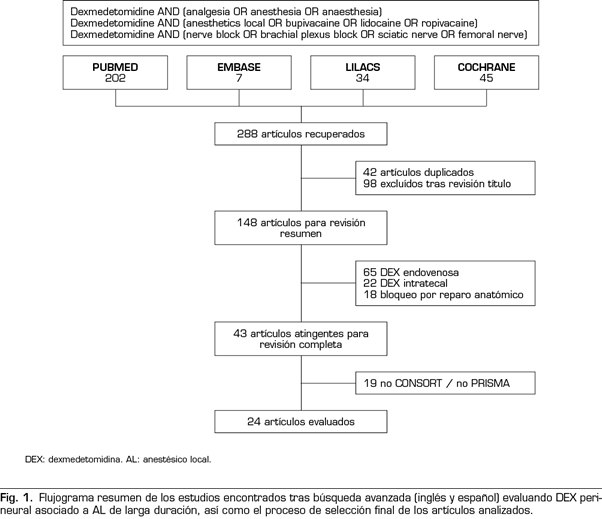
Los criterios aplicados para definir los estudios incluidos para análisis fueron: estudios de revisión sistemática (RS), metanálisis (MA) y ensayos clínicos randomizados (ECR) en anestesia regional, comparando adición de DEX perineural a AL de larga duración (bupivacaína, levobupivacaína o ropivacaína) versus AL larga duración sin DEX ni otro coadyuvante, en cualquier tipo de bloqueo nervio periférico, con ejecución del bloqueo mediante ecografía y/o estimulación de nervio (excluyéndose referencia anatómica por mayor tasa falla). Se excluyeron trabajos que solo usaran DEX perineural, o bien esta se administrara por otra ruta. Tampoco se consideró el bloqueo de Bier. Los trabajos seleccionados debían adherirse a iniciativa PRISMA en caso de ser RS/MA e iniciativa CONSORT en caso de ser ECR. Los pacientes debían ser mayores de 18 aéos, cualquier sexo, aéo publicación del estudio desde 2012 a la fecha (últimos 5 aéos), idioma inglés o espaéol y sin sesgo de publicación. La Figura 1 resume el total de artículos encontrados, así como el proceso de selección utilizado para aquellos estudios incluidos finalmente para análisis.

Recolección de datos
Dado que es un trabajo realizado por un solo autor, se decidió incluir la mayor cantidad de estudios que cumpliesen los criterios de inclusión descritos, extrayéndose los datos de interés para después presentarlos en las tablas anexas. Se buscó dirigidamente para bloqueos de extremidades: tiempo de latencia del bloqueo, duración de la analgesia hasta el primer requerimiento y duración bloqueo motor; para bloqueos centrales, y considerando que la mayoría son bloqueos continuos, se evaluó además consumo de opioides. La información presentada respecto a efectos adversos (hipotensión, bradicardia y sedación) fue tomada directamente de RS/MA consultados, dado que es información ya existente.
PROPIEDADES FARMACOLÓGICAS
La DEX es la forma dextro del enantiómero medetomidina, derivado metilado de la detomidina, agonista de receptores de imidazolina. Presenta una afinidad por receptores α-2:α-1 mucho más específica (1620:1) que su precursor clonidina (200:1), razón por la cual presenta menores efectos adversos que esta última (9).
Su vía de administración es principalmente intravenosa (i.v.), sin embargo, también puede absorberse sistémicamente a través de vía subcutánea (s.c.), así como bucal o intramuscular (i.m.), reportándose para esta última una biodisponibilidad de 104 %. Su latencia aproximada es de 15 minutos, alcanzando peak plasmático en 60 minutos tras infusión continua en dosis sugerida por fabricante (Precedex®; Abbott Labs) de 0,2-0,7 μg/kg/h, con una vida media de eliminación (t½ β) de 120-150 minutos (10).
Su eliminación total del plasma es independiente de la edad, dado ello, dosis similares de infusión pueden usarse en niños y adultos, sin embargo, en mayores de 65 años se ha reportado mayor riesgo de hipotensión y bradicardia (dosis-dependiente), recomendando así una reducción en la dosificación en esta población (11).
Por otra parte, su duración está directamente relacionada con su capacidad de vínculo a la albúmina y glicoproteína α-1, la cual permanece constante a pesar de las diversas concentraciones del fármaco. Dado lo anterior, en personas con disfunción hepática o desnutrición importante, la fracción de vínculo disminuye, aumentando así la fracción libre, debiéndose reducir la dosis también en estos pacientes (12).
Su metabolismo ocurre en el hígado a través citocromo P450, no existiendo metabolitos activos o tóxicos conocidos (los cuales se eliminan en un 95 % por orina), pudiendo usarse con seguridad en pacientes con falla renal (13).
Además, su efecto puede revertirse de manera dosis-dependiente con el antagonista α-2 selectivo atipamezol, sin embargo, este fármaco no está aprobado para uso en humanos, y dado ello, se encuentra habitualmente disponible en el arsenal farmacológico de veterinarias (14).
MECANISMO DE ACCIÓN EN ANESTESIA REGIONAL
Múltiples textos disponibles explican con detalle el funcionamiento de DEX. El receptor adrenérgico α-2 consiste en tres α-2 isoreceptores (α-2a, α-2b y α-2c), los cuales regulan los diversos efectos farmacodinámicos de este fármaco (15). El receptor α-2a pareciese promover la sedación y ansiolisis en el locus coeruleus, así como generar bradicardia y vasodilatación periférica por estímulo del centro vasomotor cerebral. El receptor α-2b anula el temblor, genera analgesia en las astas dorsales de la médula espinal y determina vasoconstricción periférica. El receptor α-2c modula el estado mental.
A nivel de segundo mensajero, y una vez activado cualquiera de estos adrenoreceptores por DEX, se inhibe la adenilato-ciclasa, disminuye la producción de adenosín monofosfato cíclico (AMPc), y se hiperpolarizan las neuronas noradrenérgicas (principalmente presinápticas) mediante la salida de potasio y bloqueo de entrada de calcio en sus terminales.
Este cambio en la conductancia de los iones anula la estimulación del locus coeruleus, astas dorsales y localizaciones extraespinales, disminuyendo así la descarga de las fibras nociceptivas Aδ y C y generando en última instancia el efecto analgésico deseado (16).
En relación con estas localizaciones extraespinales de receptores α-2 señaladas, surge entonces el interés del estudio de la DEX como fármaco coadyuvante en anestesia regional.
Usando ropivacaína 0,5 % con DEX (20 μg/kg) perineural, Brummett y cols. reportaron una prolongación del bloqueo sensitivo y motor del nervio ciático en ratas de 120 a 210 minutos al compararlo a ropivacaína 0,5 % con suero fisiológico (SF) o ropivacaína 0,5 % y DEX subcutánea (p < 0,001), evidenciando además menores efectos sistémicos asociados (17).
Conociendo entonces los beneficios analgésicos de DEX, algunos autores han sostenido que independientemente de su vía de administración (perineural versus i.v.), y debido a su mecanismo de acción central, el consumo de opioides disminuirá y se prolongará la duración del bloqueo sensitivo, sin embargo, existen solo 2 trabajos al respecto que sostienen estos postulados (18-20).
Más recientemente se ha conocido, a través de estudios en ratas con exposición nerviosa directa a diversas combinaciones de medicamentos (entre ellos DEX y ropivacaína), que la instilación de antagonistas α-1 (prazosina) y α-2 (idazoxan) no altera la latencia ni duración del bloqueo sensitivo-motor obtenido con DEX, sin embargo, la aplicación directa en el nervio de forskolina, un agonista de los canales iónicos regulados por nucleótidos cíclicos (Ih), atenuó, de manera dosis-dependiente, el efecto del bloqueo sensitivo-motor al usar la combinación ropivacaina y DEX, no así con ropivacaína con SF, hipotetizando entonces que el agonismo en estos receptores Ih activaría la adenilato-ciclasa, aumentando los niveles de AMPc en el nervio y evitando la hiperpolarización nerviosa, sustrato del funcionamiento de los α-2 agonistas (21,22).
DEXMEDETOMIDINA Y BLOQUEOS DE EXTREMIDAD SUPERIOR
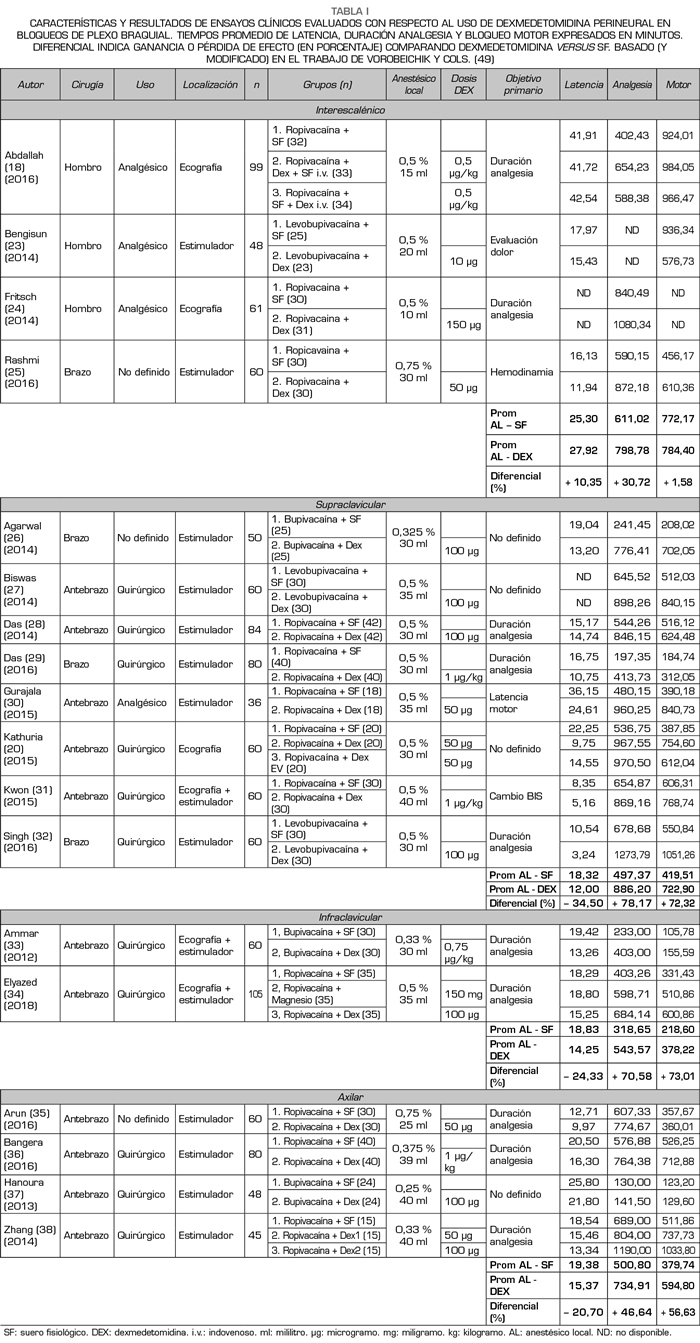
La Tabla I resume los resultados de interés en relación al objetivo primario de este trabajo en el subgrupo de anestesia regional para extremidad superior. En primer lugar, destacar que todos los artículos analizados corresponden a ECR que compararon resultados de bloqueos de nervio periférico con y sin uso de DEX perineural en diferentes abordajes de plexo braquial. En líneas generales, los trabajos analizados son bastante heterogéneos entre sí en cuanto a contexto quirúrgico y metodología anestésica; aun así, la mayoría presentan un nivel moderado-alto en cuanto a calidad de evidencia (según escala GRADE) así como nivel moderado-bajo de sesgo (según escala Cochrane) (18,20,23-38).
Factores importantes a considerar, previo a la interpretación de los resultados obtenidos, son la variabilidad de tipo AL (bupi, levobupi o ropivacaína), así como concentración y volumen utilizado (0,25-0,75 % 15-40 ml),
debido a que es conocida la asociación entre estos factores y la calidad del bloqueo, sobre todo motor.
Tal y como se señaló en la metodología, no se consideraron ensayos cuyo bloqueo se realizase mediante referencia anatómica, sin embargo, también debemos considerar potenciales sesgos al comparar la tasa de éxito de bloqueos realizados mediante neuroestimulación y/o ecografía, impresionando hoy en día como gold estándar el uso de ultrasonido; sin embargo, en nuestros resultados solo 6 autores utilizaron ecografía para el procedimiento (ejecutado por médicos con experiencia según indicaron explícitamente) y, de estos, solo en 2 se complementó con neuroestimulador. El resto de los trabajos confirmaron el bloqueo al obtener una respuesta motora esperada con un estímulo ≤ 0,5 mA. Destacar, además, que sobre el 80 % de estos trabajos fueron realizados en pacientes de 18-65 años, ASA (clasificación de riesgo anestésico para pacientes de la Sociedad Americana de Anestesiólogos) I-II, en el contexto de cirugía traumatológica abierta o artroscópica de extremidad superior (con un evidente componente doloroso asociado).
En términos objetivos, observamos que al utilizar DEX perineural (en dosificación 0,5-1 µg/kg con máximo 100 µg), sin otros coadyuvantes, en bloqueos de plexo braquial con AL de larga duración (e independientemente del tipo de abordaje), la latencia del bloqueo se redujo en promedio un 15,11 % (20,45 a 17,38 minutos), la duración de la analgesia aumentó en promedio un 53,76 % (481,81 a 740,86 minutos) y la duración del bloqueo motor aumentó en promedio un 38,56 % (447,50 a 620,08 minutos) (18,20,23-38).
DEXMEDETOMIDINA Y BLOQUEOS DE EXTREMIDAD INFERIOR
De manera similar a los ensayos clínicos que estudiaron el rendimiento de DEX perineural en extremidad superior, la mayoría de los trabajos analizados en este apartado tenían un nivel moderado en cuanto a calidad de evidencia (GRADE) y sesgo (COCHRANE). Todos los trabajos analizados en este subgrupo se realizaron en mayores de 18 años, ASA I-II y con fin último como analgesia para cirugía traumatológica de rodilla o tobillo (Tabla II) (8,39-43).
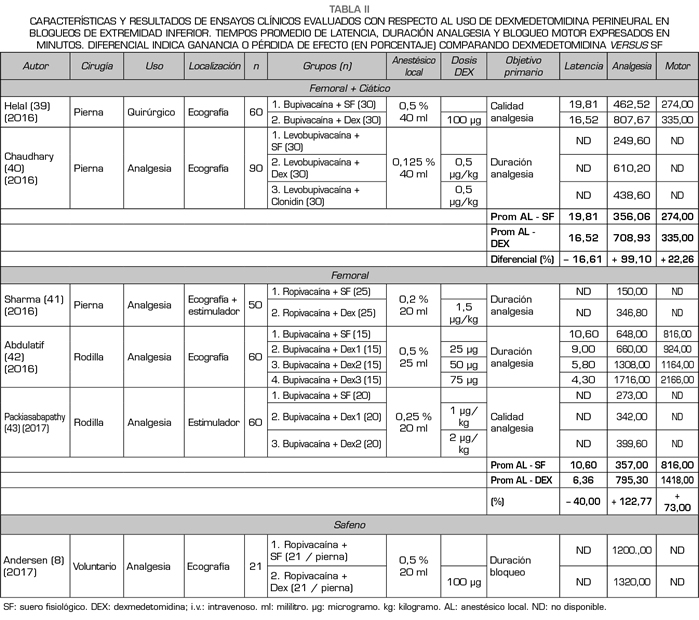
En este apartado es difícil poder establecer una relación directa entre la dosificación de la DEX perineural y la duración de la analgesia tras el bloqueo, pues de los trabajos analizados, en 4 se utilizó de manera concomitante anestesia neuroaxial o general, dado ello, el tipo, concentración y volumen de AL usado posteriormente fue muy variado (0,125-0,5 % 20-40 ml), sumado al hecho de que en algunos de los ensayos se instaló un catéter para bloqueo continuo de nervio periférico, dificultando aún más el poder establecer una correlación tan exacta entre la DEX perineural y el primer requerimiento de analgesia solicitado por paciente (8,39-43).
En términos objetivos, observamos que al utilizar DEX perineural (en dosificación 0,5-2 µg/kg), con AL de larga duración, sin otros coadyuvantes, en bloqueos de extremidad inferior (nervio femoral, ciático y/o safeno), la latencia del bloqueo se redujo en promedio un 41,42 % (15,20 a 8,90 minutos), la duración de la analgesia aumentó en promedio un 67,84 % (487,18 a 834,47 minutos) y la duración del bloqueo motor aumentó en promedio un 107 %
(545,00 a 1132,25 minutos), sin embargo, debemos recordar al interpretar estos resultados, sobre todo con respecto al bloqueo motor, que se usó inicialmente anestesia espinal y/o catéter de bloqueo continuo en varios de los trabajos analizados (40-43).
DEXMEDETOMIDINA Y BLOQUEOS CENTRALES
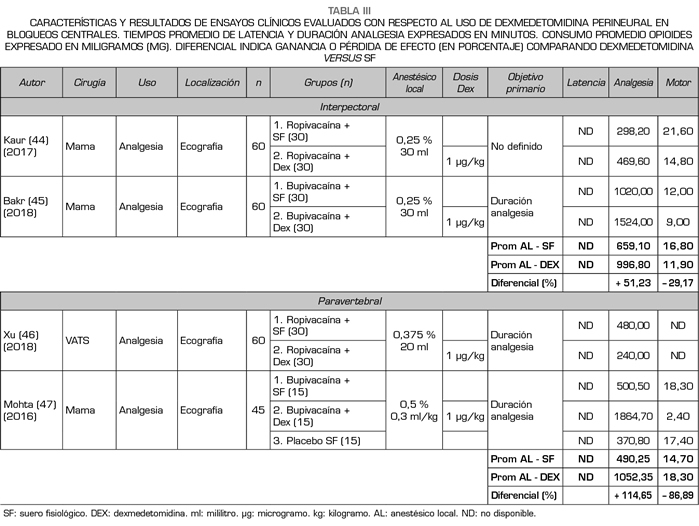
Existe muy poca información disponible con respecto al rendimiento de la DEX perineural adicionado a AL en bloqueos centrales de tronco, no encontrando a la fecha, y en base a la metodología utilizada, más allá de 10-12 ensayos clínicos al respecto. La Tabla III resume los estudios encontrados en base a los criterios metodológicos establecidos (44-47). La mayoría de los ensayos evaluados son de un nivel moderado de calidad de evidencia (GRADE) y sesgo (Cochrane), fueron realizados mayoritariamente en mujeres adultas, ASA I-II, y principalmente en el contexto de mastectomía oncológica (solo el trabajo de Xu y cols. estudió resultados de DEX en bloqueo paravertebral continuo para videotoracoscopia) (46).
Dado que la mayoría de los ensayos clínicos implicaron el uso de anestesia general e instalación de catéter para bloqueo continuo de nervio periférico, no se pudo estudiar adecuadamente los tiempos de latencia y, por ello, no se evaluó este punto en este subgrupo. Considerando los antecedentes previamente expuestos, y con respecto a la duración de la analgesia, observamos que al utilizar DEX perineural (en dosificación 1 µg/kg),
con AL de larga duración (0,25-0,5 % 20-30 ml), sin otros coadyuvantes, en bloqueos interpectorales o paravertebrales, la duración de la analgesia aumentó en promedio un 78,28 % (574,67 a 1024,57 minutos), no estudiándose tampoco compromiso motor dado que son bloqueos esencialmente sensitivos. Sí se evaluó el consumo de opioides de rescate, observándose una reducción promedio de un 49,57 % (17,30 mg de consumo morfina promedio en las primeras 24 horas con AL versus 8,73 mg al adicionar DEX al bloqueo de nervio con AL).
EFECTOS ADVERSOS
La toxicidad local de la DEX perineural ha sido investigada en modelos animales, demostrándose que tanto la mielina como el axón no son afectados tras administrarse este α-2 agonista de manera controlada y directa en dosis altas (20 µg/kg evaluado al día 1 y 14) (17,48,49). A nivel clínico, sin embargo, se ha descrito parestesias por hasta 72 horas en el área de inervación, esto en 2 voluntarios que recibieron 150 µg de DEX perineural junto con 3 ml de ropivacaína 0,75 % en el nervio cubital a la altura codo (brazo no dominante y aplicado mediante ultrasonido) (48).
Con respecto a otros efectos adversos, en la mayoría de los ensayos presentados se ha evaluado dirigidamente el riesgo de depresión cardiovascular y sedación, sin embargo, todos los autores reportan que, en caso de presentarse, dichas complicaciones han sido transitorias y reversibles, no determinando mayor repercusión clínica y, por ende, no requiriendo mayor intervención terapéutica (18,20,22-47).
Según la revisión sistemática de Vorobeichik y cols., del uso de DEX perineural en bloqueos de plexo braquial, el riesgo de complicaciones asociadas aumenta de manera exponencial dosis-dependiente (sobre todo
> 50 µg), reportándose un odds ratio (OR) de 3,3 veces para bradicardia (p < 0,01), hipotensión 5,4 veces
(p < 0,01) y sedación 17,2 veces (p < 0,01), al compararlo con bloqueos con anestésico local exclusivo. En este último punto, debemos destacar la no estandarización en la escala utilizada para la medición de sedación, aun así, no se reportaron eventos hipóxicos asociados (49). Finalmente, el riesgo de NVPO fue bajo y similar en pacientes con bloqueos con y sin DEX perineural (49).
CONCLUSIONES
De los múltiples coadyuvantes utilizados en anestesia regional, y tras analizar diversos estudios, pareciera que DEX perineural mejora la calidad de la analgesia obtenida en base a bloqueos de nervio periférico.
Aun desconociéndose una dosificación óptima de este α-2 agonista en este contexto, impresiona suficiente, en términos de riesgo-beneficio, una dosis de
0,5-1 µg/kg perineural, con un tope máximo de 50-100 µg
según la bibliografía analizada.
Con respecto a sus ventajas, encontramos que, al adicionar DEX a AL de larga duración para anestesia regional, disminuye la latencia del bloqueo (-19,16 %),
aumenta la duración de la analgesia (+ 60,79 %), aumenta la duración del bloqueo motor (+ 54,71 %) y reduce el consumo de opioides (- 49,54 %).
Dentro de sus desventajas están los cambios hemodinámicos y sedación asociada, dosis-dependientes, transitorios, sin mayor repercusión clínica (en poblaciones seleccionadas) y de mínima incidencia utilizando la dosificación previamente señalada (19,49).
Impresiona entonces que los beneficios de DEX perineural sobrepasan a sus riesgos, sin embargo debemos recordar que, a pesar de ser un medicamento conocido, de uso regular en UPC y pabellón, su aplicación en analgesia regional no está aprobada aún en España y otros países, encontrándose a la espera de que ensayos multicéntricos futuros permitan su aprobación en este ámbito por los organismos reguladores pertinentes de cada país.
Es entonces que la decisión de usar este α-2 agonista en bloqueos de nervio periférico dependerá del criterio del algólogo tratante, primando siempre el principio de beneficencia y no maleficencia, sobre todo en poblaciones de alto riesgo cardiovascular, síndrome apnea del sueño, potencial vía aérea difícil y cirugía ambulatoria, cuya recuperación y alta hospitalaria pudiese dificultarse por el aumento del bloqueo motor (mayor riesgo de caídas).
Corresponde así al futuro investigar con mayor detalle la dosificación de este fármaco, ver si se autoriza de manera global su aplicación a nivel perineural, definir si realmente la vía de administración altera o no su efecto clínico y si se modifica con la adición de otros coadyuvantes. Aun así, y en base a los antecedentes presentados, creemos se debe considerar a la DEX perineural como parte del arsenal farmacológico de uso habitual en anestesia regional y control del dolor, sobre todo postoperatorio.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA